一種有效記錄成骨細胞L型鈣通道電流的穿孔全細胞膜片鉗方法*
王文偉,祁小燕,張雪梅(復旦大學基礎醫學院生理與病理生理學系,上海000;復旦大學藥學院藥理學教研室,上海00;Research Center,Montreal Heart Institute,Montreal,Canada)
?
一種有效記錄成骨細胞L型鈣通道電流的穿孔全細胞膜片鉗方法*
王文偉1,祁小燕3,張雪梅2△
(1復旦大學基礎醫學院生理與病理生理學系,上海200032;2復旦大學藥學院藥理學教研室,上海201203;3Research Center,Montreal Heart Institute,Montreal,Canada)
[摘要]目的:探討一種有效記錄成骨細胞L型鈣通道電流的穿孔全細胞膜片鉗方法。此方法使玻璃電極與細胞內液保持電化學連續性,使細胞內環境保持穩定,改善常規全細胞膜片鉗破膜造成的破膜難和封接不穩,以及常規全細胞膜片鉗破膜后造成的封接不穩。方法:以成骨細胞為研究對象,采用β-七葉素穿孔全細胞膜片鉗技術,記錄骨細胞L型鈣通道電流。結果:采用這種穿孔全細胞膜片鉗技術,能有效記錄到成骨細胞上L型鈣通道電流。結論:穿孔膜片鉗技術是一種簡便而有效的記錄全細胞電流的實驗方法,該方法的建立為今后更深入的研究疾病中成骨細胞的病理生理機制提供實驗基礎。
[關鍵詞]骨細胞; L型鈣通道電流;穿孔全細胞膜片鉗;β-七葉素
[修回日期]2015-04-23
Perforated whole-cell patch recording of L-type calcium current with βescin in osteoblasts
WANG Wen-wei1,QI Xiao-yan3,ZHANG Xue-mei2
(1Department of Physiology and Pathophysiology,School of Basic Medical Sciences,Fudan University,Shanghai 200032;2Department of Pharmacology,School of Pharmacy,Fudan University,Shanghai 201203,China;3Research Center,Montreal Heart Institute,Montreal,Canada.E-mail: xuemzhang@ shmu.edu.cn)
[ABSTRACT]AIM: To establish a perforated whole-cell patch-clamp technique with β-escin to record L-type calcium current (ICa,L) in osteoblasts.METHODS: ROS 17/2.8 is a rat osteoblast-like osteosarcoma cell line.β-escin was applied to the pipette solution to permeabilize the cell membrane and the perforated patch recording mode was obtained.RESULTS:β-escin at concentration of 50 μmol/L easily permeabilized the cell membrane and obtained a perforated patch recording mode in 2~7 min.This technique prevented ICa,Lrundown and preserved cytoplasmic signaling pathways.CONCLUSION:β-escin may be used as an alternative ionophore for perforated patch-clamp studies in osteoblasts and results in minimal rundown that could facilitate recordings of ICa,Lin osteoblasts.
[KEY WORDS]Osteoblasts; L-type calcium current; Perforated whole-cell patch-clamp;β-escin
L型鈣通道存在于骨細胞包括成骨細胞[1]和破骨細胞[2]中,激活該通道可以增加骨密度[1],降低骨吸收[3],調節機械力誘導的骨形成[4],調節甲狀旁腺素(parathyroid hormone,PTH)和活性維生素D3對骨鈣平衡的作用[5],在骨重建和骨質疏松等骨疾病中起重要調節作用[6]。膜片鉗是研究L-型鈣通道特性的最主要方法。常規的全細胞膜片鉗方法必須在電極尖端施加負壓以吸破細胞膜,造成電極內液與細胞內液相通,細胞內容物被電極內液稀釋,甚至被吸到電極內而導致細胞內容物丟失,尤其那些維持離子通道活性和信號轉導物質和能量物質如ATP的丟失將嚴重影響細胞功能,L型鈣通道電流(ICa,L)隨記錄時間逐漸減弱的現象(rundown)就是這種記錄方法的缺陷所造成的典型后果[7]。穿孔膜片鉗技術是用具有膜穿孔能力的物質多烯抗生素,這種物質可以在細胞的脂質雙層結構上形成孔道,使電極內液通過這些孔道與細胞內液在電學上相通,且不影響細胞內物質的濃度,保持細胞功能的一種膜片鉗方法。穿孔全細胞膜片鉗有效地避免了細胞內物質的流失,胞質滲漏極為緩慢,可以進行長時間穩定的記錄;同時還具有對細胞損傷小的優點。我們實驗中用的成骨細胞ROS 17/2.8,細胞膜比較厚,很難用負壓吸破,用負壓破膜成功率僅1%。我們用β-七葉素(β-escin)在成骨細胞膜上穿孔,細胞破膜率可以提高至90%,且可以預防記錄過程中ICa,L的衰減現象。
材料和方法
1溶液配制
1.1電極內液100 mmol/L KOH,150 mmol/L HEPES,20 mmol/L EGTA,2 mmol/L CaCl2,2 mmol/L MgCl2,10 mmol/L K2HPO4(pH 7.4)。
1.2含β-escin的電極內液β-escin儲存液(25 mmol/L)配法:將0.0275 g β-escin粉末溶解于1 mL雙蒸水中,分裝,放在棕色瓶中避光保存,可在-20℃保存2周。實驗當天解凍后,將1~2 μL儲存液加入0.5 mL電極內液中(在1.5 mL Eppendorf管中進行),然后漩渦混勻大約1 min。Escin在電極內液中的終濃度為50 μmol/L,因為escin對光敏感,因此Eppendorf管應該用鋁箔包裹。
1.3細胞外液140 mmol/L NaCl,5 mmol/L KCl,20 mmol/L HEPES(pH 7.4)。一旦全細胞封接形成,115 mmol/L BaCl2和20 mmol/L HEPES (pH 7.4)加入上述浴液中,使浴液中Ba2+的終濃度為20 mmol/L,鉀電流則被四乙胺阻斷。
2全細胞穿孔破膜記錄
在沒有正壓的情況下,將電極接近細胞表面,在接觸到細胞膜時,負壓吸引,形成高阻封接,然后放開負壓。連續施加超極化脈沖(-60 mV~-65 mV,10 ms),持續觀察,1~3 min后β-escin對細胞膜進行穿孔,如果電容電流增加,表明孔道逐漸形成,電極內液與細胞內液相通,約5 min內可以獲得低細胞膜串聯電阻的穿孔膜片,待電容電流不再增加,便形成穩定的穿孔膜片鉗記錄模式。
電極內液充灌:玻璃電極(無芯玻璃電極)在拉制機(PC-10,Narishige)上兩步拉制而成,充灌電極液后,尖端阻抗為2~3 MΩ。拉制好的電極先在不含β-escin的電極液中浸約30 s,然后從電極尾部反向充灌含β-escin的電極內液,用手指輕彈電極中部排除尖端氣泡。電極尖端越長,無β-escin電極液的深度越深,則β-escin擴散到電極口處的時間越長,破膜時間也越長,理想的深度是在高阻封接形成數1~2 min β-escin擴散到電極口處。含β-escin電極內液在充灌前要振搖電極內液充灌注射器,使β-escin分子盡量均勻分布。含β-escin電極內液一般使用4~5 h,之后破膜效率會降低,建議4~5 h后更換新鮮的電極內液。
結果
在室溫下,運用β-escin穿孔膜片鉗方法能成功記錄到骨細胞L型鈣通道電流,刺激方案和結果見圖1,隨著電壓的增加,電流逐漸增大,I-V曲線顯示刺激電壓在30 mV左右時電流最大(圖2)。整個記錄過程中無明顯衰減現象。
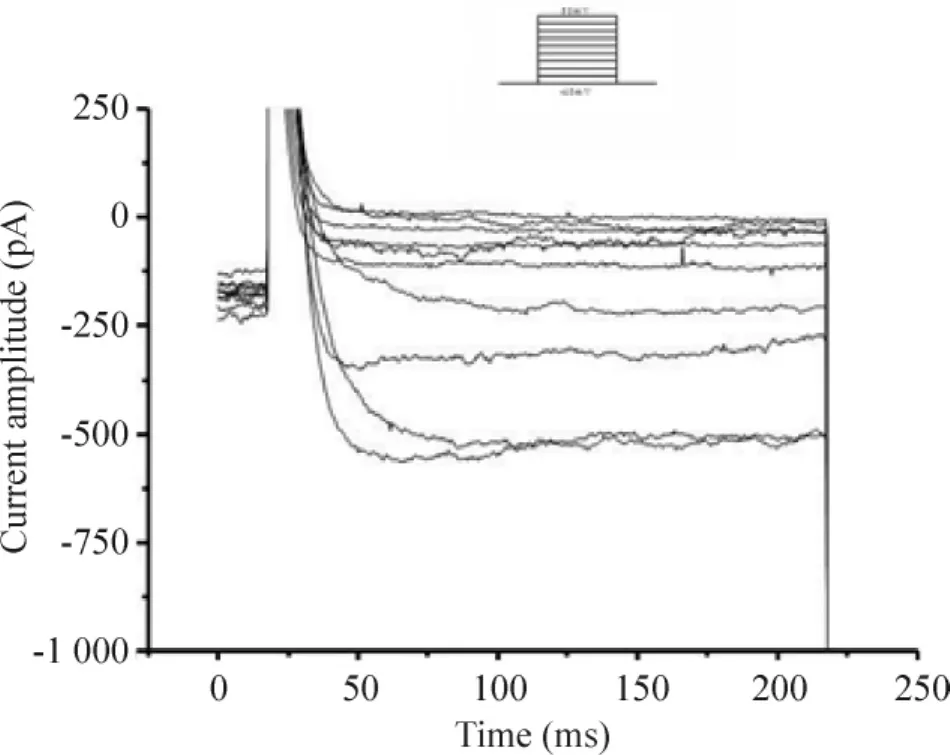
Figure 1.Original recording of L-type calcium currents in osteoblasts.圖1骨細胞膜L型鈣通道電流曲線
討論
穿孔全細胞膜片鉗法特點是不打破電極腔下的細胞膜片,而利用具有膜穿孔能力的物質在細胞膜上形成高離子通透的小孔來構成通電性回路。與全細胞記錄模式相比,穿孔全細胞記錄模式對細胞損傷小,記錄持續時間長。因為不需要打破細胞膜,防止了因負壓吸引或電擊破膜可能對封接產生的破壞,因此封接不容易喪失。
目前常用于膜片鉗技術的膜穿孔物質有制霉菌素和兩性霉素B[8],均難溶于水,充灌不當這2種物質在電極尖端開口處常殘存沒有溶解的顆粒,從而影響高阻封接質量,導致封接成功率降低。兩性霉素B在細胞膜上形成的孔道較小(4~8 nm),僅一價離子可以有效通過,其缺點是Mg2+、Ca2+等多價離子均不能通過細胞膜[9],所以本實驗不用來記錄鈣電流。β-escin在細胞膜上形成的孔道較兩性霉素B大,Ca2+能有效通過,因此能進行Ca2+電流的記錄。在Ca2+激活鉀通道電流SK2的研究中,可以將兩性霉素B與β-escin混合使用進行穿孔膜片鉗記錄[9]。
我們實驗記錄成骨細胞ROS 17/2.8的L-型鈣通道電流,用β-escin作穿孔物質[10]對膜的通透性具濃度依賴性[11],其破膜難易程度與不同種類細胞膜的結構特性有密切關系。王華等[9]的實驗中用心房肌細胞,高濃度β-escin孔道形成早,會影響封接而不能形成有效的記錄模式。在骨骼肌細胞,推薦濃度為20~50 μmol/L β-escin[10]。我們實驗中所用的ROS 17/2.8成骨細胞比心肌、平滑肌和骨骼肌更不易破膜,20 μmol/L時的破膜成功率僅約10~20%,35 μmol/L成功率約50%,當提高到50 μmol/L時成功率可達到90%,而且記錄穩定持續1~2 h,無明顯衰減現象[12]。該方法的建立為今后更深入地研究疾病中骨細胞的病理生理機制提供了一種可靠而有效的實驗方法。
[參考文獻]
[1]Guggino SE,Lajeunesse D,Wagner JA,et al.Bone remodeling signaled by a dihydropyridine- and phenylalkylamine-sensitive calcium channel[J].Proc Natl Acad Sci U S A,1989,86(8) : 2957-2960.
[2]Teti A,Grano M,Colucci S,et al.Voltage dependent calcium channel expression in isolated osteoclasts[J].Boll Soc Ital Biol Sper,1989,65(12) :1115-1118.
[3]Ritchie CK,Maecklein PB,Fitzpatrick LA.Direct effect of calcium channel antagonists on osteoclast function: alterations in bone resorption and intracellular calcium concentrations[J].Endocrinol,1994,135(3) :996-1003.
[4]Zanello LP,Norman A.1α,25(OH)2vitamin D3actions on ion channels in osteoblasts[J].Steroids,2006,71 (4) :291-297.
[5]Li J,Duncan RL,Burr DB,et al.Parathyroid hormone enhances mechanically induced bone formation,possibly involving L-type voltage-sensitive calcium channels[J].Endocrinol,2003,144(4) :1226-1233.
[6]王連唐,劉子君,鄭銘豪.骨破骨細胞生物學研究的一些進展[J].中國病理生理雜志,1997,13(6) : 746-750.
[7]Horn R,Korn SJ.Prevention of rundown in electrophysiological recording[J].Methods Enzymol,1992,207: 149-155.
[8]Akaike N,Harata N.Nystatin perforated patch recording and its applications to analyses of intracellular mechanisms [J].JPN J Physiol,1994,44(5) :433-473.
[9]王華,李濤,雷明,等.二性霉素B與β-escin混合穿孔電極液在人心房肌細胞SK2電流記錄中的應用[J].中國應用生理學雜志,2012,28(3) :214-218.
[10]Fan JS,Palade P.Perforated patch recording with beta-escin[J].Pflugers Arch,1998,436(6) :1021-1023.
[11]Fu LY,Wang F,Chen XS,et al.Perforated patch recording of L-type calcium current with beta-escin in guinea pig ventricular myocytes[J].Acta Pharmacol Sin,2003,24(11) :1094-1098.
[12]Li F,Wang W,Gu M,et al.L-type calcium channel activity in osteoblast cells is regulated by the actin cytoskeleton independent of protein trafficking[J].J Bone Miner Metab,2011,29(5) :515-525.
通訊作者△Tel: 021-51980046; E-mail: xuemzhang@ shmu.edu.cn
*[基金項目]國家自然科學基金資助項目(No.81370979)
[收稿日期]2015-01-30
[文章編號]1000-4718(2015)06-1150-03
[中圖分類號]R33-33; R363
[文獻標志碼]A
doi:10.3969/j.issn.1000-4718.2015.06.033

