鋁片包裹氯化銀置換法回收銀
曹夢竺,王 琪,葛明敏,周全法
(1. 徐州生物工程職業技術學院 生物系,江蘇 徐州 221006;
2. 江蘇理工學院 江蘇省貴金屬深加工技術及應用重點建設實驗室,江蘇 常州 213001)
綜合利用
鋁片包裹氯化銀置換法回收銀
曹夢竺1,王 琪2,葛明敏2,周全法2
(1. 徐州生物工程職業技術學院 生物系,江蘇 徐州 221006;
2. 江蘇理工學院 江蘇省貴金屬深加工技術及應用重點建設實驗室,江蘇 常州 213001)
將含銀廢液中的Ag+轉化為AgCl,再用鋁片包裹AgCl固體,在Na2CO3溶液中采用置換法回收銀。考察了各反應條件對AgCl還原為銀的轉化率的影響。實驗結果表明,適宜的反應條件為:Na2CO3溶液質量分數20%,反應溫度40 ℃,反應時間20 h,不攪拌靜置反應。在此適宜的反應條件下,AgCl還原為銀的轉化率為95.32%。
銀回收;鋁片;置換;氯化銀
從含銀廢棄物中回收銀的方法很多,如火法[1]、濕法[2-7]、生物法[8]和電解法[9]等。用活潑金屬粉末或顆粒(如鋅粉、鐵粉等)置換含銀廢液中的銀是最常用的銀回收方法,但反應混合物中未反應的活潑金屬粉末或顆粒與還原得到的銀粉混雜在一起,還需要再用鹽酸溶解以除去活潑金屬[10]。
本工作先將含銀廢液中的Ag+轉化為AgCl,再用鋁片包裹AgCl固體,在堿性環境下采用置換法回收銀。探討了各反應條件對AgCl還原為銀粉的轉化率的影響,優化了反應條件。
1 實驗部分
1.1 試劑、材料和儀器
NaCl、硝酸、鹽酸、無水Na2CO3:分析純。將純鋁片修剪后置于1 mol/L 的鹽酸中,待鋁片表面有大量氣泡產生時取出,用去離子水洗滌,干燥后隔絕空氣,備用。
HH-S1型數顯恒溫水浴鍋:金壇市醫療儀器廠;FA1204B型分析天平:上海精密儀器儀表有限公司。
1.2 實驗方法
將含銀廢液置于燒杯中,加入過量的NaCl溶液,充分攪拌,靜置,減壓過濾,用0.01 mol/L 的稀硝酸洗滌沉淀2~3次,再用約40 ℃的去離子水洗滌至中性,減壓過濾,得到近干燥的AgCl固體,測定銀含量。
稱取一定質量(m,g)的上述AgCl固體,用處理后的鋁片包裹并壓緊,置于燒杯中。緩慢加入一定質量分數的Na2CO3溶液至浸沒AgCl包裹物,在一定的反應溫度下或攪拌反應或靜置反應一定時間;取出鋁片包裹物并打開,用0.01 mol/L的稀鹽酸和去離子水分別洗滌鋁片表面3次,洗滌液并入反應后混合物中,過濾,濾渣為反應生成的粗銀粉和未反應的AgCl。
取1 g濾渣,加入一定量的8 mol/L的硝酸,充分攪拌后,靜置,置換反應生成的銀粉以Ag+的形式存在于溶液中。過濾,將濾液定容至一定體積(V1,mL)。取一定體積(V2,mL)的上清液,測定銀含量。
1.3 分析方法
采用佛爾哈德法[11]測定溶液中的銀含量:指示劑為硫酸鐵銨飽和溶液,滴定劑為一定濃度(c,mol/L)的硫氰酸銨標準溶液。臨近滴定終點時,激烈振蕩30 s,粉紅色不褪即為滴定終點,消耗硫氰酸銨標準溶液的體積為V3(mL)。
AgCl轉化率(r,%)的計算式如下:r = 107.87c V1V3/(1000 m V2)
式中:107.87為銀的摩爾質量,g/mol。
2 結果與討論
2.1 還原金屬的選擇
用金屬還原AgCl的過程是一個電化學反應過程。從電極電勢上看,反應體系中加入鐵、鋅、鋁、銅、鈷、鎘、銻等均可以還原AgCl中的銀。相比常用的鐵、鋅等,鋁的還原性更強,其在堿性介質和酸性介質中的氧化還原電極電位分別為-2.33 V和-1.66 V,且鋁是一種更常見和易得的廉價金屬。故本實驗采用鋁作為還原金屬。
2.2 攪拌對AgCl還原為銀粉的轉化率的影響
攪拌與否對Na2CO3溶液中AgCl的還原效果有較大的影響。在Na2CO3溶液質量分數為20%、反應溫度為40 ℃、反應時間為20 h的條件下,采用電磁攪拌時,AgCl還原為銀粉的轉化率僅為60%左右;而不采用電磁攪拌時,AgCl還原為銀粉的轉化率高達95%。這是因為:靜置反應能使鋁片與AgCl之間更充分地接觸,鋁失去電子變成離子,AgCl得到電子而析出單質銀,單質銀又可作為導體,將鋁放出的電子傳遞給周圍的AgCl,加快了反應速率;而攪拌會破壞反應中AgCl的緊密性,不利于還原反應中電子的相互傳遞,不利于AgCl中銀的還原,影響轉化率。故本實驗選擇不攪拌的靜置反應。
2.3 Na2CO3溶液質量分數對AgCl還原為銀粉的轉化率的影響
在反應溫度為25 ℃、靜置反應時間為40 h的條件下,Na2CO3溶液質量分數對AgCl還原為銀粉的轉化率的影響見圖1。
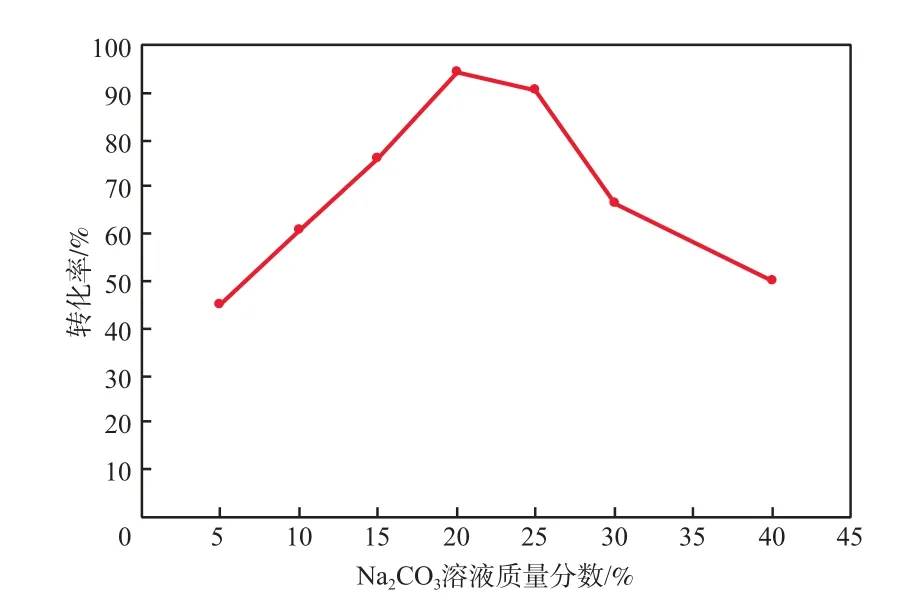
圖1 Na2CO3溶液質量分數對AgCl還原為銀粉的轉化率的影響
由圖1可見:隨Na2CO3溶液質量分數的增加,AgCl還原為銀粉的轉化率先增加后降低;當Na2CO3溶液質量分數為20%時,AgCl還原為銀粉的轉化率最高,達94.24%。這是因為,Na2CO3在水溶液中發生水解反應,隨Na2CO3溶液質量分數的增加,溶液的堿性增強,鋁轉化為AlO2-,在溶液中形成無數個鋁-銀原電池反應,加速了鋁的溶解和銀的析出。當Na2CO3溶液質量分數過高時,易產生氫氧化鋁沉淀,AgCl還原為銀粉的轉化率下降。本實驗適宜的Na2CO3溶液質量分數為20%。
2.4 靜置反應時間對AgCl還原為銀粉的轉化率的影響
在反應溫度為25 ℃、Na2CO3溶液質量分數為20%的條件下,靜置反應時間對AgCl還原為銀粉的轉化率的影響見圖2。
由圖2可見:隨靜置反應時間的延長,AgCl還原為銀粉的轉化率增加;當靜置反應時間為20 h時,AgCl還原為銀粉的轉化率最高,達94.35%;但靜置反應時間超過20 h后,AgCl還原為銀粉的轉化率基本不再變化。這是因為:隨靜置反應時間的延長,溶液中AlO2-的濃度增加,有利于電化學反應的進行;;但靜置反應時間超過20 h后,溶液中AlO2-的濃度保持穩定,且隨著鋁的溶解,反應后殘余的鋁片較小,不易分離,增加了粗銀粉去除雜質的難度。故本實驗適宜的靜置反應時間為20 h。
2.5 反應溫度對AgCl還原為銀粉的轉化率的影響
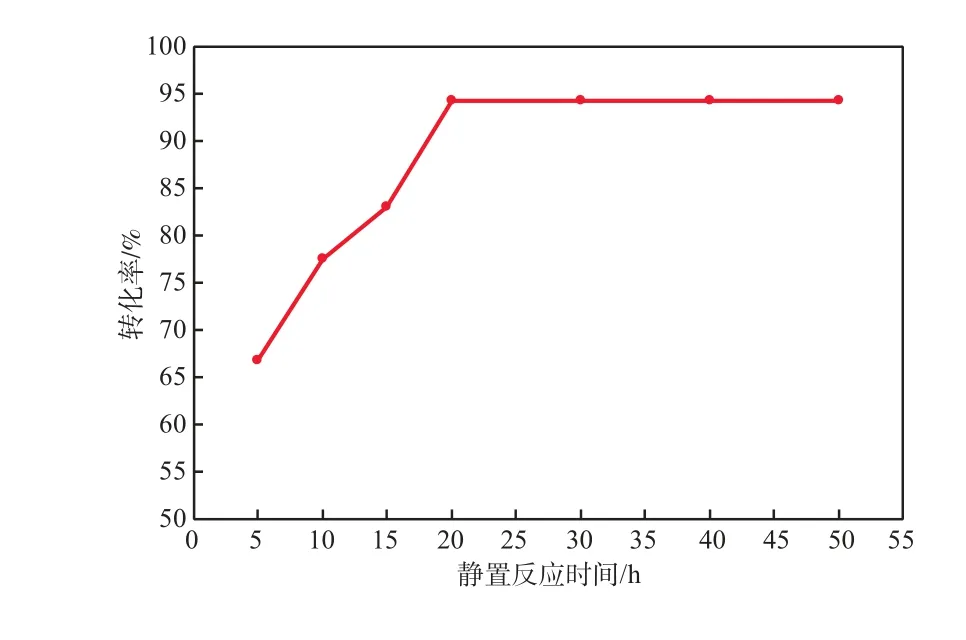
圖2 靜置反應時間對AgCl還原為銀粉的轉化率的影響
在靜置反應時間為20 h、Na2CO3溶液質量分數為20%的條件下,反應溫度對AgCl還原為銀粉的轉化率的影響見圖3。
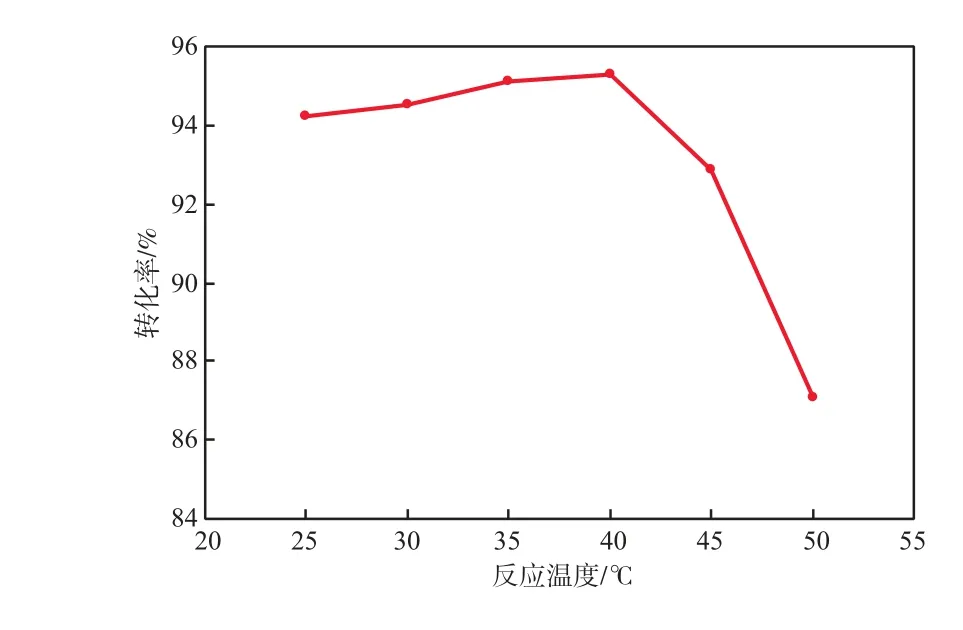
圖3 反應溫度對AgCl還原為銀粉的轉化率的影響
由圖3可見:隨反應溫度的升高,AgCl還原為銀粉的轉化率逐漸增加;當反應溫度為40 ℃時,AgCl還原為銀粉的轉化率最高,達95.32%。這是因為:反應溫度升高,加快了反應速率,有利于水解反應和電化學反應的進行;但反應溫度過高時,AgCl會變得疏松,不利于還原反應中的電子傳遞。故本實驗適宜的反應溫度為40 ℃。
3 結論
a)先將含銀廢液中的Ag+轉化為AgCl,再用鋁片包裹AgCl固體,在Na2CO3溶液中采用置換法回收銀。
b)適宜的反應條件為:Na2CO3溶液質量分數20%,反應溫度40 ℃,反應時間20 h,不攪拌靜置反應。在此適宜的反應條件下,AgCl還原為銀粉的轉化率為95.32%。
[1] Childress V W. Scrap Metal Recycling[J]. Technol Teach,2008,67(5):13 - 17.
[2] 魏劍英,韓周祥,趙瑪,等. 從廢感光膠片中回收銀[J]. 化工環保,2006,26(2):133 - 135.
[3] 韓蘭英,李祚華,劉林海. 從氯化銀及含銀廢液中回收硝酸銀的研究[J]. 上饒師范學院學報,2012,32(6):53 - 56.
[4] 畢建洪,尤亞華. 用鋁還原含銀廢水中硫化銀回收試劑級硝酸銀的研究[J]. 合肥工業大學學報:自然科學版,1996,19(4):142 - 145.
[5] 邱金法,趙冬梅. 用廢鋁回收廢定影液中銀的新工藝及裝置[J]. 華東交通大學學報,1990,90(2):75 -83.
[6] 江成軍,張振忠,趙芳霞,等. 用化學還原法從含銀電鍍廢液中回收銀的研究[J].貴金屬,2010,31(1):33 - 36.
[7] Mudder T I,Botz M M. Cyanide and Society:A Critical Review[J]. Eur J Miner Process Environ Protect,2004,4(1):62 - 74.
[8] Yuanjun Pei,Xiao Chen,Dandan Xiong,et al. Removal and Recovery of Toxic Silver Ion Using Deep-Sea Bacterial Generated Biogenic Manganese Oxides[J]. Plos One,2013,8(12):e816271 - e8162710.
[9] Su Yuan-bo,Li Qing-biao,Wang Yuan-peng,et al. Electrochemical Reclamation of Silver from Silver-Plating Wastewater Using Static Cylinder Electrodes and a Pulsed Electric Field[J]. J Hazard Mater,2009,170(2/3):1164 - 1172.
[10] 周全法. 金屬深加工及其應用[M]. 北京:化學工業出版社,2014:325 - 329.
[11] 王琪,周全法,尚通明. 貴金屬深加工實用分析技術[M]. 北京:化學工業出版社,2011:192 - 193.
(編輯 祖國紅)
Recovery of Silver from Silver Chloride Packed with Aluminum Sheet by Replacement Method
Cao Mengzhu1,Wang Qi2,Ge Mingmin2,Zhou Quanfa2
(1. Xuzhou Vocational College of Bioengineering,Xuzhou Jiangsu 221006,China;2. Jiangsu Key Laboratory of Precious Metal Chemistry and Technology,Jiangsu University of Technology,Changzhou Jiangsu 213001,China)
Silver was recovered from the silver-containing waste liquid by transforming Ag+into AgCl,packing the solid AgCl with aluminum sheet,and then reacting in Na2CO3solution by replacement method. The factors affecting the conversion rate of AgCl to Ag were studied. The experimental results show that under the suitable reaction conditions of mass fraction of Na2CO3solution 20%,reaction temperature 40 ℃,reaction time 20 h and without stirring,the conversion rate AgCl to Ag is 95.32%.
silver recovery;aluminum sheet;replacement;silver chloride
X781.1
A
1006 - 1878(2015)03 - 0305 - 03
2015 - 01 - 18;
2015 - 02 - 04。
曹夢竺(1979—),女,山東省單縣人,碩士,講師,電話 13605200291,電郵 2370152267@qq.com。聯系人:周全法,電話 13906122039,電郵 zhouquanfa@163.com。
國家科技支撐計劃項目(2014BAC03B06);江蘇省科技支撐計劃項目(BE2012645)。

