堿熔融—微波晶化法合成粉煤灰沸石及其對Cd2+的吸附
楊文煥,陳阿輝,李衛平,張雪峰,郭俊溫
(1. 內蒙古科技大學 能源與環境學院,內蒙古 包頭 014010;2. 北京城市排水集團有限責任公司,北京 100030)
堿熔融—微波晶化法合成粉煤灰沸石及其對Cd2+的吸附
楊文煥1,陳阿輝1,李衛平1,張雪峰1,郭俊溫2
(1. 內蒙古科技大學 能源與環境學院,內蒙古 包頭 014010;2. 北京城市排水集團有限責任公司,北京 100030)
以粉煤灰為主要原料,采用堿熔融—微波晶化法合成粉煤灰沸石。采用XRD,SEM,TEM等技術表征了粉煤灰沸石的微觀結構,并對其吸附Cd2+的性能進行了研究。表征結果顯示,粉煤灰沸石主要由X型沸石、P型沸石和鋁組成,粉煤灰沸石中有排列規則、呈蜂窩狀的孔穴和孔道存在,其孔穴和孔道大小分布均勻,致密。粉煤灰沸石的比表面積為108.49 m2/g,平均孔徑為3.779 nm,孔體積為0.221 mL/g。實驗結果表明,在溶液pH為7、吸附時間30 min的最佳吸附條件下,Cd2+去除率均大于94%。粉煤灰沸石對Cd2+的吸附可很好地用二級動力學方程進行擬合,相關系數為0.999 99。可用Langmuir等溫吸附模型描述該吸附過程,該吸附過程是單分子層吸附,主要是化學吸附,粉煤灰沸石對Cd2+的飽和吸附量為49.261 mg/g。
粉煤灰沸石;鉻離子;吸附;堿熔融;微波
隨著工業的迅速發展,重金屬對環境造成累積污染,對人類的健康造成危害,如何消除重金屬的危害是當今環保領域面臨的主要問題之一[1-2]。國內外學者通過廢物利用制成新型吸附材料用于吸附重金屬離子,效果良好,具有一定的應用前景[3-5]。目前采用的吸附材料主要有活性炭、礦物材料、活性污泥等[6-7]。新近研究成果顯示,利用合成沸石作為吸附劑具有較好的重金屬離子吸附效果[8-10]。
本工作以粉煤灰作為主要原料,采用堿熔融—微波晶化法合成具有微孔結構的粉煤灰沸石,對粉煤灰沸石的微觀結構進行了表征,并對其吸附Cd2+的性能進行了研究。
1 實驗部分
1.1 材料、試劑和儀器
粉煤灰:取自內蒙古包頭市某發電廠,主要組成為SiO250.6%(w),Al2O327.2%(w)。硝酸、氫氧化鈉、無水乙醇:分析純。Cd2+標準溶液:納克試劑公司。
D8 ADVANCE型X射線衍射儀:德國布魯克公司;QUANTA 400型掃描電子顯微鏡:荷蘭FEI公司;NOVA 3000e型物理吸附分析儀:美國Quantachrome公司;iCAP 6000型電感耦合等離子體發射光譜儀:費爾伯恩精密儀器有限公司;Tecnai G220s-twin型透射電子顯微鏡:荷蘭FEI公司。
1.2 粉煤灰沸石的制備
將粉煤灰球磨過200目篩后,按m(粉煤灰)∶m(氫氧化鈉)=1.0∶1.2混合均勻,裝入鎳坩堝后在箱式電爐中于650 ℃下煅燒1 h,隨爐冷卻至室溫,得到合成粉煤灰沸石的前驅物;將前驅物研磨至粉末狀后,按照固液比為1∶10(g/mL)加入水并攪拌陳化12 h,在微波爐中(600 W)微波晶化反應20 min,取出反應物經過濾、洗滌,在105 ℃下干燥6 h,得到粉煤灰沸石。
1.3 粉煤灰沸石的表征
采用XRD技術檢測粉煤灰沸石的物相,檢測條件:銅靶,管電壓40 kV,管電流40 mA,石墨單色器,Si固體探測器,掃描速率為2 (°)/min,掃描范圍為10 °~80 °。采用SEM技術表征粉煤灰沸石的形貌特征,檢測條件:鎢燈,加速電壓為200~30 000 V。采用物理吸附分析儀檢測粉煤灰沸石的比表面積和孔徑分布:以無水乙醇為分散劑,將粉煤灰沸石粉末超聲震蕩分散20 min后,用鍍非晶碳膜的銅網撈出進行檢測,工作電壓為200 kV。
1.4 吸附實驗
將0.2 g粉煤灰沸石和100 mL 一定質量濃度的Cd2+標準溶液加入250 mL的錐形瓶中,使用2 mol/ L的硝酸溶液和2 mol/L的氫氧化鈉溶液調節pH,密閉瓶口,將其置于振蕩器中振蕩一定時間后過濾,取濾液置于轉速為4 000 r/min的離心機中分離10 min,取上清液測定其中Cd2+的質量濃度,計算Cd2+去除率。
2 結果與討論
2.1 粉煤灰沸石的表征結果
2.1.1 XRD
粉煤灰沸石的XRD譜圖見圖1。由圖1可見,粉煤灰沸石的合成產物主要由X型沸石、P型沸石和鋁組成。由于在晶化反應體系中存在鋁過量的現象,因此,在XRD檢測圖譜中還有鋁元素的衍射峰存在。
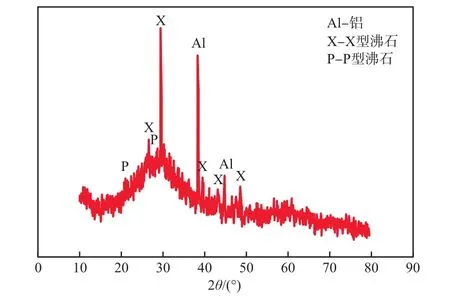
圖1 粉煤灰沸石的XRD譜圖
2.1.2 SEM
粉煤灰沸石的SEM照片見圖2。由圖2可見:粉煤灰沸石晶體表面較為粗糙、多孔,晶粒輪廓清晰但形狀、排列不規則、大小分布不均勻;粉煤灰沸石中存在部分未經轉化的球形粉煤灰顆粒,還有結晶度較高、呈立方體形狀的粉煤灰沸石晶體生成。

圖2 粉煤灰沸石的SEM照片
2.1.3 TEM
粉煤灰沸石的TEM照片見圖3。由圖3可見,粉煤灰沸石中有排列規則、呈蜂窩狀的孔穴和孔道存在,這些孔穴和孔道是粉煤灰沸石在晶化過程中由硅氧四面體和鋁氧四面體通過不同方式相互連接形成的,其孔穴和孔道大小分布均勻,致密。
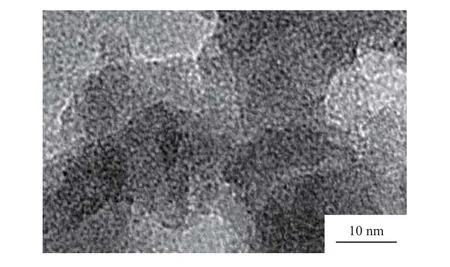
圖3 粉煤灰沸石的TEM照片
2.1.4 比表面積和孔徑分布
粉煤灰沸石對N2的吸附與脫附等溫線見圖4。由圖4可見,粉煤灰沸石對N2的吸附脫附等溫線符合IUPAC分類中的Ⅳ型,在中壓至接近飽和蒸汽壓部分,吸附脫附曲線形成了一個明顯的滯后環。根據吸附脫附等溫線,由BET方程計算出粉煤灰沸石的比表面積為108.49 m2/g,平均孔徑為3.779 nm,孔體積為0.221 mL/g。

圖4 粉煤灰沸石對N2的吸附與脫附等溫線
2.2 吸附實驗結果
2.2.1 溶液pH對Cd2+去除率的影響
在Cd2+初始質量濃度為10 mg/L、振蕩時間為30 min的條件下,溶液pH對Cd2+去除率的影響見圖5。
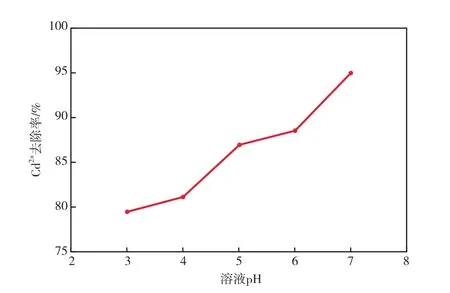
圖5 溶液pH對Cd2+去除率的影響
由圖5可見,隨pH的增加,Cd2+去除率明顯提高。這是因為:當pH較低時,吸附劑表面的吸附點位被水合氫離子占據,從而阻礙Cd2+與吸附點位的結合,且pH越低Cd2+可以結合的點位越少;當pH逐漸增加時,水合氫離子數不斷減少,吸附點位逐漸暴露出來,增加了Cd2+的吸附點位數,使粉煤灰沸石的吸附能力逐漸增大。因此,選擇溶液pH為7較適宜。
2.2.2 振蕩時間對Cd2+去除率的影響
在Cd2+初始質量濃度為10 mg/L、溶液pH為7的條件下,振蕩時間對Cd2+去除率的影響見圖6。由圖6可見:粉煤灰沸石對Cd2+的吸附速率較快,振蕩時間為30 min時吸附已趨于平衡,Cd2+去除率達95%;再延長振蕩時間,Cd2+去除率略有升高。因此,選擇振蕩時間為30 min較適宜。
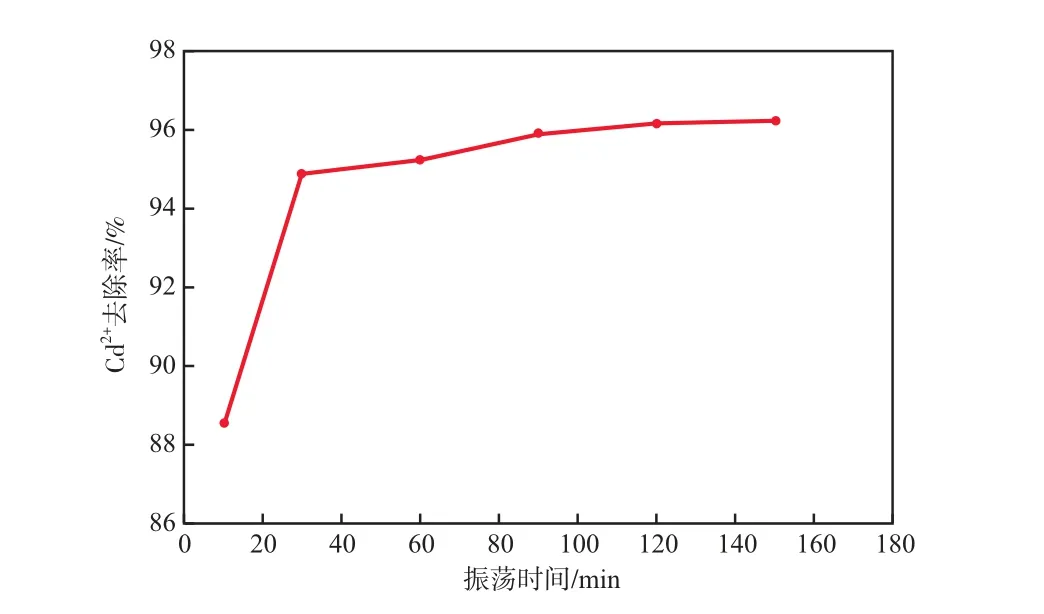
圖6 振蕩時間對Cd2+去除率的影響
2.2.3 Cd2+初始質量濃度對Cd2+去除率的影響
在溶液pH為7、振蕩時間為30 min的條件下,Cd2+初始質量濃度對Cd2+去除率的影響見圖7。由圖7可見,隨Cd2+初始質量濃度的增加,Cd2+去除率緩慢下降,但都維持在較高的范圍,均大于94%。
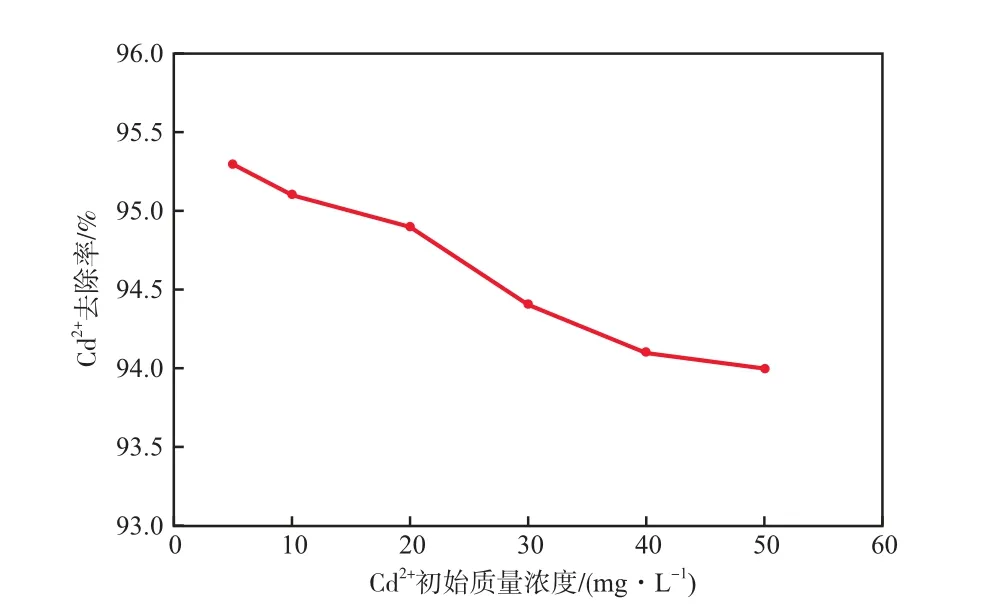
圖7 Cd2+初始質量濃度對Cd2+去除率的影響
2.3 吸附動力學
在25 ℃條件下,粉煤灰沸石對Cd2+的吸附動力學曲線見圖8。由圖8可見,粉煤灰沸石對Cd2+的吸附在30 min內迅速達到吸附平衡。
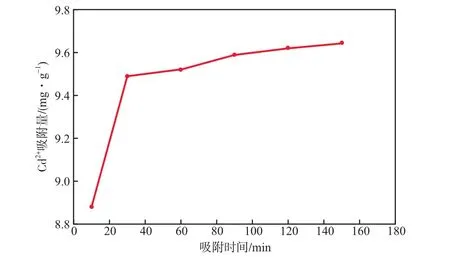
圖8 吸附動力學曲線
二級動力學模型擬合曲線見圖9。
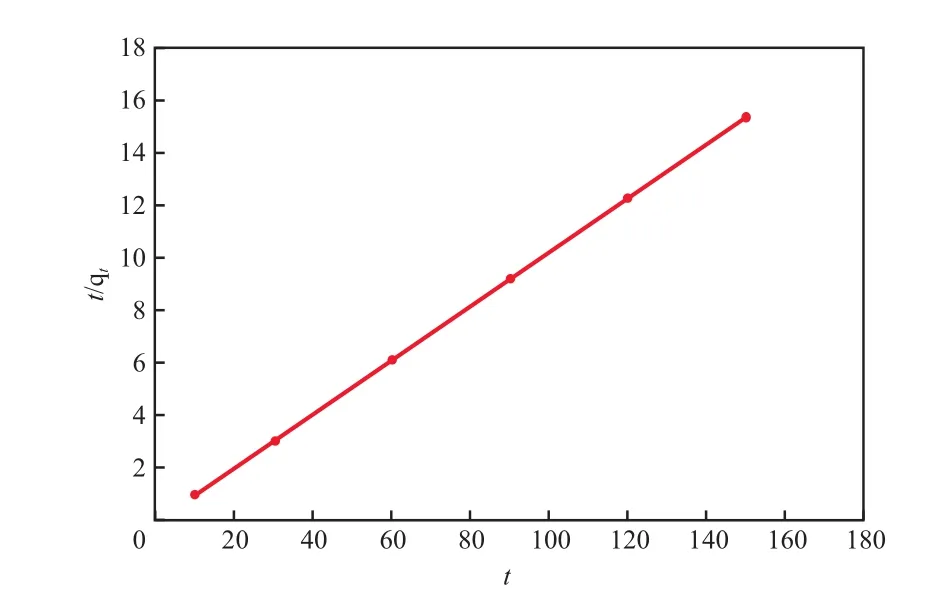
圖9 二級動力學模型擬合曲線
由圖9可見,粉煤灰沸石對Cd2+的吸附可以很好地用二級動力學方程進行擬合,相關系數可達0.999 99。通過二級動力學方程計算得到二級動力學方程參數k2為0.130 7 g/(mg ·min),平衡吸附量qe為9.681 mg/g,與實驗值(9.631 mg/g)相差較小,表明該吸附過程遵循二級反應機理,屬于化學吸附。
2.4 等溫吸附
粉煤灰沸石對Cd2+的吸附過程可分別用Langmuir吸附等溫模型和Freundlich吸附等溫模型進行描述,Langmuir吸附等溫線見圖10,Freundlich吸附等溫線見圖11。Langmuir和Freundlich吸附等溫模型的相關參數見表1。由圖10、圖11及表1可見,Langmuir吸附等溫模型更適于描述該吸附過程,說明該吸附過程是單分子層吸附,主要是化學吸附,粉煤灰沸石對Cd2+的飽和吸附量為49.261 mg/g。
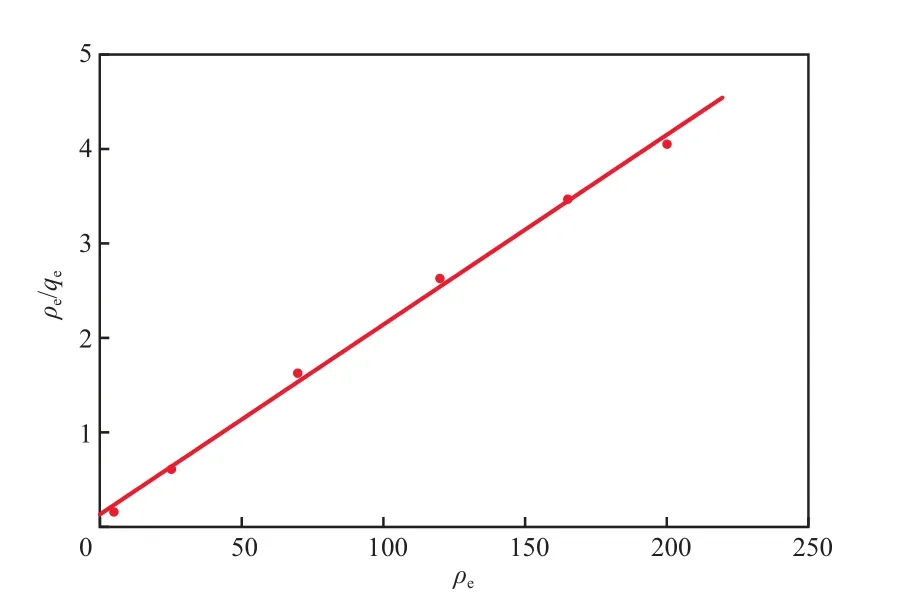
圖10 Langmuir吸附等溫線
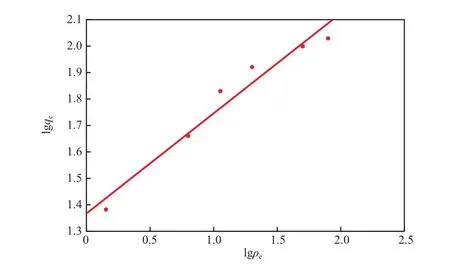
圖11 Freundlich吸附等溫線
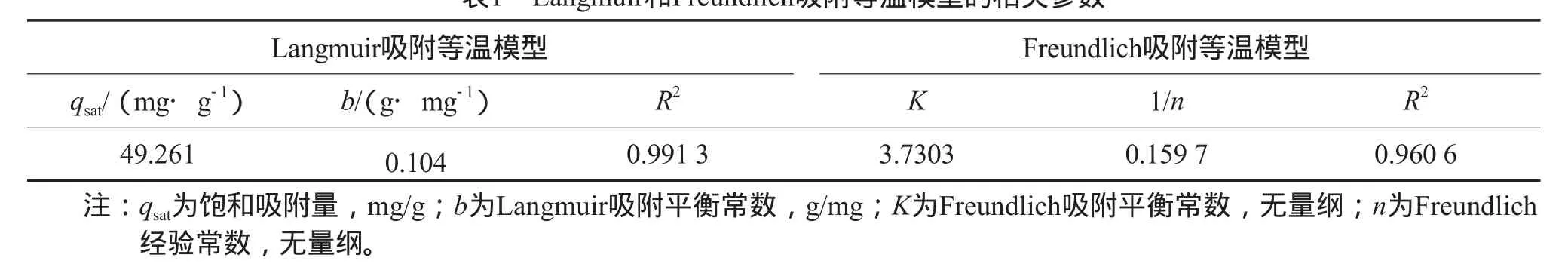
表1 Langmuir和Freundlich吸附等溫模型的相關參數
3 結論
a)以粉煤灰為主要原料,采用堿熔融—微波晶化法合成的粉煤灰沸石主要由X型沸石、P型沸石和鋁組成,粉煤灰沸石中有排列規則、呈蜂窩狀的孔穴和孔道存在,其孔穴和孔道大小分布均勻,致密。粉煤灰沸石的比表面積為108.49 m2/g,平均孔徑為3.779 nm,孔體積為0.221 mL/g。
b)粉煤灰沸石吸附Cd2+的最佳條件為:溶液pH 為7、吸附時間30 min,在此條件下Cd2+去除率均大于94%。
c)粉煤灰沸石對Cd2+的吸附可很好地用二級動力學方程進行擬合,相關系數可達0.999 99。同時還可用Langmuir吸附等溫模型描述該吸附過程,該吸附過程是單分子層吸附,主要是化學吸附,粉煤灰沸石對Cd2+的飽和吸附量為49.261 mg/g。
[1] 鄒照華,何素芳,韓彩蕓,等. 重金屬廢水處理技術研究進展[J]. 工業水處理,2010,36(6):17 - 21.
[2] Slbodan P S. World Water Dynamics:Global Modeling of Water Resources[J]. J Environ Manag,2002,66(3):249 - 267.
[3] Babel S,Dacera D del M. Heavy Metal Removal from Coniaminated Sludge for Land Application:A Review[J]. Waste Manage,2006,26(9):988 - 1004.
[4] Sheoran A S,Sheoran V. Heavy Metal Removal Mechanism of Acid Mine Drainage in Wetlands:A Critical Review[J]. Mineral Eng,2006,19(2):105 - 116.
[5] 林芳芳,易筱筠. 改性花生殼對水中Cd2+和Pb2+的吸附研究[J]. 農業環境科學學報,2011,30(7):1404 -1408.
[6] 馮寧川,郭學益. 皂化改性橘子皮生物吸附劑對重金屬離子的吸附[J]. 環境工程學報,2012,6(5):1467 - 1472.
[7] 胡克偉,賈冬艷,顏麗,等. 膨潤土對重金屬離子的競爭性吸附研究[J].土壤通報,2011,42(2):467 -470.
[8] 嚴小明,楊朗. 天然沸石吸附氨氮[J].南京工業大學學報:自然科學版,2009,31(2):89 - 92.
[9] 王春峰,李健生,韓衛清. 以粉煤灰為原料兩步法合成亞微米NaA型沸石[J].硅酸鹽學報,2008,36(11):1639 - 1641.
[10] Hedstrom A. Ion Exchange of Ammonium in Zeolites:A Literature review[J]. J Environ Eng,2001,127(8):673 - 681.
(編輯 祖國紅)
一種共聚物親水改性超濾膜及其制備方法與應用
該專利涉及一種共聚物親水改性超濾膜。其制備方法如下:將單體A、單體B、引發劑加入水和乙醇的混合溶劑中,在50~80 ℃下反應5~10 h后,反應液經沉淀過濾,所得固體物于60~90 ℃下烘干備用;取干燥的共聚物用溶劑溶解,再加入膜材料溶解,攪拌均勻得到鑄膜液,所得鑄膜液經刮膜、蒸發、凝固、清洗,得到所述的超濾膜,置于甲醛溶液中保存備用。該專利超濾膜可應用于去除水體中的重金屬離子,制備方法簡便,性能優良,應用前景廣闊。/CN 104772051 A,2015-07-15
一種羥基磷酸鈣-活性炭復合材料的制備方法及其應用
該專利涉及一種羥基磷酸鈣-活性炭復合材料的制備方法及其應用。所述復合材料的活性炭與羥基磷酸鈣的摩爾比為 (24~36)∶1,其制備方法如下:1)將氧化鈣或氫氧化鈣加入活性炭懸浮的磷酸溶液中,攪拌反應,其中磷酸與氧化鈣或氫氧化鈣的摩爾比為3∶(4.8~5.2);2)調節溶液pH至8~9,攪拌,靜置陳化;3)對溶液進行固液分離,將固體物烘干、磨細,得到所述復合材料。該復合材料對鉛、鎘污染處理效果顯著,且選用的材料中不含對環境有害的物質。同時,該復合材料的制備成本低廉。/CN 104772111 A,2015-07-15
一種以光電氣浮聯合凈化水中持久性有機污染物的方法
該專利涉及一種聯合光催化還原、電催化分解、電氣浮和電吸附技術,高效快速凈化水中持久性有機污染物的方法。包括如下步驟:首先以石墨電極為陰極、生鐵電極為陽極,施加電場釋放電氣浮絮體,該絮體具有一定的電導率,在電場作用下可在強化吸附的同時不完全分解水中污染物,進而以絮體中的鐵化合物為催化劑,借助光輻射對絮體中吸附的污染物進行徹底的催化降解。該技術整合了多種水處理工藝,具有工藝協同性強、綜合處理效率高、對微量持久性污染物的選擇性好、處理成本低等優點,具有較高的工業應用潛力。/CN 104773883 A,2015-07-15
Synthesization of Fly-Ash Zeolite by Alkali Fusion-Microwave Crystallization Process and Adsorption to Cd2+
Yang Wenhuan1,Chen Ahui1,Li Weiping1,Zhang Xuefeng1,Guo Junwen2
(1. School of Resource and Environment,Inner Mongolia University of Science and Technology,Baotou Inner Mongolia 014010,China;2. Beijing Drainage Group Co. Ltd.,Beijing 100030,China)
Fly-ash zeolite was synthesized by alkali fusion-microwave crystallization process using fl y ash as raw material,and characterized by XRD,SEM and TEM. Its adsorption capability to Cd2+was also studied. The characterization results indicate that:The prepared fl y-ash zeolite mainly consist of X type and P type zeolite and Al,and is full of uniform and regular holes and pores;The specif i c surface area,average size and pore volume of the fl y-ash zeolite are 108.49m2/g,3.779 nm and 0.221 mL/g,respectively. The experimental results show that under the optimum adsorption conditions of solution pH 7 and adsorption time 30 min,the adsorption rate of Cd2+is more than 94%. The adsorption of Cd2+by fl y-ash zeolite fi ts the secondary reaction kinetics equation with 0.999 99 of correlation coeff i cient. The adsorption process can be described by Langmuir isothermal adsorption model with 49.261 mg/g of the saturated adsorption capacity,which indicates that the reaction is a process of monolayer adsorption and mostly chemical adsorption.
fl y-ash zeolite;chromium ion;adsorption;alkali fusion;microwave
X783
A
1006-1878(2015)05-0547-05
2015 - 05 - 08;
2015 - 06 - 18。
楊文煥(1980—),女,內蒙古自治區人,碩士,講師,電話 18904728953,電郵 yangwenhuan80@163.com。聯系人:李衛平,18604720301,電郵 sjlwp@163.com。
國家環保部公益性行業科研專項項目(200909032);內蒙古科技大學創新基金項目(2011NCL022)。

