不同分期糖尿病視網膜病變淚液TNF-α 的表達*
張潔,王偉超,王虹,劉素波,李雅婷
(1.石家莊市第三醫院 眼科,河北 石家莊050011;2.石家莊市第一醫院 內分泌科,河北 石家莊050011;3.石家莊市第一醫院 干部老年病科,河北 石家莊050011;4.石家莊市第七醫院 健康檢查科,河北 石家莊050031)
近年來,糖尿病已成為排在心腦血管疾病和腫瘤之后的第三位影響人類健康的主要疾病。糖尿病引起的糖尿病性視網膜病變作為糖尿病的主要并發癥之一,為致盲的主要原因[1],隨著糖尿病病程進展,發病率逐漸增高,病程10年以上發病率增至60%~90%[2],嚴重地影響了糖尿病患者的生存質量。有關2型糖尿病的病因與發病機制的探討中,糖尿病炎癥發病學說備受關注并得到認同,認為糖尿病是一種自然免疫和低度炎癥性疾病,炎癥因子引起的血管內皮炎癥反應在糖尿病尤其是血管病變的發生、發展中具有重要作用,多種炎癥因子參與了糖尿病視網膜的微血管病變[3]。其中腫瘤壞死因子(tumor necrosis factorα,TNF-α)是糖尿病微血管病變發展過程中起著重要作用的炎癥因子[4-5]。本試驗采用酶聯免疫吸附試驗(ELISA試驗)對淚液、血清TNF-α 的濃度進行了測定,探討其與糖尿病及不同分期糖尿病性視網膜病變發生的關系,為臨床糖尿病病情監測提供可能的新方法。
1 資料與方法
1.1 儀器與試劑
LXJ-11型離心機(上海醫用儀器廠);酶標儀(法國Jouan公司);超低溫冰箱(法國Jouan公司);TNF-α ELISA試劑盒(美國TBE公司),靈敏度>0.5 pg/ml。
1.2 試驗方法
1.2.1 病例選擇 正常對照組(NC組)50例,男25例,女25例,平均年齡63.1歲。均為健康志愿者,無眼病史,無糖尿病家族史,無藥物過敏史、服用糖皮質激素及類似藥物史;2型糖尿病無糖尿病視網膜病變組(NDR組)50例,男25例,女25例,平均年齡65.4歲。經檢眼鏡和眼底血管熒光造影排除糖尿病視網膜病變;單純性糖尿病視網膜病變組(DR組)50例,男27例,女23例,平均年齡65.7歲,經檢眼鏡和眼底血管熒光造影確診為單純性糖尿病視網膜病變;增殖性糖尿病視網膜病變組(PDR組)50例,男24例,女26例,平均年齡66.8歲,經檢眼鏡和眼底血管熒光造影確診為增生性糖尿病視網膜病變。NDR組、DR組、PDR組均符合1999年WHO《2型糖尿病診斷標準》,患者起病年齡均>30歲,無酮癥發生,口服降糖藥有效,胰島自身抗體陰性,均無心、肺、腎、肝臟疾病,
以上四組人群的年齡、性別比例均相匹配。
1.2.2 標本采集 征求以上四組研究對象知情同意后分別采集其淚液和血液,采集過程均由同一人在相同條件下完成:受試者禁食、停藥8~10 h,檢查者動作輕柔,輕拉被檢者下瞼結膜并微后壓,以毛細玻璃管輕置于穹窿結膜與球結膜交界處,使淚液引流入毛細玻璃管,分別收集左、右眼淚液,每例受試者所取淚液樣本量為20μl,轉移至同一微量離心管,于超低溫冰箱-20℃保存備用;完成淚液采集后抽取研究對象靜脈血3ml,采用離心機分離血清,超低溫冰箱-20℃凍存以備集中檢測。
1.2.3 淚液、血清TNF-α 濃度測定 采用酶聯免疫吸附試驗(ELISA)測定人淚液、血清中TNF-α 的含量,嚴格按試劑盒說明進行操作。在ELISA檢測儀上,于450 nm處,以空白對照孔調零后測各孔OD值。以標準品濃度為橫坐標,以OD值為縱坐標,用平滑線連接各標準品的坐標點,繪制標準曲線,通過標本的OD值在標準曲線上查出其濃度。
1.3 統計學分析
所有數據采用SPSS 17.0統計軟件進行統計分析。計量資料以均數±標準差(±s)表示,分別對淚液、血清TNF-α 濃度進行單因素方差分析,若組間不同或不完全相同,再進一步做SNK-q檢驗比較各組間差別。并對淚液、血清TNF-α 水平作相關分析。P<0.05為差異有統計學意義。
2 結果
2.1 TNF-α在淚液中的含量
對NC組、NDR組、DR組、PDR組的各組數據進行單因素方差分析,其F=129.636,表明各組間不同或不完全相同,再進一步做SNK-q檢驗比較各組間差別,結果表明:NDR組、DR組、PDR組淚液TNF-α 含量均較NC組高,差異有統計學意義(P<0.01);DR組、PDR組淚液TNF-α 含量較NDR組高,差異有統計學意義(P<0.01);PDR組淚液TNF-α 含量較DR組高,差異有統計學意義(P<0.05)。如附表所示。
2.2 TNF-α 在血清中的含量
對NC組、NDR組、DR組、PDR組的各組數據進行單因素方差分析,其F=59.067,表明各組間不同或不完全相同,再進一步做SNK-q檢驗比較各組間差異,結果表明:NDR組、DR組、PDR組血清TNF-α 含量均較NC組高,差異有統計學意義(P<0.01);DR組、PDR組血清TNF-α 含量較NDR組高,差異有統計學意義(P<0.01);PDR組血清TNFα 含量較DR組高,差異有統計學意義(P<0.01)。如附表所示。
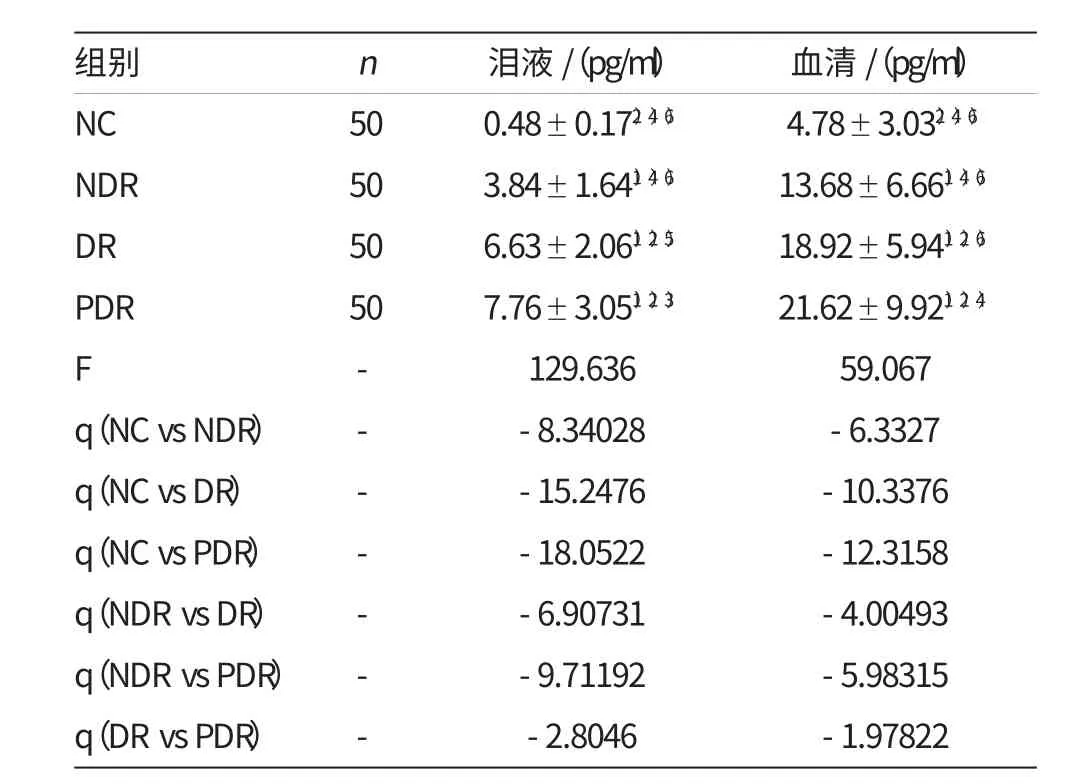
附表 淚液、血清中TNF-α 的含量
2.3 淚液TNF-α 與血清TNF-α 的相關分析
淚液與血液中的TNF-α 相關性關系為:r=0.751,P<0.05,95%可信區間為(0.31123,0.92586)。
3 討論
糖尿病可以引起多種并發癥,做為微血管并發癥之一的視網膜病變在發展中國家是導致成年人致盲的首要原因,其中黃斑水腫和增殖性視網膜病變是引起視力降低的主要原因,影響了12%的1型糖尿病患者和28%的2型糖尿病患者[6]。糖尿病炎癥發病學說認為,在糖尿病尤其是血管病變的發生、發展過程中,炎癥因子引起的血管內皮炎癥反應起到重要作用。這一學說備受關注并得到普遍認同,而其中的炎癥細胞因子TNF-α,在參與2型糖尿病及其血管并發癥的發生、發展過程中的作用不容忽視。
TNF-α 主要由激活的單核細胞、巨噬細胞分泌,血管內皮細胞、腎小管上皮細胞也可合成,參與多種生理免疫過程,是具有多種生物活性的細胞因子[7],有抗腫瘤、促進細胞生長、誘導細胞分化凋亡、影響糖脂代謝、誘導多種細胞因子產生等生物功能。TNF-α 基因啟動子多態性和糖尿病的發生密切相關,大量證據表明TNF-α 參與胰島素抵抗的形成,與β 細胞分泌胰島素的關系密切[8],在胰島素抵抗發病機制中起著重要作用,并且與糖尿病微血管病變關系密切。TNF-α 可抑制胰島素信號轉導通路中胰島素受體底物-1酪氨酸磷酸化,促進脂肪分解,使游離脂肪酸增多,誘導并加重了胰島素抵抗,促進糖尿病及其并發癥的發生發展。TNF-α 水平增高引起胰島素抵抗可引起視網膜微血管內皮細胞的病理性增生,與亞臨床炎癥共同作用,引起糖尿病視網膜病變。有研究顯示[9-10],血清TNF-α 水平與糖尿病視網膜病變嚴重程度有顯著關聯。TNF-α可直接損傷血-視網膜屏障,通過核因子途徑的激活刺激人視網膜血管內皮細胞引起明顯的細胞間黏附分子和血管細胞黏附分子的表達,提高視網膜血管通透性;可刺激巨噬細胞及其他細胞產生IL-8等,增強視網膜局部炎癥反應,JOUSSEN等[11]認為TNF-α 在糖尿病視網膜病變早期的發生機制中發揮了重要的作用,其中部分歸功于其促炎活性。有研究發現糖尿病可以誘發小鼠淚腺結構和分泌發生顯著改變,糖尿病小鼠的淚腺重量和淚膜容量均較對照組低,而淚液中白介素1b和腫瘤壞死因子的濃度均較對照組高。TNF-α 可以提高視網膜血管通透性,從而刺激血管外基質過量產生和血管細胞的增殖,最終導致眼內新生血管形成。RIFAT等[12]通過對糖尿病性視網膜病變行玻璃體切除術的患者的研究,檢測其玻璃體樣品中TNF-α 的水平,研究結果顯示糖尿病性視網膜病變患者玻璃體樣本中TNF-α 水平明顯高于對照組患者,由此他們推斷:在視網膜新生血管形成中起重要作用的TNF-α 其濃度在糖尿病性視網膜病變患者玻璃體樣本中明顯升高。
通過對國內外相關研究的調查表明,有關對糖尿病、糖尿病微血管病變患者血清中的TNF-α 水平研究較多,其研究發現血清TNF-α 作為重要的炎癥介質,在糖尿病及其微血管并發癥患者中明顯升高。本研究對正常人(NC組)、2型糖尿病尚無視網膜病變患者(NDR組)、單純性糖尿病視網膜病變患者(DR組)及增生性糖尿病視網膜病變患者(PDR組)血清TNF-α 進行測定,結果表明TNF-α 含量:PDR組>DR組>NDR組>NC組,且差異有統計學意義,表明糖尿病患者血清TNF-α 水平較正常人增高,隨著糖尿病視網膜病變程度的加重,血清TNF-α 水平進一步升高,此結果與以往研究結論一致。
雖然淚液與血清同屬體液范疇,但關于淚液TNF-α 在糖尿病及其視網膜病變患者中的表達,國內外很少有研究報道。淚液收集過程無創,易于被患者接受,可以用來進行臨床病情監測。本研究又通過對糖尿病患者淚液TNF-α 的檢測,探討了淚液TNF-α 的水平與糖尿病及不同分期糖尿病視網膜病變的關系,并進一步對淚液TNF-α 和血清TNF-α 做了相關性分析。本研究對NC組、NDR組、DR組、PDR組淚液TNF-α 分別進行了測定,結果表明TNF-α 含量:PDR組>DR組>NDR組>NC組,差異均有統計學意義,提示隨著糖尿病視網膜病變程度的加重,淚液TNF-α 水平進一步升高。相關分析表明:淚液TNF-α 與血清TNF-α 變化趨勢一致,呈直線正相關關系。
總之,本試驗研究表明2型糖尿病患者淚液TNF-α 水平明顯升高,且隨糖尿病視網膜病變程度的加重而升高,淚液TNF-α 與2型糖尿病及不同分期糖尿病視網膜病變的發生有關。血清TNF-α 與淚液TNF-α 的變化呈直線正相關關系,所以淚液TNF-α 的測定有望成為繼血清監測之后的糖尿病病情監測和評估的一種新方法。
[1]HABFFB NM,YOUSSFF OI,SAAB AA,et al.A diponectin as a marker of complications in typeⅠdiabetes[J].Indian Pediatr,2012,49(4):277-280.
[2]ZHANG X,SAADDINE JB,CHOU CF,et al.Prevalence of diabetic retinopathy in the United States,2005-2008[J].JAMA,2010,304(6):649-656.
[3]ANTONETTI DA,KLEIN K,GARDNER TW.Diabetic retinopathy[J].N Engl JMed,2012,366(13):1227-1239.
[4]NAVARRO JF,MORA-FERN?NDEZ C.The role of TNF-alpha in diabetic nephropathy:pathogenic and therapeutic implications[J].Cytokine Growth Factor Rev,2006,17(6):441-450.
[5]ICHINOSE K,KAWASAKI E,EGUCHI K.Recent advancement of understanding patho-genesis of type 1 diabetes and potential relevance to diabetic nephropathy[J].Am J Nephrol,2007,27(6):554-564.
[6]ROMERO-AROCA P.Current status in diabetic macular edema treatments[J].World J Diabetes,2013,4(5):165-169.
[7]FORNONI A,IJAZ A,TEJADA T,et al.Role of inflammation in diabetic nephropathy[J].Curr Diabetes Rev,2008,4(1):10-17.
[8]NAVARRO JF,MORA C,GOMEZ M,et al.Influence of renal involvement on peripheral blood mononuclear cell expression behaviour of tumour necrosis factor-alpha and interleukin-6 in type 2 diabetic patients[J].Nephrol Dial Transplant,2008,23(3):919-926.
[9]KOLEVA-GEORGIEVA DN,SIVKOVA NP,TERZIEVA D.Serum inflammatory cytokines IL-1beta,IL-6,TNF-alpha and VEGF have influence on the development of diabetic retinopathy[J].Folia Med(Plovdiv),2011,53(2):44-50.
[10]KAUL K,HODGKINSON A,TARR J,et al.Is inflammation a common retinal-renal-nerve pathogenic link in diabetes[J].Curr Diabetes Rev,2010,6(5):294-303.
[11]JOUSSEN AM,DOEHMEN S,LE ML,et al.TNF-α mediated apoptosis plays an important role in the development of early diabetic retinopathy and long-term histopathological alterations[J].Mol Vis,2009,15(8):1418-1428.
[12]RIFAT R,OZGUR A,UZAY G,et al.Interleukin-8 and tumor necrosis factor-a levels in vitreous samples from patients with diabetic retinopathy[J].Int Eye Sci,2013,13(12):2365-2369.

