自噬參與低氧預處理抗PC12細胞糖氧剝奪損傷過程*
盧 娜,魏林郁,王寶英,李新娟,李超堃,白瑞櫻,李東亮(新鄉醫學院基礎醫學院生理與神經生物學教研室,河南新鄉453003)
自噬參與低氧預處理抗PC12細胞糖氧剝奪損傷過程*
盧娜△,魏林郁,王寶英,李新娟,李超堃,白瑞櫻,李東亮
(新鄉醫學院基礎醫學院生理與神經生物學教研室,河南新鄉453003)
[摘要]目的:觀察低氧預處理(HPC)對氧糖剝奪(OGD)損傷的PC12細胞的作用,同時探討自噬在其中的作用。方法:培養的PC12細胞按照處理因素分為6組:對照組、HPC模型組、3-甲基腺嘌呤(3-MA)組、低氧預處理后氧糖剝奪(HPC+ OGD)組、3-甲基腺嘌呤預處理后行低氧預處理及氧糖剝奪(3-MA+ HPC+ OGD)組和OGD組。CCK-8檢測細胞存活率; caspase-3活性檢測試劑盒檢測酶活性; TUNEL染色和流式細胞術檢測細胞凋亡的情況; Western blot法檢測自噬相關蛋白LC3、beclin-1和凋亡相關蛋白caspase-3的表達。結果:與對照組相比,OGD組細胞存活率明顯降低;與3-MA+ HPC+ OGD組及OGD組相比,HPC+ OGD組細胞存活率明顯升高(P<0.05)。與對照組相比,OGD組細胞的caspase-3酶活性明顯升高;與3-MA+ HPC+ OGD組及OGD組相比,HPC+ OGD組的caspase-3酶活性明顯降低(P<0.05)。與對照組相比OGD組細胞凋亡明顯增多; HPC+ OGD組與OGD組相比凋亡明顯減少(P<0.05)。此外,與對照組相比,OGD組的激活型caspase-3蛋白水平明顯升高(P<0.05) ;且HPC+ OGD組與OGD組相比激活型caspase-3蛋白水平明顯減少而LC3、beclin-1的蛋白水平明顯升高(P<0.05)。結論: HPC抗OGD損傷的機制可能與其激活細胞自噬有關。
[關鍵詞]自噬;細胞凋亡;低氧預處理;氧糖剝奪
[修回日期]2015-06-01
腦血管病以其高發病率、高死亡率、高致殘率而嚴重危害人類健康,其中缺氧缺血性腦血管病約占70%。但遺憾的是,目前沒有有效預防和治療的方法。對其發病機制的研究及如何啟動內源性保護機制以尋找有效的防治手段仍然是該領域研究的重點。低氧預處理(hypoxic preconditioning,HPC)是指1次或多次短暫、非致死性低氧刺激后,機體獲得的對更嚴重甚至致死性缺血或缺氧的耐受性。HPC是機體抗缺氧或缺血的一種內源性保護現象,可發生在腦、心、肺、肝和腎等組織,其中腦HPC由Kitagawa等于1990年首報道,此保護現象為臨床治療腦缺血/低氧性損傷提供了新思路[1]。此后大量實驗及我實驗室前期工作表明,HPC能改善以后出現的腦缺氧缺血[2-3]。若預先多次給于人體能耐受的低氧條件,則可明顯減少缺血性腦卒中的發病率、死亡率和致殘率。目前,腦低氧預處理的機制尚不十分清楚,尤其是其細胞保護的信號通路、分子機制還需要深入研究。本實驗以PC12細胞為對象,從不同層面對HPC抗腦缺氧缺血的機制進行研究,探索自噬在其中的作用。
材料和方法
1材料
PC12細胞株由上海中科院典型細胞培養庫提供; DMEM培養液和新生牛血清購于HyClone; 3-甲基腺嘌呤(3-methyladenine,3-MA)購于Sigma;細胞存活與毒性檢測試劑盒CCK-8、caspase-3活性檢測試劑盒、Annexin V-FITC細胞凋亡檢測試劑盒和一步法TUNEL細胞凋亡檢測試劑盒均購自碧云天生物技術有限公司;兔抗LC3-Ⅱ多克隆抗體購自Abcam;兔抗beclin-1多克隆抗體購自Bioworld;兔抗cleaved-caspase-3單克隆抗體購自Abgent;辣根過氧化物酶標記山羊抗兔IgG(H+ L)購自Laboratories;蛋白Marker購自Fermentas。
2主要方法
2.1PC12細胞培養細胞置于10%胎牛血清的達爾伯克改良伊格爾培養基(Dulbecco’s modified eagle medium,DMEM)中,在37℃、5% CO2的飽和水汽培養箱中培養,每隔48 h換培養液,當單層細胞融合后,行傳代處理。傳代后隨機分為對照(control)組、HPC組、3-MA組、HPC+氧糖剝奪(oxygen-glucose deprivation,OGD)組、3-MA+ HPC+ OGD組和OGD組。每次每組設6個平行復孔,實驗重復3次。
2.2PC12細胞低氧預處理模型的建立每天定時將PC12細胞移至37℃恒溫密閉容器內,連續充以低氧氣體(93% N2、2% O2、5% CO2),30 min后立即取出,再恢復常氧培養,重復6次,建立細胞低氧預處理模型。
2.3PC12細胞OGD模型的建立選用培養6 d生長良好的PC12細胞,置換成無糖培養基孵育,放入
37℃厭氧培養箱中培養2 h(94% N2、1% O2、5% CO2),然后復氧復糖培養24 h。
2.4CCK-8比色法檢測細胞存活率取對數生長期細胞,調整細胞密度,以2×104/L接種于96孔板,每孔細胞懸液100 μL。在37℃、5% CO2的飽和水汽培養箱中培養24 h。處理后,每孔加10 μL CCK-8溶液,避光孵育2 h,酶標儀在波長450 nm處讀取吸光度(A)值,用8個復孔A值的均數計算存活率。存活率按下式計算:存活率=A處理/A對照×100%。本實驗對照組的細胞存活率定為100%。
2.5Caspase-3活性檢測試劑盒檢測caspase-3酶活性冰浴裂解細胞15 min,4℃、20 000×g離心10 min,將上清轉移到96孔板中。配置反應體系,再加入Ac-DEVD-pNA后混勻,37℃孵育60 min,測定A405。通過標準曲線對比計算出樣品中催化產生多少量的pNA。
2.6一步法TUNEL細胞凋亡檢測試劑盒檢測凋亡取對數生長期細胞,調整細胞密度,以5×105/L接種于24孔板內載玻片上,每個孔細胞懸液500 μL;培養24 h后,分組處理細胞;棄培養液、PBS洗滌1次、4%多聚甲醛固定1 h、0.1% Triton X-100冰浴孵育5 min、在樣品上加50 μL TUNEL檢測液,37℃避光孵育60 min,封片后立即在熒光顯微鏡下觀察。在100倍鏡下,隨機取5個視野,計數呈現綠色熒光的凋亡細胞,取平均值,計算細胞凋亡率(%)=凋亡細胞數/視野下細胞總數×100%,重復3次。
2.7流式細胞術檢測細胞凋亡率PC12細胞經分組處理后,PBS洗2遍,收集104個細胞,加入195 μL Annexin V-FITC結合液輕輕重懸細胞,加入5 μL Annexin V-FITC,輕輕混勻,加入10 μL碘化丙啶染色液,輕輕混勻。室溫(20~25℃)避光孵育10~20 min,隨即進行流式細胞儀檢測細胞凋亡率。
2.8Western blot法檢測caspase-3、LC3-Ⅱ和beclin-1的蛋白水平收獲細胞,4℃預冷的PBS洗1次,加入適量的細胞裂解液,用細胞刮刮下細胞,低溫離心機12 000×g離心10 min,取上清液,棄沉淀。用BCA法測定各組蛋白含量,每孔上樣25 μL蛋白,經15% SDS-PAGE 80V分離2 h后,300 mA恒流轉膜40 min,5%脫脂牛奶常溫下封閉1 h后,在4℃孵育I抗(兔抗大鼠LC-3滴度為1∶1 000,兔抗大鼠bec-lin-1滴度為1∶1 500,兔抗大鼠cleaved caspase-3抗體滴度為1∶1 000,小鼠抗大鼠β-actin滴度為1∶3 000) ; 5%脫脂牛奶常溫下封閉; II抗(羊抗兔辣根過氧化物酶IgG和羊抗小鼠辣根過氧化物酶IgG滴度均為1∶5 000,5%脫脂牛奶配制)孵育,ECL顯影顯示目的條帶和內參照。用ImageJ軟件分析光密度值,Sigma Plot 13軟件分析蛋白表達的相對水平。
3統計學處理
用SPSS 18.0統計軟件進行分析。數據均采用均數±標準差(mean±SD)表示,多組間比較采用單因素方差分析(one-way ANOVA),組間兩兩比較采用Student-Newman-Keuls檢驗(SNK-q檢驗)。以P<0.05為差異有統計學意義。
結果
1不同處理組PC12細胞的形態觀察
倒置相差光學顯微鏡下觀察PC12細胞形態的變化,正常PC12細胞大部分呈梭形,少數呈多邊形,多數可見細胞突起,折光性好,貼壁能力強; OGD處理后,細胞貼壁數量明顯減少,細胞形態逐漸變為圓形,體積皺縮,突起減少或消失,折光性減弱,脫壁的細胞增加; HPC+ OGD組細胞的缺氧缺糖損傷明顯減輕; 3-MA+ HPC+ OGD組細胞的損傷無明顯減輕,見圖1。這提示HPC能減輕OGD引起的細胞損傷;自噬阻斷劑3-MA可阻斷這種保護作用。
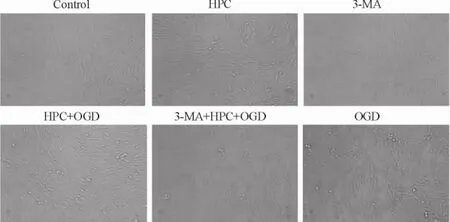
Figure 1.The effect of different treatment factors on the morphology of PC12 cells (×100).圖1不同處理因素對PC12細胞形態的影響
2不同處理因素對PC12細胞存活率的影響
CCK-8法檢測結果以空白對照組細胞存活率為100.0%,則HPC、3-MA、HPC+ OGD、3-MA+ HPC+ OGD和OGD組存活率分別為98.7%、97.9%、86.2%、63.5%和67.6%。HPC+ OGD、3-MA+ HPC+ OGD組、OGD組與對照組比較差異均有統計學意義(P<0.05) ; HPC+ OGD組與3-MA+ HPC+ OGD組及OGD組比較差異均有統計學意義(P<0.05),見圖2。
3不同處理因素對PC12細胞caspase-3酶活性的影響
Caspase-3活性檢測試劑盒檢測結果以空白對照組細胞的caspase-3酶活性為1,則HPC、3-MA、HPC+ OGD、3-MA+ HPC+ OGD和OGD組的caspase-3酶活性分別為1.15、1.09、2.56、3.38和3.42。HPC+ OGD、3-MA+ HPC+ OGD組、OGD組與對照組比較差異均有統計學意義(P<0.05) ; HPC+ OGD組與3-MA+ HPC+ OGD組及OGD組比較差異均有統計學意義(P<0.05),見圖3。
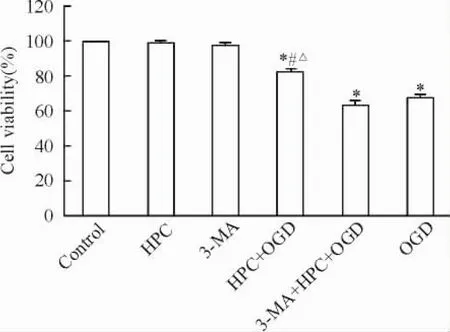
Figure 2.The effect of different treatment factors on the cell viability of PC12 cells.Mean±SD.n=3.*P<0.05 vs control group;#P<0.05 vs OGD group;△P<0.05 vs 3-MA+ HPC+ OGD group.圖2不同處理因素對PC12細胞存活率的影響
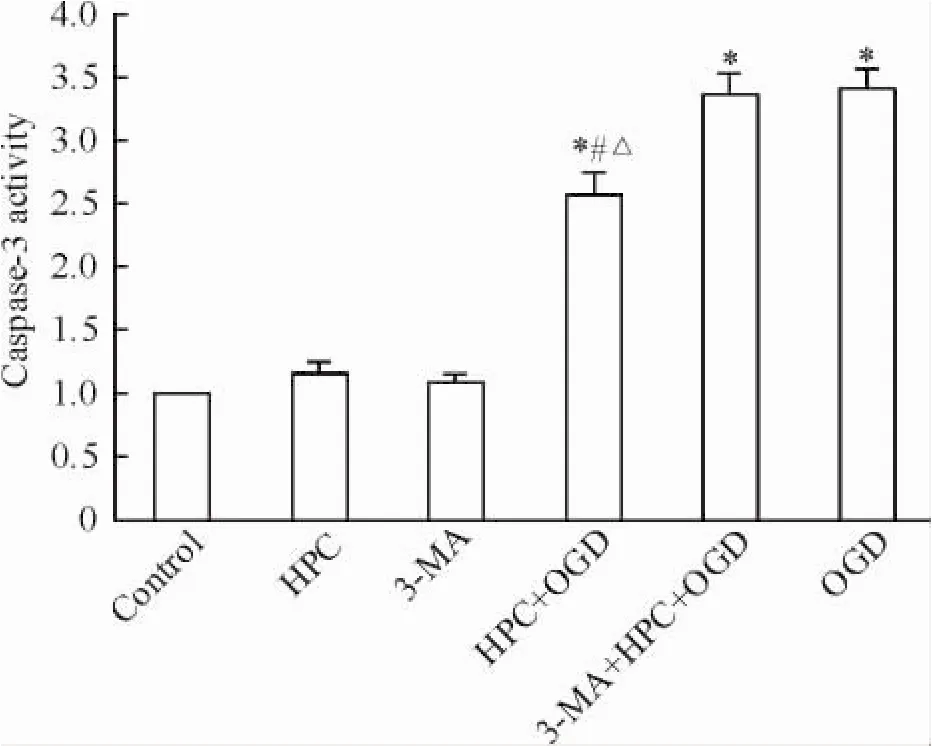
Figure 3.The caspase-3 activity in the PC12 cells with different treatments.Mean±SD.n=3.*P<0.05 vs control group;#P<0.05 vs OGD group;△P<0.05 vs 3-MA+ HPC+ OGD group.圖3各組細胞caspase-3酶活性的比較
4 TUNEL法熒光染色檢測細胞凋亡率
TUNEL熒光染色可見control組、HPC組和3-MA組陽性凋亡細胞數較少; HPC+ OGD組、3-MA+ HPC+ OGD組及OGD組陽性細胞數明顯增多; HPC+ OGD組明顯低于3-MA+ HPC+ OGD組及OGD組(P<0.05),見圖4。
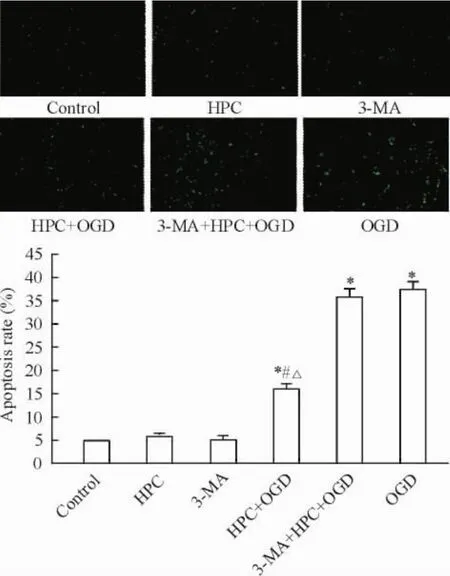
Figure 4.The TUNEL staining and apoptotic rate in the PC12 cells with different treatments (×100).Mean±SD.n=3.*P<0.05 vs control group;#P<0.05 vs OGD group;△P<0.05 vs 3-MA+ HPC+ OGD group.圖4各組細胞的TUNEL熒光染色及凋亡率的比較
5流式細胞術檢測細胞凋亡率
Annexin V-FITC/PI雙染流式細胞儀檢測結果顯示control組、HPC組、HPC+ OGD組和OGD組的凋亡率分別為(3.40±0.36) %、(3.87±0.59) %、(18.67±0.97) %和(36.40±0.89) %;與正常對照組相比,HPC+ OGD組和OGD組凋亡率明顯增加(P<0.05),HPC+ OGD組與OGD組比較明顯減少(P<0.05),見圖5。
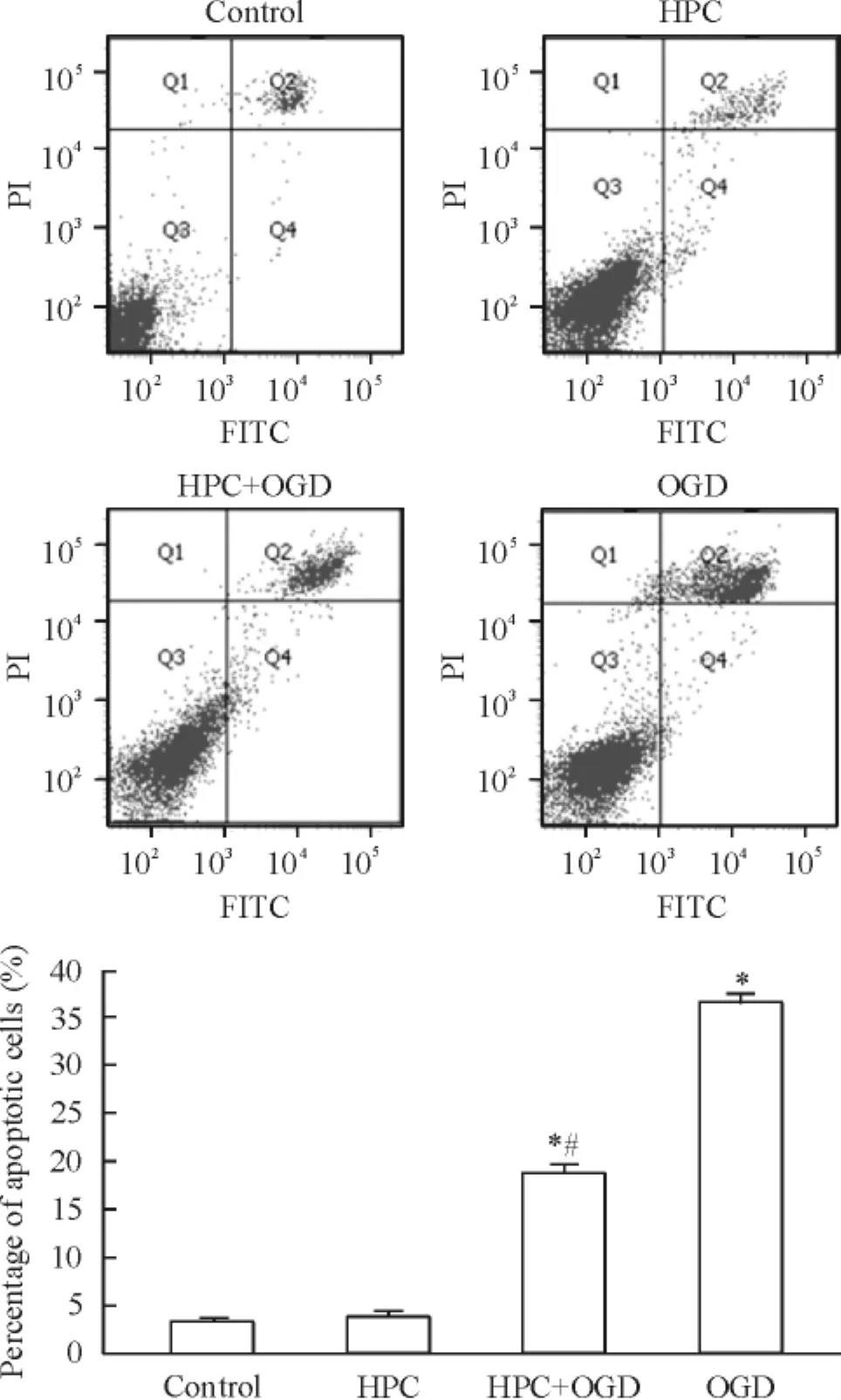
Figure 5.Apoptosis of PC12 cells detected by flow cytometry of Annexin V-FITC/PI staining.Mean±SD.n=3.*P<0.05 vs control group;#P<0.05 vs OGD group.圖5流式細胞術檢測細胞凋亡
6 Western blot法檢測caspase-3、LC3-Ⅱ和beclin-1蛋白水平的變化
蛋白質印跡分析結果顯示,與正常對照組比較,HPC+ OGD組和OGD組的cleaved caspase-3的蛋白量均增加(P<0.05) ;且HPC+ OGD組明顯低于OGD組(P<0.05)。HPC+ OGD組的LC3-Ⅱ和beclin-1蛋白表達明顯高于OGD組(P<0.05),見圖6。
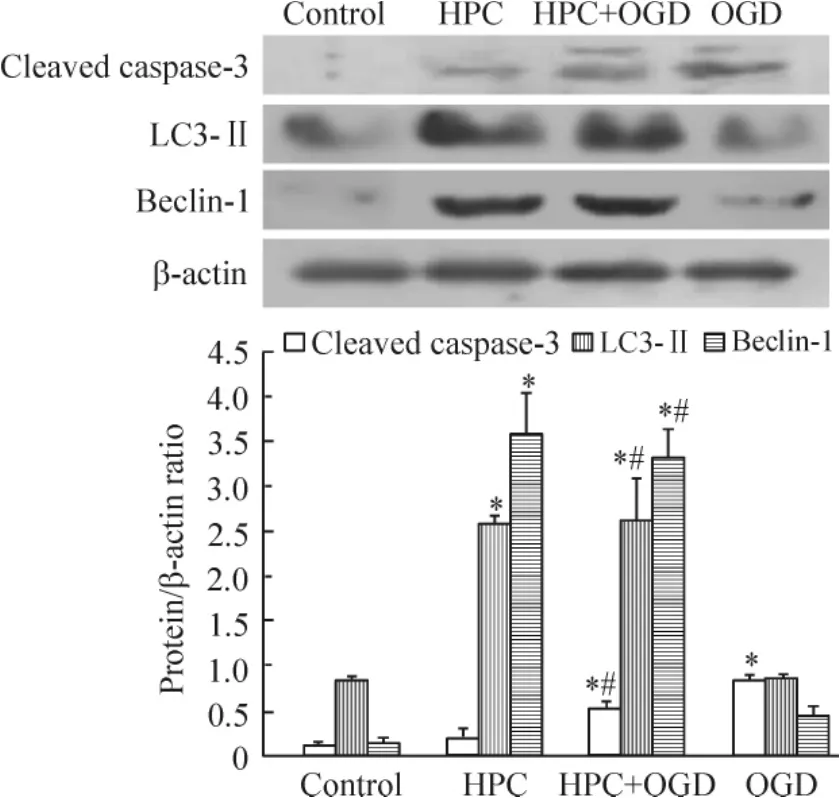
Figure 6.The protein levels of cleaved caspase-3,LC3-Ⅱand beclin-1 in the PC12 cells with different treatments.Mean±SD.n=3.*P<0.05 vs control group;#P<0.05 vs OGD group.圖6各組PC12細胞cleaved caspase-3、LC3-Ⅱ和beclin-1蛋白水平的比較
討論
自噬是指存在于真核細胞中的生命現象,細胞在自噬相關基因的調控下形成自噬體,并與溶酶體融合形成自噬溶酶體,降解其所包裹的內容物,以實現細胞本身的代謝需要和某些細胞器的更新[4]。自噬是繼壞死、凋亡后發現的第3種細胞死亡形式,參與了如腦損傷等多種疾病的發病過程[4]。細胞在受到外界因素刺激,如饑餓、缺氧、高溫、應激等逆境條件下均可誘導細胞自噬的發生,可以在一定程度上對細胞進行保護[5-6]。自噬在機體的生命過程中隨處可見,但是其關鍵的發生和作用機制尚未完全闡明[7]。盡管自噬現象很早就被發現,但對自噬與腦缺氧缺血關系的研究時間并不長。目前,大多數研究證實自噬具有腦保護作用。Erlich等[8]采用雷帕霉素干預大鼠顱腦損傷也發現了自噬現象的產生,證明顱腦損傷后4 h注入雷帕霉素在腦功能恢復上與未注入組有明顯改善效果。Carloni等[9]研究結果顯示細胞凋亡與自噬存在負相關,自噬激動劑雷帕霉素的使用加速后自噬現象的發生,減少細胞凋亡,減輕腦損傷;說明自噬激活在腦損傷早期,可能對神經細胞起著一定的保護作用。Zhang等[10]證明腦外傷后確實激活了細胞自噬的發生,且能夠維持32天,自噬在損傷后早期主要保護周圍神經細胞免于凋亡和退行性變,并在神經細胞損傷與修復過程中長期發揮生物學作用。Komatsu等[11]的研究表明一定程度自噬具有增強抗氧化、恢復認知功能、調節腦血流量等特異的作用。當神經元遭遇應激時,自噬最先被激活,當自噬不能維持神經元穩態后,細胞再繼發凋亡,最后進入壞死;且自噬與凋亡可同時存在于神經元細胞,推測自噬參與腦缺氧缺血后神經元的保護[12-13]。事實上,自噬是一個動態過程,主要由自噬相關基因編碼的蛋白來完成相應的生物學功能。LC3是哺乳動物細胞中酵母ATG8(Aut7/Apg8)基因的同源物,定位于前自噬泡和自噬泡膜表面,參與自噬體的形成。LC3有Ⅰ型和Ⅱ型之分,未發生自噬時,細胞內合成的LC3經過加工,成為胞質可溶性的LC3-Ⅰ,常規表達。當自體吞噬發生時,LC3-Ⅰ經泛素樣加工修飾過程,與自噬膜表面的磷脂酰乙醇胺結合,形成LC3-Ⅱ。LC3-Ⅱ結合并始終位于胞內自噬體的膜上,其含量的多少與自噬泡數量的多少成正比。因此LC3-Ⅱ是目前觀察自噬現象是否存在、研究自噬活性較為可靠的生物學標志物[14]。Beclin-1是激活自噬的上游信號分子,游離的beclin-1能與多種蛋白質共同形成Ⅲ型PI3K復合體,參與早期自噬體的形成。已經證實通過上調beclin-1在哺乳動物細胞中的表達能夠刺激自噬的發生[15]。因此,常以beclin-1的表達來衡量自噬的發生。
凋亡是由基因控制的細胞主動死亡的一種過程。Caspase是一大類凋亡調控基因,對神經元的凋亡起著非常關鍵的作用,而caspase-3被稱為死亡蛋白酶,是caspase家族中最重要的細胞凋亡執行者之一[16]。腦組織缺血、缺氧后,神經細胞內能量代謝發生障礙,產生大量氧自由基、興奮性氨基酸及內質網應激素等,均可誘導細胞自噬的發生。值得注意的是,細胞自噬是一把雙刃劍。一方面,自噬的過度激活可能介導細胞程序性死亡的發生[17-18];另一方面,自噬的啟動也有助于維持神經元的穩態,減少繼發損傷,并有效清除已經被損傷的細胞器而對神經元起保護作用[19]。有報道稱低氧預處理可誘導自噬,自噬可能參與神經保護作用[20]。那么在PC12細胞OGD損傷過程中自噬扮演什么角色?在HPC的影響下,自噬能否被激活?細胞自噬的增強能否對更嚴重的缺氧缺血起到保護作用?檢索國內外文獻未見相關報道。
本研究CCK-8結果表明,OGD組細胞存活率顯著降低,HPC+ OGD組細胞存活率顯著高于OGD組,3-MA+ HPC+ OGD組顯著低于HPC+ OGD組。這提示HPC明顯增加OGD導致的PC12細胞存活率降低,具有保護作用;且可被自噬抑制劑3-MA阻斷。通過caspase-3酶活性檢測顯示,OGD組caspase-3酶活性顯著升高,HPC+ OGD組的caspase-3酶活性顯著低于OGD組,且3-MA+ HPC+ OGD組顯著高于HPC+ OGD組。提示HPC明顯降低OGD導致PC12細胞caspase-3酶活性升高,具有保護作用;且可被自噬抑制劑3-MA阻斷。通過TUNEL熒光染色檢測法及流式細胞術檢測細胞凋亡率顯示,與正常對照組相比,OGD組細胞凋亡率明顯增多,HPC+ OGD組明顯低于3-MA+ HPC+ OGD組及OGD組。提示HPC明顯降低了OGD導致的PC12細胞凋亡率,具有保護作用,與相關研究結果基本相符[21-22],且這種保護效應可被自噬抑制劑3-MA阻斷。我們進一步通過Western blot對凋亡相關蛋白caspase-3及自噬相關蛋白LC3-Ⅱ、beclin-1的表達進行檢測,發現HPC+ OGD組、OGD組的激活型caspase-3蛋白量均增加,且HPC+ OGD組明顯低于OGD組。HPC組及HPC+ OGD組LC3-Ⅱ和beclin-1蛋白表達明顯高于OGD組。說明細胞自噬的激活在一定程度上可對抗凋亡,LC3-Ⅱ及beclin-1蛋白的調控和caspase-3活化存在負相關。因此,我們推測HPC誘導自噬的激活,可對抗神經元的氧糖剝奪損傷,延緩細胞凋亡過程的發生,對細胞存活起一定的保護作用[23]。研究低氧預處理啟動和調控自噬的激活,或許能夠為應對神經元損傷提供新的策略,為腦缺血的防治開辟新的途徑,既有理論意義,又有潛在的臨床應用前景。
[參考文獻]
[1]Ara J,Fekete S,Frank M,et al.Hypoxic-preconditioning induces neuroprotection against hypoxia-ischemia in newborn piglet brain[J].Neurobiol Dis,2011,43(2) : 473-485.
[2]Zhang N,Yin Y,Han S,et al.Hypoxic preconditioning induced neuroprotection against cerebral ischemic injuries and its cPKC-gamma-mediated molecular mechanism[J].Neurochem Int,2011,58(6) : 684-692.
[3]Sun HS,Xu B,Chen W,et al.Neuronal K(ATP) channels mediate hypoxic preconditioning and reduce subsequent neonatal hypoxic-ischemic brain injury[J].Exp Neurol,2015,263: 161-171.
[4]Shpcilka T,Elazar Z.Shedding light on mammalian microautophagy[J].Dev Cell,2011,20(1) : 1-2.
[5]Zou W,Wang X,Vale R,et al.Autophagy genes promote apoptotic cell corpse clearance[J].Autophagy,2012,8(8) : 34-38.
[6]Luo J.Autophagy and ethanol neurotoxicity[J].Autophagy,2014,10(12) : 2099-2108.
[7]Aveleira CA,Botelho M,Carmo-Silva S,et al.Neuropeptide Y stimulates autophagy in hypothalamic neurons[J].Proc Natl Acad Sci U S A,2015,112 (13) : E1642-E1651.
[8]Erlich S,Alexandrovich A,Shohami E,et al.Rapamycin is a neuroprotective treatment for traumatic brain injury [J].Neurobiol Dis,2007,26(1) : 86-93.
[9]Carloni S,Buonocore G,Balduini W.Protective role of autophagy in neonatal hypoxia-ischemia induced brain injury[J].Neurobiol Dis,2008,32(3) : 329-339.
[10]Zhang YB,LI SX,Chen XP,et al.Autophagy is activated and might protect neurons from degeneration after traumatic brain injury[J].Neurosci Bull,2008,24(3) : 143-149.
[11]Komatsu M,Waguri S,Chiba T,et al.Loss of autophagy in the central nervous system causes neurodegeneration in mice[J].Nature,2006,441(7095) : 880-884.
[12]Wang P,Guan YF,Du H,et al.Induction of autophagy contributes to the neuroprotection of nicotinamide phosphoribosyltransferase in cerebral ischemia[J].Autophagy,2012,8(1) : 77-87.
[13]Yamamoto A,Yue Z.Autophagy and its normal and pathogenic states in the brain[J].Annu Rev Neurosci,2014,37: 55-78.
[14]Mehrpour M,Esclatine A,Beau I,et al.Overview of macro-autophagy regulation in mammalian cells[J].Cell Res,2010,20(7) : 748-762.
[15]Gabryel B,Kost A,Kasprowska D.Neuronal autophagy in cerebral ischemia is a potential target for neuroprotective strategies[J].Pharmacol Rep,2012,64(1) : 1-15.
[16]Jan CR,Su JA,Teng CC,et al.Mechanism of maprotiline-induced apoptosis: role of[Ca2+]i,ERK,JNK and caspase-3 signaling pathways[J].Toxicology,2013,304: 1-12.
[17]Adhami F,Liao G,Morozov YM,et al.Cerebral ischemia-hypoxia induces intravascular coagulation and autophagy [J].Am J Pathol,2006,169(2) : 566-583.
[18]Balduini W,Carloni S,Buonocore G,et al.Autophagy in hypoxia-ischemia induced brain injury[J].J Matern Fetal Neonatal Med,2012,25 Suppl 1: 30-34.
[19]Zhao Y,Chen G,Zhang W,et al.Autophagy regulates hypoxia-induced osteoclastogenesis through the HIF-1α/BNIP3 signaling pathway[J].J Cell Physiol,2012,227 (2) : 639-648.
[20]Tzeng YW,Lee LY,Chao PL,et al.Role of autophagy in protection afforded by hypoxic preconditioning against MPP+-induced neurotoxicity in SH-SY5Y cells[J].Free Radic Biol Med,2010,49(5) : 839-846.
[21]周天恩,張萌,楊正飛,等.亞低溫減輕氧糖剝奪所致的大鼠海馬神經元損傷[J].中國病理生理雜志,2013,29(7) : 1165-1170.
[22]Cui C,Zhou T,Li J,et al.Proteomic analysis of the mouse brain after repetitive exposure to hypoxia[J].Chem Biol Interact,2015,236: 57-66.
[23]Sarkar C,Zhao Z,Aungst S,et al.Impaired autophagy flux is associated with neuronal cell death after traumatic brain injury[J].Autophagy,2014,10(12) : 2208-2222.
(責任編輯:林白霜,余小慧)
Hypoxic preconditioning alleviates oxygen-glucose deprivation in PC12 cells: the involvement of autophagy
LU Na,WEI Lin-yu,WANG Bao-ying,LI Xin-juan,LI Chao-kun,BAI Rui-ying,LI Dong-liang
(Department of Physiology and Neurobiology,Xinxiang Medical University,Xinxiang 453003,China.E-mail: 13462225817@163.com)
[ABSTRACT]AIM: To examined the effects of hypoxic preconditioning (HPC) on oxygen-glucose deprivation (OGD) -induced PC12 cells,and to investigate its possible mechanisms of autophagy.METHODS: Cultured PC12 cells were randomly divided into control group,HPC group,3-methyladenine (3-MA) group,HPC+ OGD group,3-MA+ HPC+ OGD group and OGD group.CCK-8 assay was used to detect the cell viability.The caspase-3 activity was also tested.TUNEL staining and flow cytometry were used to detect the cell apoptosis.The protein levels of apoptosis-related protein caspase-3 and autophagy-marked protein LC3-2 and beclin-1 were determined by Western blot.RESULTS: Compared with control group,the viability of PC12 cells was significantly reduced,and the activity of caspase-3 was significantly increased in OGD group.Compared with 3-MA+ HPC+ OGD group and OGD group,the viability of PC12 cells was significantly increased,and the activity of caspase-3 was significantly reduced in HPC+ OGD group (P<0.05).The PC12 cell injury was apparent after OGD with a great increase in the apoptotic rate (P<0.05).Compared with OGD group,the apoptotic rate significantly decreased in HPC+ OGD group (P<0.05).Compared with control group,the protein level of cleaved caspase-3 was significantly increased in OGD group (P<0.05).Compared with OGD group,the protein level of cleaved caspase-3 was significantly decreased,and the levels of LC3-2 and beclin-1 were significantly increased in HPC+ OGD group (P<0.05).CONCLUSION: OGD decreases cell survival and induces apoptosis.Activation of cell autophagy may be the mechanism by which hypoxic preconditioning protects the PC12 cells from OGD induced injury.
[KEY WORDS]Autophagy; Apoptosis; Hypoxic preconditioning; Oxygen-glucose deprivation
通訊作者△Tel: 0373-3029104; E-mail: 13462225817@163.com
*[基金項目]河南省教育廳科學技術研究重點項目(No.14A310009; No.14A310019)
[收稿日期]2015-03-27
[文章編號]1000-4718(2015)09-1627-06
[中圖分類號]R363.21
[文獻標志碼]A
doi:10.3969/j.issn.1000-4718.2015.09.017

