弓形蟲核苷三磷酸水解酶-II真核表達質粒的構建與鑒定
陳 鐳,李成朋,陳 弟,趙徐寒暉,蔣 凱,林佳鑫,劉陽陽,胡 昕,譚 峰
弓形蟲核苷三磷酸水解酶-II真核表達質粒的構建與鑒定
陳 鐳1,李成朋1,陳 弟1,趙徐寒暉1,蔣 凱1,林佳鑫2,劉陽陽2,胡 昕2,譚 峰3
目的 構建弓形蟲核苷三磷酸水解酶-II(NTPase-II)基因真核表達質粒pcDNA3.1(+)-NTPase-II并在COS-7細胞中進行瞬時表達。方法 以pBAD-HisB-NTPase-II質粒為模板,PCR擴增NTPase-II目的基因,將其克隆到pcDNA3.1(+)真核表達載體中,雙酶切及測序鑒定重組質粒。陽離子脂質體法轉染COS-7細胞并經SDS-PAGE和Western Blot檢測目的蛋白的表達。結果 經鑒定,弓形蟲pcDNA3.1(+)-NTPase-II核酸疫苗質粒構建成功。以脂質體法轉染COS-7細胞后,轉染細胞可成功地表達弓形蟲NTPase-II蛋白。結論 證實了弓形蟲NTPase-II蛋白能在真核細胞中表達,為該基因的核酸疫苗研究提供了實驗依據。
剛地弓形蟲; 核苷三磷酸水解酶;真核表達
剛地弓形蟲是一種廣泛寄生于人和溫血動物的機會致病性原蟲,由于其復雜的生活史、感染方式和致病機制,它對人類的危害也日益受到重視。然而,迄今為止尚未獲得理想的治療藥物[1]。近年來,弓形蟲疫苗和免疫保護性研究已逐漸引起了重視,并認為疫苗接種將是預防弓形蟲病的最佳策略[2]。
剛地弓形蟲屬于嘌呤營養缺陷型,因此必須從宿主細胞直接獲取嘌呤,這是弓形蟲細胞內寄生的原因。體外研究發現[3], 弓形蟲產生的核苷三磷酸水解酶(nucleoside triphosphate hydrolase,NTPase)在二巰基化合物的激活作用下, 能連續水解所有的三磷酸核苷和三磷酸脫氧核苷至單磷酸形式。在宿主細胞內,弓形蟲正是以此形式水解宿主細胞內三磷酸腺苷(ATP),以合成自身生存所必需的嘌呤核苷酸[4]。因此,弓形蟲NTPase有望成為潛在的疫苗靶點。
本實驗擬構建pcDNA3.1(+)-NTPase-II重組質粒,并采用脂質體轉染COS-7細胞,觀察弓形蟲NTPase-II蛋白表達情況,為下一步研究重組質粒在動物體內的免疫效果奠定基礎。
1 材料與方法
1.1 菌株、質粒、細胞 本實驗所用菌株、質粒與細胞若無特別說明,均由溫州醫科大學寄生蟲學教研室保存,包括:大腸埃希菌(E.coli)DH5α,原核表達質粒pBAD-HisB-NTPase-II,以及COS-7細胞。pcDNA3.1(+)載體購自上海英濰捷基公司。
1.2 主要試劑 限制性內切酶XmaI、SpeI購自大連寶生物有限公司;T4 DNA連接酶、2×PCR 聚合酶鏈反應試劑盒購自上海晶美生物技術有限公司;小量質粒抽提試劑盒購自寧波中鼎生物技術有限公司, DNA 凝膠回收試劑盒購自上海生工生物工程技術有限公司;高糖型DMEM培養基、胎牛血清等購自Gibco公司;Lipofecter脂質體轉染試劑、細胞裂解液NP-40購自碧云天生物技術研究所;重組弓形蟲NTPase-II蛋白、鼠源抗弓形蟲NTPase-II單抗由溫州醫科大學寄生蟲學教研室制備保存;HRP標記的兔抗鼠IgG購自Sigma公司。
1.3 PCR擴增TgNTPase-II編碼基因 根據TgNTPase-II基因序列(GenBank: L39079.1)設計引物。上游引物:5′-TCC CCC CGG GAC AGA CTC ATC GTC ACT CCG G-3′;下游引物:5′-GGA CTA GTT CAC AGA TTG TGA GAA TAT CCC G-3′。劃線處分別為XmaI與SpeI酶切位點。引物由上海英濰捷基公司合成。以原核表達質粒pBAD-HisB-NTPase-II為模板,PCR擴增NTPase-II編碼基因。PCR條件為:95 ℃預變性5 min;95 ℃45 s,55 ℃45 s,72 ℃90 s,循環35次;72 ℃延伸10 min。擴增產物進行1%瓊脂糖凝膠電泳鑒定。
1.4 真核表達質粒構建 將上述PCR產物與載體pcDNA3.1(+)以XmaI、SpeI分別進行雙酶切、T4連接酶連接,構建真核表達質粒pcDNA3.1(+)-NTPase-II。質粒轉化大腸桿菌DH5α后挑取克隆進行雙酶切驗證,隨后將鑒定的陽性克隆送上海英濰捷基公司進行測序驗證。對于測序正確的克隆提取質粒保存于-20 ℃中備用。
1.5 細胞培養及轉染 以5% CO2、37 ℃常規培養COS-7細胞于DMEM細胞培養液(含10%胎牛血清、100 μg/mL青鏈霉素及谷氨酸)中,待細胞密度達80%時,按5×105個細胞/孔接種6孔板。繼續培養24 h,棄去原培養基,PBS清洗一次后按2 mL/孔換入不含抗生素與谷氨酸的DMEM培養基。將保存的pcDNA3.1(+)-NTPase-II質粒調整濃度后按3 μg/孔加入,根據脂質體轉染試劑盒操作步驟轉染細胞。以pcDNA3.1空載體作為陰性對照。各組于細胞培養箱內培養5~6 h,棄去含有Lipofecter脂質體的培養液。加入正常細胞培養基2 mL/孔繼續培養48 h。
1.6 Western Blot分析表達產物 培養48 h后,收集轉染后細胞提取總蛋白。將pcDNA3.1-NTPase質粒轉染組、pcDNA3.1空載體轉染組以及陽性對照組(重組NTPase-II蛋白)進行12% SDS-PAGE電泳后,以抗弓形蟲NTPase-II單抗作為一抗,HRP標記的抗小鼠IgG為二抗進行Western blot分析。
2 結 果
2.1 PCR產物擴增目的片段 對PCR擴增出的產物進行1%瓊脂糖凝膠電泳,證實所擴增片段約為1 800 bp,其大小與目的片段相符(圖1)。

Lane M: DNA marker; Lane 1: PCR products of NTPase-II.
2.2 pcDNA3.1(+)-NTPase-II重組質粒的構建與鑒定 以XmaI與SpeI分別雙酶切PCR產物和載體后進行T4連接酶連接,篩選出陽性克隆質粒經雙酶切后獲得約5.6 kb和 1.8 kb兩條電泳條帶,其大小與載體片段和目的片段長度相符(圖2)。同時,測序結果進一步證實重組質粒構建成功。
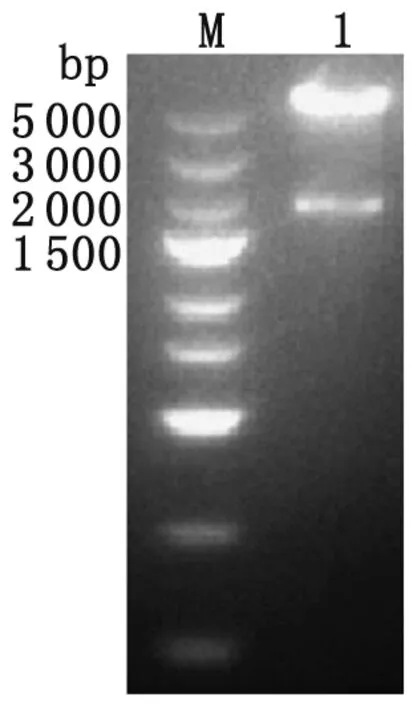
Lane M: DNA marker; Lane 1: NTPase-II digested byXmaI andSpeI.
圖2 重組質粒雙酶切鑒定
Fig.2 Identification of recombinant plasmids digested byXmaI andSpeI
2.3 Western blot分析重組質粒體外表達 pcDNA3.1(+)-NTPase-II重組質粒體外轉染COS-7細胞,48 h后收集裂解細胞,以本實驗室前期制備的特異性單克隆抗體進行Western blot檢測。結果表明,與陽性對照相同,實驗組在約70 kDa處有一條特異條帶,而陰性對照組未顯示有目的條帶(圖3),從而證實本實驗中所構建的pcDNA3.1(+)-NTPase-II重組質粒可在真核表達體系中進行瞬時表達。
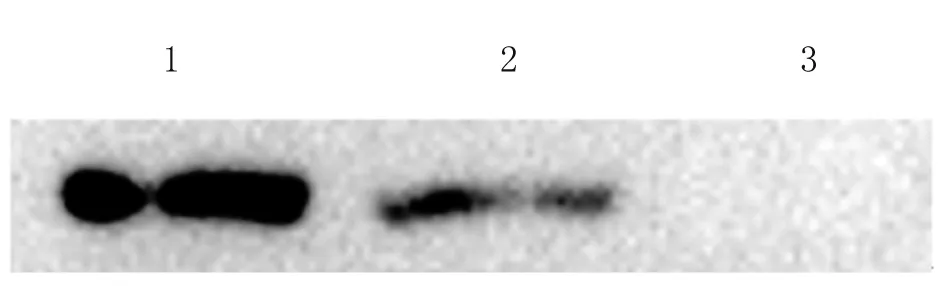
Lane 1: Positive control; Lane 2: Transfected with pcDNA3.1-NTPase-II; Lane 3: Negative control (pcDNA3.1 empty plasmid).
圖3 Western blot 鑒定
Fig.3 Western blot analysis of the recombinant protein
3 討 論
本研究針對弓形蟲NTPase-II成功構建了真核重組表達質粒pcDNA3.1(+)-NTPase-II。該質粒在轉染COS-7宿主細胞后,經Western blot實驗證實可在細胞中成功表達。弓形蟲的發育屬嘌呤營養缺陷型——無法通過從頭途徑合成嘌呤。而通過補救合成途徑從宿主細胞直接獲取嘌呤這一途徑常常由于納蟲泡膜的分隔作用而無法實現。弓形蟲NTPase存在于速殖子期的膜表面[5],占速殖子期整個蟲體蛋白的2%~8%[6]。當侵入宿主細胞后,該酶會被分泌入納蟲泡的網狀管腔系統中,經二巰基化合物(如DTT)的激活進而連續水解所有的三磷酸核苷、三磷酸脫氧核苷至單磷酸,并同時合成維持自身生存所必需的嘌呤核苷酸。本實驗室前期研究發現,特異性抗弓形蟲NTPase-II蛋白單克隆抗體可顯著抑制酶活性、降低蟲株在宿主細胞內的增殖速度[7]。由此可見,NTPase是細胞內寄生的蟲體獲取嘌呤的一種重要酶類,在弓形蟲的寄生、繁殖方面具有重要意義,并是一種潛在的、可用于開發弓形蟲病防治藥物或疫苗的新靶點。
弓形蟲基因組編碼兩種NTPase蛋白:NTPase-I和NTPase-II[3,8-9]。研究表明,NTPase-I僅存在于弓形蟲強毒株,而NTPase-II則存在于幾乎所有的弓形蟲蟲株。同時,除在剛地弓形蟲和犬新孢子蟲體內[5,10]發現這種依賴DTT激活的NTPase外,尚未在其他物種中發現該酶,并且Asai等[10]發現,犬新孢子蟲速殖子體內只表達NTPase-I。因此,以NTPase-II蛋白作為防治弓形蟲病的藥物或疫苗靶點具有更廣泛地應用前景。
通過體內、外實驗,本實驗室已經證實弓形蟲NTPase-II蛋白在免疫動物后可為其提供一定的免疫保護作用[11]。然而,由于核酸疫苗相比蛋白質疫苗具有生產簡便安全、成本低廉、穩定性好且具有良好的誘導細胞免疫和體液免疫的優點,因此,研究核酸疫苗在一定意義上比基因工程亞單位疫苗更有發展前景。基于本實驗所獲得的pcDNA3.1(+)-NTPase-II真核重組表達質粒,為NTPase-II核酸疫苗的進一步應用提供了實驗基礎。
[1]el Kouni MH. Adenosine metabolism inToxoplasmagondii: potential targets for chemotherapy [J]. Curr Pharm Des, 2007, 13(6): 581-597. DOI: 10.2174/138161207780162836
[2]Kur J, Holec-Gasior L, Hiszczynska-Sawicka E. Current status of toxoplasmosis vaccine development[J]. Expert Rev Vaccines, 2009, 8(6): 791-808. DOI: 10.1586/erv.09.27
[3]Bermudes D, Peck KR, Afifi MA, et al. Tandemly repeated genes encode nucleoside triphosphate hydrolase isoforms secreted into the parasitophorous vacuole ofToxoplasmagondii[J]. J Biol Chem, 1994, 269(46):29252-29260.
[4]Silverman JA, Qi H, Riehl A, et al. Induced activation of theToxoplasmagondiinucleoside triphosphate hydrolase leads to depletion of host cell ATP levels and rapid exit of intracellular parasites from infected cells[J]. J Biol Chem, 1998, 273(20): 12352-12359. DOI: 10.1074/jbc.273.20.12352
[5]Kikuchi T, Furuta T, Kojima S, et al. Membrane localization and demonstration of isoforms of nucleoside triphosphate hydrolase fromToxoplasmagondii[J]. Parasitology, 2001, 122(1): 15-27. DOI: 10.1017/S0031182000007101[6]Asai T, Kanazawa T, Kobayashi S, et al. Do protozoa conceal a high potency of nucleoside triphosphate hydrolysis present inToxoplasmagondii[J]. Comp Biochem Physiol, 1986, 85(2): 365-367. DOI:10.1016/0305-0491(86)90013-1
[7]Tan F, Hu X, Pan CW, et al. Monoclonal antibodies against nucleoside triphosphate hydrolase-II can reduce the replication ofToxoplasmagondii[J]. Parasitol Int, 2010, 59(2):141-146. DOI:10.1016/j.parint.2009.12.007
[8]Berninsone P, Miret JJ, Hirschberg CB. The Golgi guanosine diphosphatase is required for transport of GDP-mannose into the lumen of Saccharomyces cerevisiae Golgi vesicles [J]. J Biol Chem, 1994, 269 (1): 207-211.
[9]Johnson MS, Broady KW, Johnson AM. Differential recognition ofToxoplasmagondiirecombinant nucleoside triphosphate hydrolase isoforms by naturally infected human sera [J]. Int J Parasitol, 1999, 29 (12): 1893-1905. DOI:10.1016/S0020-7519(99)00139-3
[10]Asai T, Howe DK, Nakajima K, et al.Neosporacaninum: tachyzoites express a potent type-I nucleoside triphosphate hydrolase, but lack nucleoside diphosphate hydrolase activity [J]. Exp Parasitol, 1998, 90(3): 277-285. DOI:10.1006/expr.1998.4346
[11]Tan F, Hu X, Luo FJ, et al. Induction of protective Th1 immune responses in mice by vaccination with recombinantToxoplasmagondiinucleoside triphosphate hydrolase-II [J]. Vaccine, 2011, 29(15):2742-2748. DOI: 10.1016/j.vaccine.2011.01.089.
Tan Feng, Email: tanfengsong@163.com
Construction and identification of eukaryotic expression plasmid ofToxoplasmagondiiNTPase-II gene
CHEN Lei1,LI Cheng-peng1,CHEN Di1,ZHAO Xuhanhui1, JIANG Kai1,LIN Jia-xin2,LIU Yang-yang2,HU Xin2,TAN Feng3
(1.TheFirstClinicalMedicalCollege,WenzhouMedicalUniversity,Wenzhou325035,China; 2.SchoolofMedicalLaboratoryScienceandSchoolofLifeScience,WenzhouMedicalUniversity,Wenzhou325035,China; 3.TheSchoolofBasicMedicalSciences,WenzhouMedicalUniversity,Wenzhou325035,China)
We constructed the eukaryotic expression plasmid pcDNA3.1(+)-NTPase-II ofToxoplasmagondiiand assess the expression of recombinant protein in COS-7 cells. The prokaryotic expression plasmid pBAD-HisB-NTPase-II constructed previously in our laboratory was used as templates to amplify the target gene by PCR. The resulting PCR products were cloned into the vector pcDNA3.1(+) for construction of eukaryotic expression plasmid pcDNA3.1(+)-NTPase-II. Then, the plasmids were transfected into COS-7 cells after identification with double enzyme digestion and sequencing. Finally, Western blot was performed to detect the expression of NTPase-II in COS-7. The result revealed thatToxoplasmaNTPase-II could be expressed in COS-7 cells when compared with empty pcDNA3.1(+) control group. Taken together, the plasmid pcDNA3.1(+)-NTPase-II constructed successfully will play an important role in development of a potential gene vaccine.
Toxoplasmagondii; nucleoside triphosphate hydrolase (NTPase); eukaryotic expression
譚峰:Email: tanfengsong@163.com
1.溫州醫科大學第一臨床醫學院,溫州 325035; 2.溫州醫科大學生命科學學院檢驗醫學院,溫州 325035; 3.溫州醫科大學基礎醫學院,溫州 325035
Supported by the Fund of Science and Technology of Zhejiang Province (No. 2014C33161) and the Student Scientific Research Project of Wenzhou Medical College (No. wyx201301011)
10.3969/cjz.j.issn.1002-2694.2015.06.005
R382.5
A
1002-2694(2015)06-0519-03
2014-10-11;
2014-11-26
浙江省科技廳公益性項目(No.2014C33161)和溫州醫科大學學生科研項目(No.wyx201301011)聯合資助

