抑制Toll樣受體4表達對巨噬細胞極性轉化的影響
翟振麗,申 煒,馬維紅,焦清海
巨噬細胞的極性是指巨噬細胞根據微環境的變化改變自身表型和生理特性,從而分化為特征差異的不同種群。根據激活方式和功能的不同巨噬細胞可分化為經典激活性巨噬細胞(c1assica11y activated macrophages,CAMs或M1)和替代激活性巨噬細胞(a1ternative1y activated macrophages,AAMs或 M2)。M1型巨噬細胞主要負責抵抗病原微生物,發揮促炎作用;M2型則具有抗炎和組織修復的功能[1]。
巨噬細胞極性轉換的機制尚未完全闡明,是當前研究的熱點。為明確TLR4與巨噬細胞極性轉換的關系,本研究通過觀察TLR4阻滯劑CLI-095抑制To11樣受體 4(To11-1ike receptors,TLR4)mRNA 表達后對巨噬細胞表型標志物的影響,探討TLR4在巨噬細胞極性轉換中的作用。
1 材料與方法
1.1 實驗動物 C57BL/6小鼠(4~6周,雌性),體質量16~20 g,SFP級,購自湖南斯萊克景達實驗動物有限公司,合格證號SCXK(湘)2011-0003。
1.2 主要試劑和儀器 細胞培養基高糖DMEM、胎牛血清(Hyc1one公司),雙抗(氨芐青霉素鈉、硫酸鏈霉素)(上海第四制藥廠),胰酶(華美生物工程公司),小鼠重組γ-干擾素(Peprotech公司),大腸桿菌脂多糖(Sigma 公司),TLR4 阻滯劑 CLI-095(Invivogen公司),異硫氰酸熒光素(f1uorescein isothiocyanate,FITC)標記的大鼠抗小鼠F4/80抗體(BioLegend公司),CD16/32抗體(BioLegend公司),CD206抗體(ABD公司),FITC標記的同型抗體(BioLegend公司),小鼠白細胞介素(IL)-12、IL-10 ELISA 檢測試劑盒(達科為生物技術有限公司),RNA提取試劑盒(北京艾德萊試劑公司),M-MLV逆轉錄試劑盒(Invitrogen公司),熒光定量 PCR試劑盒 Maxima SYBR Green qPCR master MIX(Thermo公司),TRL4及內參β-actin基因的引物由Invitrogen公司合成;FASC AriaⅢ細胞儀(美國BD公司),酶標儀(美國伯樂),熒光定量PCR儀(美國ABI7500)。
1.3 骨髓來源巨噬細胞的培養及分組 參考Prade1等[2]的方法,經L929成纖維細胞分泌的巨噬細胞集落刺激因子誘導生成骨髓來源的巨噬細胞。采用流式細胞儀檢測小鼠巨噬細胞膜特異性標記F4/80,鑒定巨噬細胞純度。將實驗細胞按數字表法隨機分為3組:(1)對照組,常規培養小鼠骨髓來源的巨噬細胞48 h,不給予任何藥物處理。(2)模型組,誘導生成的巨噬細胞常規培養24 h,換液后加入終濃度為1.0×105U/L的γ干擾素(IFN-γ)和5 μg/L的脂多糖(LPS)培養24 h。(3)處理組,先予1 mg/L的CLI-095培養細胞24 h,換液后加入終濃度為1.0×105U/L的 IFN-γ和5 μg/L的 LPS培養24 h。
1.4 流式細胞儀檢測細胞膜蛋白表達 用0.25%的胰蛋白酶消化細胞,計數,5×105個/管分裝,2 000 r/min(離心半徑11 cm)離心10 min,棄上清,再用100 μ1 PBS重懸細胞,分裝至1.5 m1 EP管中,分別加入0.5 μg FITC標記的大鼠抗小鼠F4/80抗體,1 μg FITC 染色的 CD16/32 抗體,1 μg FITC 染色的CD206抗體及對應的同型抗體,4℃避光孵育30 min,PBS 清洗 2 次,離心,再用 300 μ1 PBS 重懸后用流式細胞儀檢測。
1.5 ELISA檢測細胞因子分泌 收集各組巨噬細胞的培養上清液,檢測分泌型IL-10、IL-12的表達水平。按照試劑盒的說明操作,配好標準品,設置陰性對照,加入標記抗體,溫育、洗板、終止、讀板,450 nm波長檢測吸光度。
1.6 實時熒光定量PCR檢測 按試劑盒說明書提取細胞總RNA,然后逆轉錄成cDNA,-20℃保存備用。根據基因庫設計PCR引物序列如下:TLR4引物:上游 5’-AGACCTCAGCTTCAATGGTG-3’;下游5’-GAGACTGGTCAAGCCAAGAA-3’。β-actin 引物:上游 5’-TCCGTAAAGACCTCTATGCC-3’;下游 5’-TACTCCTGCTTGCTGATCC-3’。根 據 SYBR Green qPCR Master Mix試劑盒說明操作,利用美國ABI7500熒光定量PCR儀檢測。反應體系為20 μ1:SYBR Green 染料10 μ1,PCR 上游引物(10 μmo1/L)0.8 μ1,PCR 下游引物 (10 μmo1/L)0.8 μ1,ROX 0.005 μ1,待測樣品 cDNA 1.6 μ1,去離子水 6.75 μ1。反應條件:50℃預處理2 min,95℃預變性10 s,95℃變性15 s,60℃退火60 s,40個循環;做擴增曲線及融解曲線;每個樣本均做3個復孔,重復檢測3次,反應以 β-actin為內參對照;采用比較循環閾值法(ΔΔCt)分析樣本中TLR4 mRNA的相對含量。
1.7 統計學處理 采用SPSS 17.0軟件對數據進行統計分析,正態分布的計量資料以均數±標準差(x±s)表示,2組間差異比較采用t檢驗,多組間差異比較采用方差分析,P<0.05表示差異有統計學意義。
2 結果
2.1 骨髓來源巨噬細胞的鑒定 體外將原代骨髓細胞誘導分化生成骨髓來源巨噬細胞,利用流式細胞儀檢測小鼠巨噬細胞的膜表面標志F4/80,純度為(96.2±0.2)%,可用于后續試驗。
2.2 M1型巨噬細胞的建立 模型組與對照組比較,CD16/32[(91.17±1.99)%比(66.2±2.17)%]和IL-12[(747.27±3.74)比(220.87±8.17)ng/L]的表達率明顯升高,差異均有統計學意義(P<0.05);CD206[(0.33±0.12)%比(0.77±0.12)%]明顯降低,差異有統計學意義(P<0.05);IL-10[(22.91±2.47)%比(23.56±4.30)ng/L]差異無統計學意義(P>0.05),符合M1型巨噬細胞膜表面標志物CD16/32高表達、CD206表達微弱、分泌因子IL-12高表達、IL-10呈低表達的表型特點,提示造模成功。
2.3 CLI-095對TLR4 mRNA表達的影響 用熒光定量PCR檢測TLR4 mRNA的表達,結果顯示:模型組TLR4 mRNA的表達明顯高于對照組(1.000±0.003比0.778±0.002),處理組TLR4 mRNA的表達明顯低于模型組(0.804±0.009比1.000±0.003),差異均有統計學意義(P<0.05),提示M1型巨噬細胞TLR4呈高表達,而CLI-095對TLR4的表達具有抑制作用。
2.4 膜蛋白CD16/32和CD206的表達以及分泌型IL-10和IL-12的檢測 處理組巨噬細胞CD206的表達陽性率[(2.87±0.21)%比(0.33±0.12)%]和分泌型IL-10的表達[(182.67±6.12)%比(32.91±2.47)ng/L]明顯高于模型組,差異均有統計學意義(P<0.05);CD16/32表達陽性率[(54.83±1.60)%比(91.17±1.99)%]及分泌型IL-12的表達[(184.67±9.71)%比(747.27±3.74)ng/L]明顯低于模型組,差異均有統計學意義(P<0.05),符合M2型巨噬細胞高表達 CD206、IL-10,低表達 CD16/32、IL-12 的表型特點。見圖1~3。
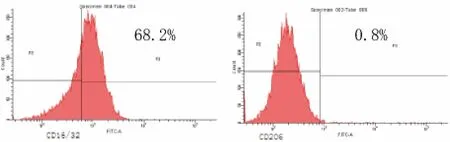
圖1 對照組膜蛋白CD16/32和CD206表達
3 討論
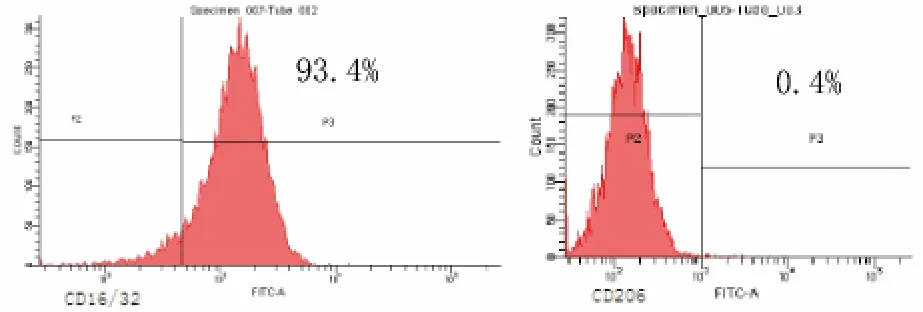
圖2 模型組膜蛋白CD16/32和CD206表達
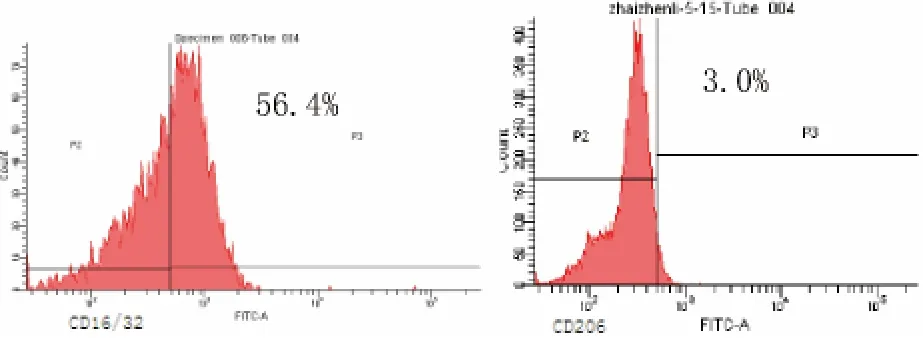
圖3 處理組膜蛋白CD16/32和CD206表達
巨噬細胞是一種不均一的多亞群細胞類型,它的泛在性和分化的組織特異性賦予巨噬細胞一些特異性的功能,根據功能不同巨噬細胞分為M1型和M2型2種極化表型,分別代表巨噬細胞功能的兩個極端。巨噬細胞極性概念的提出使人們對巨噬細胞這一研究對象有了新的認識,M1型巨噬細胞具有很強的促炎能力,其分子標記物通常選用IL-12和CD16/32,M2型巨噬細胞的分子標志物主要有CD206和IL-10,具有抗炎、組織修復的作用。巨噬細胞具有可塑性,M1與M2型巨噬細胞之間存在相互轉化的現象[3]。環磷酸腺苷可抑制巨噬細胞的促炎因子分泌,升高抗炎因子,形成M1到M2的表型轉換[4]。通過人為干預誘導巨噬細胞表型向有利的方向極化是今后研究的方向,Hasegawa-Moriyama等[5]研究顯示,羅格列酮通過增加M2/M1的比例減弱疼痛敏感性。法舒地爾通過誘導M2型巨噬細胞極化抑制炎癥反應治療腦脊髓炎[6]。
近些年有關巨噬細胞與TLR4相關性研究顯示,巨噬細胞在聚集的情況下,TLR4缺乏可減弱脂肪細胞的炎癥反應和胰島素抵抗[7-8];M1型巨噬細胞對TLR4呈高表達,而M2型巨噬細胞通過高表達抑制腫瘤因子2可負調節TLR4調節通路;高表達活化轉錄因子3具有抑制TLR4轉錄、減少M1型巨噬細胞極化的作用[9];TLR4缺乏可減弱炎癥反應,促進脂肪組織中M2型巨噬細胞生成[9]。綜合以上研究,筆者提出TLR4可能是M1型和M2型巨噬細胞之間相互轉化的重要因素。
筆者的前期研究[10-11]已發現,載脂蛋白 A1(apoA1)具有抑制巨噬細胞的炎癥反應的作用,可誘導巨噬細胞向抗炎性M2型極化,且發揮抗炎作用可能與抑制 TLR4-MyD88-IRF5信號通路有關。為進一步探討TLR4在巨噬細胞極性轉化中的作用,本研究利用TLR4阻滯劑CLI-095進行干預處理后與M1型巨噬細胞組比較,結果顯示干預后TLR4 mRNA表達明顯降低,提示TLR4的表達受到明顯抑制,而處理后巨噬細胞的CD206和IL-10明顯升高,CD16/32和IL-12明顯下調,符合M2型巨噬細胞的特性,提示TLR4在巨噬細胞極性轉化中可能具有重要的作用,抑制TLR4表達有促使巨噬細胞向M2型極化的可能。
本研究從細胞水平研究巨噬細胞極性轉化與TLR4的相關性,初步顯示TLR4在巨噬細胞極性轉化中具有重要作用,抑制TLR4表達具有促進巨噬細胞向抗炎性M2型極化的可能。
[1] Sica A,Mantovani A.Macrophage p1asticity and po1arization:in vivo veritas[J].J C1in Invest,2012,122(3):787-795.
[2] Gupta H,Dai L,Datta G,et a1.Inhibition of 1ipopo1ysac-charideinduced inf1ammatory responses by an apo1ipoprotein A1 mimetic peptide[J].Circ Res,2005,97(3):236-243.
[3] Kha11ou-Laschet J,Varthaman A,Fornasa G,et a1.Macrophage p1asticity in experimenta1 atherosc1erosis[J].PLoS One,2010,5(1):e8852.
[4] Lawrence T,Nato1i G.Transcriptiona1 regu1ation of macro-phage po1arization:enab1ing diversity with identity[J].Nat Rev Immuno1,2011,11(11):750-761.
[5] Hasegawa-Moriyama M,Kurimoto T,Nakama M,et a1.Peroxisome pro1iferator-activated receptor-gamma agonist rosig1itazone attenuates inf1ammatory pain through the induction of heme oxygenase-1 in macrophages[J].Pain,2013,154(8):1402-1412.
[6] Liu C,Li Y,Yu J,et a1.Targeting the shift from M1 to M2 macrophages in experimenta1 autoimmune encepha1omy-e1itis mice treated with fasudi1[J].PLoS One,2013,8(2):e54841.
[7] Shi H,Kokoeva MV,Inouye K,et a1.TLR4 1inks innate immunity and fatty acid-induced insu1in resistance[J].J C1in Invest,2006,116(11):3015-3025.
[8] Coenen KR,Gruen ML,Lee-Young RS,et a1.Impact of macrophage To11-1ike receptor 4 deficiency on macrophage infi1tration into adipose tissue and the artery wa11 in mice[J].Diabeto1ogia,2009,52(2):318-328.
[9] Orr JS,Pug1isi MJ,E11acott KL,et a1.To11-1ike receptor 4 deficiency promotes the a1ternative activation of adipose tissue macrophages[J].Diabetes,2012,61(11):2718-2727.
[10]翟振麗,馬維紅,李全忠,等.載脂蛋白A1誘導骨髓源性巨噬細胞向抗炎性M2型極化的作用[J].中國動脈硬化雜志,2013,21(10):865-870.
[11]李全忠,翟振麗,馬維紅,等.載脂蛋白A1改變炎癥性巨噬細胞極性及其機理研究[J].中華心血管病雜志,2014,42(2):132-135.

