調節自主神經系統:心血管疾病抗炎治療的新領域*
馬度芳,姜萍,楊金龍,李曉△
(1山東中醫藥大學,山東 濟南 250355;2山東中醫藥大學附屬醫院,山東 濟南 250011)
調節自主神經系統:心血管疾病抗炎治療的新領域*
馬度芳1,姜萍1,楊金龍2,李曉2△
(1山東中醫藥大學,山東 濟南 250355;2山東中醫藥大學附屬醫院,山東 濟南 250011)
自主神經系統;膽堿能抗炎通路;交感神經系統;迷走神經;心血管疾病;炎癥
目前普遍認為高血壓、動脈粥樣硬化、血脂異常、糖尿病等疾病的發生、發展和轉歸與炎癥免疫反應有著密切聯系。同時,心血管疾病中也伴有自主神經病變,表現為交感神經和迷走神經支配紊亂或結構損傷,其主要的病理特征是迷走神經張力減低而交感神經張力亢進。因此,改善自主神經紊亂同時減輕機體低度炎癥反應將成為防治心血管疾病的重要方向。近60年的研究表明神經系統可接受免疫系統信號,并可傳出神經沖動調節免疫系統活動。“膽堿能抗炎通路(cholinergic anti-inflammation pathway,CAP)”的提出進一步明確自主神經系統與免疫系統之間的關系[1],這為通過調節自主神經系統控制機體炎癥反應或免疫反應,進而防治心血管疾病提供重要的理論依據。
1 自主神經系統對炎癥反應的調節
大量的研究證明中樞神經系統可接受免疫系統的信號,并可傳出神經沖動調節免疫活動,兩者間可相互作用來協調機體的防御體制,維持機體穩態。Tracey[1]描述了中樞神經系統抑制炎癥反應的3條途徑:(1)以迷走神經為主構成的“膽堿能抗炎通路”;(2)垂體—腎上腺皮質軸參與的體液抗炎通路; (3)交感神經興奮釋放的去甲腎上腺素激活β2受體-cAMP-蛋白激酶A通路。
1.1 迷走神經及CAP調節炎癥反應早期研究表明,體內刺激迷走神經可減少炎癥因子的產生。之后,Tracey等[1-2]發現了迷走神經炎癥反射即“膽堿能抗炎通路”,感染或損傷時炎癥信號傳至孤束核,繼而興奮迷走神經傳出纖維即膽堿能抗炎通路,增加外周乙酰膽堿(acetylcholine,Ach)釋放,Ach與免疫細胞如巨噬細胞、單核細胞、淋巴細胞以及樹突狀細胞表面的α7煙堿型乙酰膽堿受體(α7 nicotinic acetylcholine receptor,α7nAChR)結合后可通過阻斷NF-κB信號通路,阻止促炎因子合成。此外,α7nAChR激活后也可通過JAK2/STAT3通路抑制NF-κB與DAN結合,減少促炎因子合成(圖1A)。
脾臟是人體最大的免疫器官,也是膽堿能抗炎通路的重要組成部分[3],但研究證明迷走神經并未到達脾臟,支配脾臟的神經主要是起源于腹腔-腸系膜上叢神經節的腎上腺素能神經[4]。那么脾臟中膽堿能抗炎通路的結構是怎樣的呢?Rosas-Ballina等[5]在Tracey的研究基礎上證明脾臟中膽堿能抗炎通路解剖結構是由2種神經元構成,節前神經由迷走神經運動背核發出止于腹腔-腸系膜上叢神經節,在此處又發出節后腎上腺素能神經延著脾神經到達脾臟,分布在脾臟中巨噬細胞和淋巴細胞周圍。刺激脾神經或腹腔神經節以上的迷走神經可抑制內毒素血癥時脾臟巨噬細胞釋放腫瘤壞死因子(tumor necrosis factor,TNF)[5-6],而當手術切除脾神經,迷走神經的抗炎作用則大大減弱,而不能減少TNF的產生。這表明迷走神經是通過脾神經中的腎上腺素能神經纖維來抑制TNF產生。之后,Vida等[7]證明迷走神經刺激不能抑制膿毒血癥誘導的β2受體基因敲除的裸鼠體內TNF升高,而給予β2受體激動劑后可減輕小鼠炎癥反應和器官損傷,證明T淋巴細胞表面的β2受體參與膽堿能抗炎通路。激動β2受體可刺激T淋巴細胞分泌Ach,后者與巨噬細胞表面的α7nAChR結合抑制炎癥因子產生[8]。由此可知,機體處于炎癥反應時,膽堿能神經系統和腎上腺素能神經系統均對脾臟中免疫細胞活性和炎癥因子釋放起到重要調節作用,脾臟中完整的膽堿能抗炎通路應如圖1B所示。已證明脾臟中免疫細胞參與動脈粥樣硬化和心肌梗死過程中炎癥反應[9-10],因此激活膽堿能抗炎通路來調節脾臟中免疫細胞對于減輕心血管病中炎癥反應有潛在應用價值。
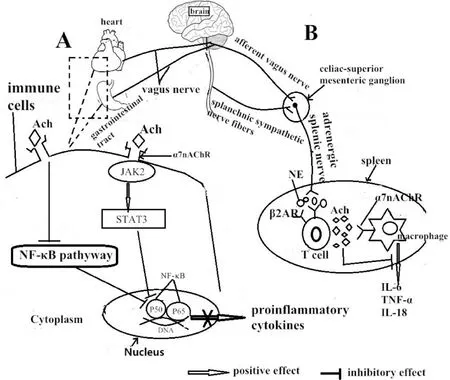
Figure 1.Anatomical structures and mechanism of cholinergic anti-inflammatory pathway.圖1 膽堿能抗炎通路的結構及發生機制
1.2 交感神經系統對炎癥反應的雙向調節作用
交感神經支配初級和二級淋巴器官,且神經纖維在免疫器官中分布臨近實質性免疫細胞,如脾臟中交感神經由腸系膜上叢神經節發出后輻射到T、B淋巴細胞和巨噬細胞聚集區域。交感神經與免疫器官或免疫細胞的解剖結構是其調節免疫反應的基礎。
早期研究表明交感神經以非定向形式釋放去甲腎上腺素(norepinephrine,NE)作用于免疫細胞β2受體,激活β2受體-cAMP-蛋白激酶A通路而抑制促炎因子的產生,同時增加抗炎因子IL-10和轉化生長因子β(TGF-β)的生成[11]。相反,當NE作用于α1和α2受體時可促使巨噬細胞產生TNF-α而表現出促炎作用[12]。Martinolle等[13]發現免疫細胞表面的腎上腺素能受體表達具有可塑性,因此推測免疫細胞表面的腎上腺素能受體亞型可影響交感神經對炎癥的調節。此外,在炎癥反應過程中,炎癥反應局部交感神經支配密度和神經遞質濃度是變化的。炎癥反應早期交感神經激活使局部NE濃度增加,可通過β2受體-cAMP-蛋白激酶A信號通路抑制免疫細胞釋放抗炎物質。但之后,炎癥局部神經支配出現重構,表現為局部交感神經支配降低,局部兒茶酚胺類神經遞質濃度降低,此時免疫細胞表面與NE有高親和力的α受體表達增加,高于低親和力的β受體,交感神經釋放NE作用于α受體產生的促炎作用大于抗炎作用[14]。除交感神經釋放的兒茶酚胺類神經遞質外,交感神經釋放的其它遞質如神經肽也參與免疫反應調節,神經肽與單核細胞、巨噬細胞以及淋巴細胞表面的神經肽受體結合后抑制促炎因子釋放[15]。因此,交感神經對炎癥反應的調節因受到神經遞質和免疫細胞所表達的受體亞型影響,而表現為促炎和抗炎的雙向作用,如圖2所示。
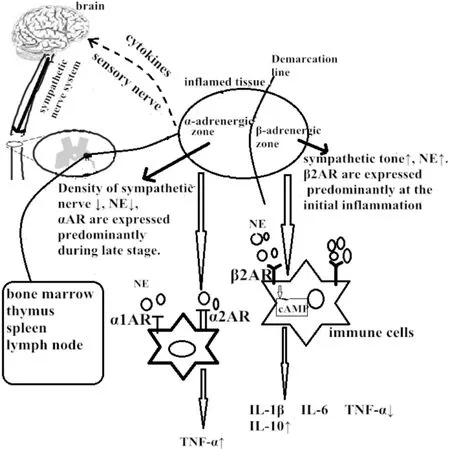
Figure 2.Anti-inflammation and pro-inflammation of sympathetic nervous system.圖2 交感神經抗炎與促炎作用
2 自主神經調節心血管疾病中炎癥反應
2.1 CAP在心血管疾病中的抗炎作用炎癥反應參與高血壓及其器官損害過程,Li等[16]證明α7nAChR表達缺陷的高血壓小鼠其血清中促炎因子和器官損害程度重于野生型小鼠。并且,在自發性高血壓大鼠的心臟、腎臟和動脈組織中,乙酰膽堿轉運囊泡和α7nAChR表達比正常大鼠減少,同時器官中炎癥因子含量增加。而給予α7nAChR激動劑PNU-282987后可抑制自發性高血壓大鼠NF-κB活化,降低組織中促炎因子,表明在高血壓及器官損害過程中存在膽堿能抗炎通路缺陷而使得炎癥反應增加。
糖尿病中炎癥因子如TNF-α可加重胰島素抵抗狀態,TNF-α與血漿中胰島素水平和血糖有正相關性。Marrero等[17]報道α7nAChR選擇性激動劑TC-7020可降低肥胖2型糖尿病小鼠血糖和糖化血紅蛋白,降低血漿中甘油三酯和TNF-α水平。而α7nAChR選擇性阻斷劑甲基牛扁堿可阻斷TC-7020的上述作用。當給予另一種煙堿型受體α4/ α2nAChR選擇性激動劑或Janus激酶2抑制劑后未能表現出上述改善作用,這證明了α7nAChR具有特異性,它通過JAK/STAT3通路降低肥胖糖尿病小鼠體內炎癥反應,改善機體代謝狀態。
炎癥介質在損傷心肌的愈合過程中發揮重要作用,但過度的炎癥反應可進一步加重缺血和再灌注過程中的心肌損傷。Calvillo等[18]證明迷走神經刺激可以減少缺血再灌注大鼠心肌梗死面積,并可降低梗死區周邊巨噬細胞、中性粒細胞和凋亡細胞數量以及血漿中炎癥因子水平,而煙堿受體阻斷劑可增加大鼠心肌梗死面積。表明煙堿途徑介導的抗炎和抗細胞凋亡作用是迷走神經保護梗死心肌的重要機制,并且這種保護機制與迷走神經降低心率無關。在心肌缺血再灌注損傷中同時存在遠端血管如腸系膜動脈的結構損傷和功能障礙。迷走神經刺激在減輕梗死面積,改善心功能同時可減輕缺血再灌注導致的腸系膜上動脈血管舒縮功能障礙,減輕血管內皮損傷,降低血管壁和血清中TNF-α和IL-1β含量。進一步研究證明迷走神經對腸系膜血管的這種保護作用是通過M3膽堿能受體和α7nAChR實現的。迷走神經興奮激活α7nAChR后增加STAT3磷酸化,同時抑制NF-κB活化從而抑制血管中炎癥[19]。這提示α7nAChR存在于血管壁中,啟示我們進一步研究膽堿能抗炎通路是否可減輕動脈粥樣硬化時血管壁的炎癥反應。
上述研究表明膽堿能抗炎通路可降低高血壓、心肌梗死以及糖尿病等動物模型中存在的炎癥反應。通過增強迷走神經信號傳出或增加α7nAChR在免疫細胞和組織細胞中表達可降低心血管疾病中的炎癥反應。
2.2 交感神經在心血管病中促炎作用目前多數研究認為交感神經亢進可增加心血管疾病中的炎癥反應,Dutta等[20]認為急性心肌梗死時,緊張、疼痛或心衰等因素可激活交感神經系統釋放NE作用于骨髓中β3受體,促使免疫細胞祖細胞轉移至脾臟,增加髓外單核細胞生成,大量單核細胞重新聚集在動脈管壁可增大動脈中斑塊面積,再次加速加重梗死后動脈粥樣硬化進程。自發性高血壓大鼠骨髓中交感神經支配增加與炎性細胞增多有相關性[21]。高血壓前期,血管緊張素II、高鹽等物質作用于中樞自主神經區域,改變中樞神經傳出信號造成交感神經對外周免疫器官如骨髓和脾臟的支配增加而迷走神經支配減弱,交感神經作用于免疫器官中β3和β2受體增加免疫器官中促炎因子和炎性細胞產生,抑制內皮祖細胞外滲。與此同時,骨髓感覺神經再次將炎性信號返回至中樞,如此形成前饋環路,造成永久性迷走神經抗炎能力下降,而交感神經促炎作用增加。炎癥反應增加和內皮損傷修復能力降低最終造成永久性高血壓,出現血管、心臟及腎臟等器官損害[22]。
盡管目前多數研究認為交感神經亢進可增加心血管疾病中炎癥反應,而且β受體阻斷劑的應用可降低炎癥反應[23]。但交感神經在心血管疾病中的有利和不利影響仍是值得研究的問題。Shinohara等[24]發現心衰患者經改善交感神經障礙后可降低機體炎癥反應,而且減低的炎癥與改善的心臟交感神經功能明顯相關。這反映了交感神經對炎癥的雙向調節作用,因此我們推測過度抑制交感神經或交感神經損毀并不一定有利于減輕心血管疾病中炎癥反應,而恢復正常的交感神經支配可能更有利于減輕炎癥反應。
3 調節自主神經是心血管疾病抗炎治療的新領域
目前認為阿司匹林、血管緊張素II受體拮抗劑和他汀類等藥物可減輕心血管病中的低度炎癥反應。相比而言,調節自主神經是有別于上述藥物抗炎的新途徑。由膽堿能抗炎通路的生理及解剖基礎推測可從以下3條途徑對其調節:(1)增加中樞迷走神經信號傳出,如使用毒蕈堿受體激動劑或乙酰膽堿酯酶抑制劑[25];(2)體內安裝迷走神經刺激裝置增加迷走神經傳出信號;(3)使用外周α7nAChR激動劑。對于交感神經可通過激活細胞表面β2受體來抑制炎癥反應。
研究證明應用中樞毒蕈堿受體激動劑卡巴膽堿或使用乙酰膽堿酯酶抑制劑加蘭他敏可增加中樞迷走神經信號傳出,提高外周迷走神經活性[26-27]。但藥物激活中樞膽堿能系統后在體內作用廣泛而選擇性差,尤其能對心率或血壓產生抑制作用,這在極大程度限制其臨床應用。除此之外,Giuliani等[28]報道應用黑皮質素激活中樞黑皮質素受體MC3和MC4也可激活膽堿能抗炎通路,減輕心肌缺血損傷,降低機體炎癥反應,這值得進一步研究。
動物實驗證明迷走神經刺激具有抗炎、抗心律失常、抗心肌纖維化、逆轉心室重構等作用,因而引起心血管醫生的廣泛關注。但是其在臨床應用中的研究結果仍存在分歧,一項多中心臨床研究表明慢性迷走神經刺激可改善患者的左室功能和生活質量[29]。相反,最近NECTAR-HF研究顯示迷走神經刺激不能改善患者心室重構和心功能,而僅能改善患者生活質量[30]。這可能與刺激方法、強度和研究對象等有關。研究認為刺激頸部迷走神經激活膽堿能抗炎通路所需電壓不足以引起心臟迷走神經興奮,因而不會造成血流動力學改變[31],但迷走神經刺激可引起咳嗽、發聲障礙和刺激相關性疼痛等副作用,而且不恰當地植入技術和刺激強度等可造成術后肺水腫以及呼吸系統和循環系統不穩定,這些問題限制了其在臨床中的推廣。
隨著α7nAChR研究的深入,發現心肌細胞、血管內皮細胞和血管平滑肌細胞均可表達α7nAChR。盡管動物實驗證明煙堿可激活α7nAChR,但因其較大的毒副作用而不適用于臨床。因此尋找低毒且特異性的α7nAChR受體激動劑對于降低心血管疾病中炎癥反應具有較大應用價值。
對于交感神經,體外研究證明β2受體激動劑可降低炎性細胞活性,減少炎癥因子產生,但臨床應用中β2受體激動劑并未表現出抗炎作用,因此交感神經抗炎途徑還需更深入研究[32]。
綜上,膽堿能抗炎通路可抑制機體炎癥反應,而交感神經系統同時具有促炎和抗炎作用。激活膽堿能抗炎通路,恢復正常的交感神經支配可降低心血管疾病中機體炎癥反應,為心血管疾病中抗炎治療開辟新領域。盡管如此,尋找理想的實施方法還需進行更深入具體的研究。
[1]Tracey KJ.The inflammatory reflex[J].Nature,2002,420(6917):853-859.
[2]Tracey KJ.Reflex control of immunity[J].Nat Rev Immunol,2009,9(6):418-428.
[3]Huston JM,Ochani M,Rosas-Ballina M,et al.Splenectomy inactivates the cholinergic antiinflammatory pathway during lethal endotoxemia and polymicrobial sepsis[J].J Exp Med,2006,203(7):1623-1628.
[4]Berthoud HR,Powley TL.Characterization of vagal innervation to the rat celiac,suprarenal and mesenteric ganglia[J].J Auton Nerv Syst,1993,42(2):153-169.
[5]Rosas-Ballina M,Ochani M,Parrish WR,et al.Splenic nerve is required for cholinergic antiinflammatory pathway control of TNF in endotoxemia[J].Proc Natl Acad Sci U S A,2008,105(31):11008-11013.
[6]Kees MG,Pongratz G,Kees F,et al.Via beta-adrenoceptors,stimulation of extrasplenic sympathetic nerve fibers inhibits lipopolysaccharide-induced TNF secretion in perfused rat spleen[J].J Neuroimmunol,2003,145(1-2):77-85.
[7]Vida G,Pe~na G,Kanashiro A,et al.β2-Adrenoreceptors of regulatory lymphocytes are essential for vagal neuromodulation of the innate immune system[J].FASEB J,2011,25(12):4476-4485.
[8]Andersson U,Tracey KJ.Neural reflexes in inflammation and immunity[J].J Exp Med,2012,209(6):1057-1068.
[9]Swirski FK,Nahrendorf M,Etzrodt M,et al.Identification of splenic reservoir monocytes and their deployment to inflammatory sites[J].Science,2009,325(5940):612-616.
[10]Nahrendorf M,Swirski FK,Aikawa E,et al.The healing myocardium sequentially mobilizes two monocyte subsets with divergent and complementary functions[J].J Exp Med,2007,204(12):3037-3047.
[11]Elenkov IJ,Wilder RL,Chrousos GP,et al.The sympathetic nerve——an integrative interface between two supersystems:the brain and the immune system[J].Pharmacol Rev,2000,52(4):595-638.
[12]Bai A,Lu N,Guo Y,et al.Modulation of inflammatory response via α2-adrenoceptor blockade in acute murine colitis[J].Clin Exp Immunol,2009,156(2):353-362.
[13]Martinolle JP,More J,Dubech N,et al.Inverse regulation of alpha-and beta-adrenoceptors during trinitrobenzenesulfonic acid(TNB)-induced inflammation in guinea-pig small intestine[J].Life Sci,1993,52(18):1499-1508.
[14]Pongratz G,Straub RH.Role of peripheral nerve fibres in acute and chronic inflammation in arthritis[J].Nat Rev Rheumatol,2013,9(2):117-126.
[15]Chandrasekharan B,Nezami BG,Srinivasan S.Emerging neuropeptide targets in inflammation:NPY and VIP[J].Am J Physiol Gastrointest Liver Physiol,2013,304(11): G949-G957.
[16]Li DJ,Evans RG,Yang ZW,et al.Dysfunction of the cholinergicanti-inflammatorypathwaymediatesorgan damage in hypertension[J].Hypertension,2011,57 (2):298-307.
[17]Marrero MB,Lucas R,Salet C,et al.An α7 nicotinic acetylcholine receptor-selective agonist reduces weight gain and metabolic changes in a mouse model of diabetes[J].J Pharmacol Exp Ther,2010,332(1):173-180.
[18]Calvillo L,Vanoli E,Andreoli E,et al.Vagal stimulation,through its nicotinic action,limits infarct size and the inflammatory response to myocardial ischemia andreperfusion[J].J Cardiovasc Pharmacol,2011,58(5): 500-507.
[19]Zhao M,He X,Bi XY,et al.Vagal stimulation triggers peripheral vascular protection through the cholinergic antiinflammatory pathway in a rat model of myocardial ischemia/reperfusion[J].Basic Res Cardiol,2013,108(3): 345.
[20]Dutta P,Courties G,Wei Y,et al.Myocardial infarction acceleratesatherosclerosis[J].Nature,2012,487 (7407):325-329.
[21]Zubcevic J,Jun JY,Kim S,et al.Altered inflammatory response is associated with an impaired autonomic input to the bone marrow in the spontaneously hypertensive rat[J].Hypertension,2014,63(3):542-550.
[22]Santisteban MM,Zubcevic J,Baekey DM,et al.Dysfunctional brain-bone marrow communication:a paradigm shift in the pathophysiology of hypertension[J].Curr Hypertens Rep,2013,15(4):377-389.
[23]Serg M,Kampus P,Kals J,et al.Nebivolol and metoprolol:long-term effects on inflammation and oxidative stress in essential hypertension[J].Scand J Clin Lab Invest,2012,72(5):427-432.
[24]Shinohara T,Takahashi N,Saito S,et al.Effect of cardiac resynchronization therapy on cardiac sympathetic nervous dysfunction and serum C-reactive protein level[J].Pacing Clin Electrophysiol,2011,34(10):1225-1230.
[25]Ji H,Rabbi MF,Labis B,et al.Central cholinergic acti
vation of a vagus nerve-to-spleen circuit alleviates experimental colitis[J].Mucosal Immunol,2014,7(2):335-347.
[26]Zhou G,Hu S,Lv Y,et al.Carbachol alleviates rat cytokine release and organ dysfunction induced by lipopolysaccharide[J].J Trauma,2011,71(1):157-162.
[27]Pavlov VA,Parrish WR,Rosas-Ballina M,et al.Brain acetylcholinesterase activity controls systemic cytokine levels through the cholinergic anti-inflammatory pathway[J].Brain Behav Immun,2009,23(1):41-45.
[28]Giuliani D,Ottani A,Altavilla D,et al.Melanocortins and the cholinergic anti-inflammatory pathway[J].Adv Exp Med Biol,2010,681:71-87.
[29]De Ferrari GM,Crijns HJ,Borggrefe M,et al.Chronic vagus nerve stimulation:a new and promising therapeutic approach for chronic heart failure[J].Eur Heart J,2011,32(7):847-855.
[30]Zannad F,De Ferrari GM,Tuinenburg AE,et al.Chronic vagal stimulation for the treatment of low ejection fraction heart failure:results of the neural cardiac therapy for heart failure(NECTAR-HF)randomized controlled trial[J].Eur Heart J,2014,pii:ehu345
[31]Johnston GR,Webster NR.Cytokines and the immunomodulatory function of the vagus nerve[J].Br J Anaesth,2009,102(4):453-462.
[32]Theron AJ,Steel HC,Tintinger GR,et al.Can the antiinflammatory activities of β2-agonists be harnessed in the clinical setting?[J].Drug Des Devel Ther,2013,7: 1387-1398.
Regulating autonomic nerve system:a new field of anti-inflammatory therapy for cardiovascular diseases
MA Du-fang1,JIANG Ping1,YANG Jin-long2,LI Xiao2
(1Shandong University of Traditional Chinese Medicine,Jinan 250355,China;2Affiliated Hospital of Shandong University of Traditional Chinese Medicine,Jinan 250011,China.E-mail:lixiao617@163.com)
The role of chronic inflammation and autonomic neuropathy in the crucial underlying process contributing to the initiation and the progression of various cardiovascular diseases is well established.It is well known that the immune system is innervated by the autonomic nervous system,and the inflammatory reaction and immune reaction are regulated by the autonomic nerve system.Vagus nerve depresses inflammatory reaction via cholinergic anti-inflammatory pathway(CAP),while sympathetic nervous system has bidirectional regulation of pro-inflammation and anti-inflammation,which are affected by several factors such as the concentration of neurotransmitters or types of receptors.In this paper,we reviewed different effects of CAP and sympathetic nervous system on cardiovascular inflammatory reaction.Activation of CAP and regaining normal sympathetic function will improve the chronic inflammation in the process of cardiovascular diseases.Low-toxic and selective α7nAchR agonist is expected to be applied in cardiovascular diseases to alleviate chronic inflammation.
Autonomic nervous system;Cholinergic anti-inflammatory pathway;Sympathetic nervous system; Vagus nerve;Cardiovascular diseases;Inflammation
R363
A
10.3969/j.issn.1000-4718.2015.02.033
1000-4718(2015)02-374-06
2014-09-23
2014-10-23
國家自然科學基金項目資助(No.81072962)
△通訊作者Tel:0531-68616064;E-mail:lixiao617@163.com

