不同產地芡實藥材水溶性蛋白質的含量分析Δ
陳蓉,陳偉,吳啟南(1.蘇州市食品藥品檢驗所,江蘇 蘇州 15104;.蘇州市中醫醫院,江蘇 蘇州 15009;3.南京中醫藥大學藥學院,南京 10046)
芡實為睡蓮科植物芡Euryale ferox Salisb的干燥成熟種仁[1]。營養成分以淀粉為主,另富含蛋白質、氨基酸、多糖等。芡實中總氨基酸平均值為103.33mg/g,游離氨基酸為0.98mg/g,人體必需氨基酸種類齊全,且比例均衡,接近世界衛生組織/聯合國糧農組織(WHO/FAO)標準模式[2]。芡實蛋白富含多種必需氨基酸,是一種結構比較平衡的優質膳食蛋白[3]。芡實水溶性部位能通過上調細胞因子信號傳導抑制蛋白-3(SOCS-3)、下調葡萄糖轉運蛋白1(GLUT1)及轉化生長因子-β1(TGF-β1)在腎組織的表達水平來延緩糖尿病腎病的進展[4-5]。水溶性蛋白質是芡實蛋白質中可以溶解于水的部分,可以被人體直接吸收利用。蛋白質含量測定最常見的方法包括凱氏法、福林酚法和考馬斯亮藍法等。本試驗采用考馬斯亮藍法測定不同產地芡實水溶性蛋白質含量,并進行聚類分析,現報道如下。
1 材料
1.1 儀器
BT 125D型十萬分之一電子分析天平(北京賽多利斯儀器系統有限公司);UV2000紫外可見分光光度計(北京萊伯泰科儀器股份有限公司);PE Lambda 35型紫外分光光度計(美國PerkinElmer公司);WH-1型微型漩渦混合儀(上海滬西分析儀器廠有限公司);FSH-2A型可調高速勻漿機(金壇市金南儀器廠);Universal-32R型高速冷凍離心機(德國Hettich公司)。
1.2 試劑
牛血清白蛋白(上海惠興生化試劑有限公司,批號:2012062525);考馬斯亮藍G-250(國藥集團化學試劑有限公司,批號:20120817);磷酸為優級純,95%乙醇為分析純,試驗用水均為雙重蒸餾水。
1.3 藥材
芡實樣品來源于全國14個產地,經南京中醫藥大學藥學院吳啟南教授鑒定為睡蓮科植物芡E.ferox Salisb的干燥成熟種仁。芡實樣品來源詳見表1。

表1 芡實樣品來源Tab 1 Sources of E.ferox
1.4 數據處理
利用Excel、ORIGIN 7.5和SPSS 18.0軟件對15個產地的芡實藥材水溶性蛋白質含量進行數據處理、分析。
2 方法與結果
2.1 考馬斯亮藍G-250顯色劑的配制[6]
精密稱取100mg考馬斯亮藍G-250,溶于50ml 95%乙醇,再加入100ml 85%磷酸,用雙重蒸餾水稀釋至1000ml。此溶液可在常溫下放置1個月。
2.2 對照品溶液的配制
精密稱取牛血清白蛋白50.10mg,加雙重蒸餾水溶解并定容至10ml量瓶中;再精密吸取1ml至10ml量瓶中,加雙重蒸餾水定容,配成濃度為0.5010mg/ml的對照品溶液。
2.3 供試品溶液的制備
稱取干燥的芡實藥材樣品1 g,加3ml雙重蒸餾水研磨成勻漿,于4℃條件下,浸泡48 h[7],又在4℃條件下,以半徑為3 cm、11000 r/min離心18min,上清液為蛋白質粗提液,即得。
2.4 吸收波長的確定
精密量取“2.2”項下對照品溶液0.3ml和“2.3”項下供試品溶液0.8ml,分別置具塞試管中,用去離子水補充至1ml。各試管中分別加入“2.1”項下考馬斯亮藍G-250顯色劑5.0ml,立即在漩渦混合器上混合,以相應的試劑為空白,于400~900nm處掃描,確定測定波長為595nm。全波長掃描圖詳見圖1。
2.5 標準曲線的制備

圖1 蛋白質全波長掃描圖Fig 1 Full wavelength scan map of proteins
精密吸取牛血清白蛋白對照品溶液(質量濃度為0.5010mg/ml)0.00、0.01、0.05、0.10、0.15、0.20、0.25、0.30ml,用去離子水補充至1ml。分別加入“2.1”項下考馬斯亮藍G-250顯色劑5.0ml,立即在漩渦混合器上混合;靜置5min后,用分光光度計測定各溶液在595nm處的吸光度值。以牛血清白蛋白質量濃度(x,mg/ml)為橫坐標、吸光度值(y)為縱坐標進行線性回歸,得回歸方程為y=4.0184x-0.0098(r=0.9992)。結果,牛血清白蛋白質量濃度在0.00501~0.1503mg/ml范圍內與其吸光度值呈良好的線性關系。
2.6 方法學考察
2.6.1 精密度試驗 精密吸取牛血清白蛋白對照品溶液(質量濃度為 0.5010mg/ml)0.20ml,用去離子水補充至 1ml,按“2.5”項下方法操作,重復6次,分別測定吸光度值。結果,RSD為0.19%,表明儀器精密度良好。
2.6.2 穩定性試驗 精密稱取芡實樣品(S9)1 g,按“2.3”項下方法制備供試品溶液及再按“2.5”項下操作,分別在配制0、5、10、15、20、25、30、35、40、50、60min測定吸光度值。結果,RSD為1.08%,表明供試品溶液在60min內穩定性良好。
2.6.3 重復性試驗 精密稱取芡實樣品(S9)6份,各1 g,按“2.3”項下方法制備供試品溶液,再按“2.5”項下操作分別測定吸光度值。結果,平均含量為0.4732mg/g,RSD為2.04%,表明本方法重復性良好。
2.6.4 加樣回收率試驗 精密稱取芡實樣品(S9)6份,各0.5 g,分別加入質量濃度為0.5010mg/ml的牛血清白蛋白對照品溶液0.5ml,即含對照品0.2505mg,分別按“2.3”和“2.5”項下方法操作,測定吸光度值,并計算加樣回收率,結果詳見表2。

表2 加樣回收率試驗結果(n=6)Tab 2 Average recovery test of sample(n=6)
2.7 含量測定
準確稱取樣品(S1~S15)各1 g,按“2.3”項下操作制備供試品溶液,精密吸取各芡實供試品溶液(S1~S15)0.8ml,0號加蒸餾水1ml作為空白對照,分別加入考馬斯亮藍G-250顯色劑5.0ml,在旋渦混合器上充分混合,在分光光度計上測定各樣品在595nm處的吸光度值,平行測定3次。根據測出的吸光度值,計算樣品中的蛋白質含量,結果詳見表3。
由表3可知,各產地芡實水溶性蛋白質含量差異較大,平均值為0.4577mg/g。其中,S10江蘇蘇州的水溶性蛋白質含量最高,S15的含量最低。與筆者前期研究的芡實中氨基酸含量[2]相比,芡實中水溶性蛋白質含量很低,僅為萬分之幾,與游離氨基酸含量接近,而總氨基酸則達到了百分之十左右。其原因可能是總氨基酸來源于全部酸水解的蛋白質和肽類化合物,而本試驗考慮到蛋白質受熱變性,采用冰浴研磨,提取的基本為活性蛋白質,處理方法較為簡便,且保證了提取物的準確性。
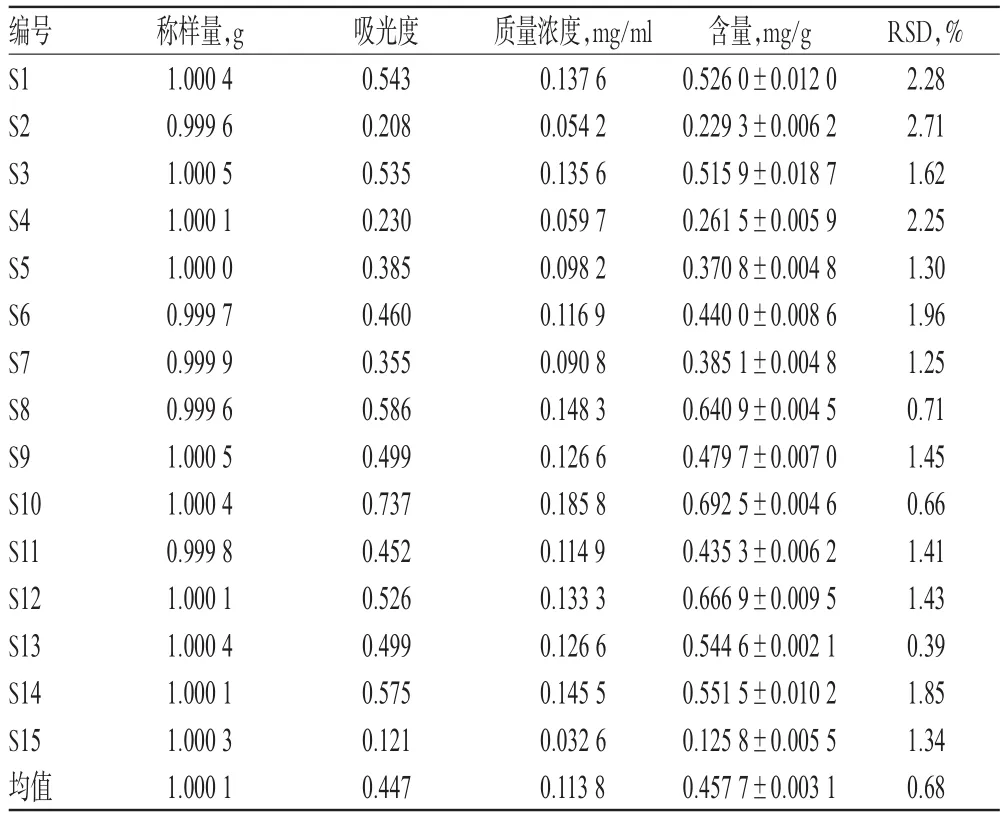
表3 芡實水溶性蛋白質含量測定結果Tab 3 Results of content determination of water-soluble proteins in E.ferox
2.8 不同產地芡實水溶性蛋白質聚類分析
運用SPSS 18.0軟件中的hierarchical cluster analysis對15個產地的芡實樣品進行系統聚類,方法為組間平均,公式為平方歐式距離,得到不同樣品的聚類分析圖。15個產地芡實被聚為6類,詳見圖2。
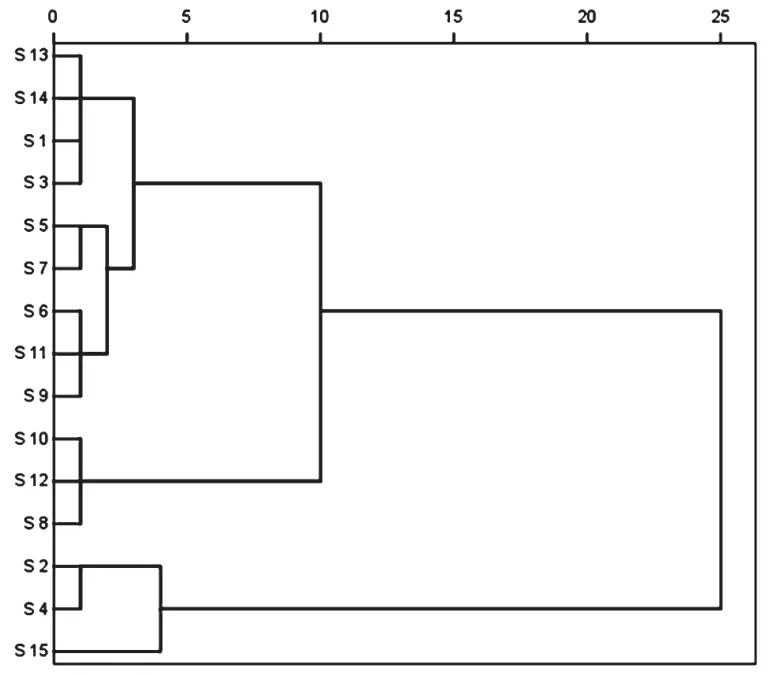
圖2 不同產地芡實水溶性蛋白質聚類結果Fig 2 Clustering results of water-soluble protein in E.ferox
第Ⅰ類包括3個產地(S8、S10、S12),分別為湖南益陽、江蘇蘇州、江蘇金湖,這一類產地水溶性蛋白質含量最高,均超過0.6mg/g,其中江蘇蘇州的含量最高,達到0.6966mg/g。第Ⅱ類包括4個產地(S1、S3、S13、S14),分別為四川成都、安徽蕪湖、江蘇建湖、江蘇浦口,這一類產地水溶性蛋白質含量次之,均超過0.5mg/g,其中江蘇浦口的含量最高,達到0.5457mg/g。第Ⅲ類包括3個產地(S6、S9、S11),分別為福建莆田、廣東肇慶、江蘇寶應,這一類產地水溶性蛋白質含量位列第3位,均超過0.4mg/g,其中廣東肇慶的含量最高,達到0.4746mg/g。第Ⅳ類包括2個產地(S5、S7),分別為江西武穴、四川中江,這一類產地水溶性蛋白質含量位列第4位,均超過0.3mg/g,其中四川中江的含量最高,達到0.3891mg/g。第Ⅴ類包括2個產地(S2、S4),分別為山東菏澤、河北安國,這一類產地水溶性蛋白質含量位列第5位,均超過0.2mg/g,其中河北安國的含量最高,達到0.2557mg/g。第Ⅵ類包括1個產地(S15),為對照藥材,其水溶性蛋白質含量最低,僅為0.1220mg/g。可能與其存放時間太久導致水溶性蛋白質減少有關。
綜上所述,聚類分析結果可以認為芡實水溶性蛋白質含量有明顯的產地差異,基本以長江流域的芡實水溶性蛋白質含量較高,南方芡實次之,而北方芡實的水溶性蛋白質含量最少,可能與氣候、水環境以及種質差異有關。故產地從一定程度上可以解釋芡實水溶性蛋白質的變異,同時結合氨基酸分析評價[2],來判斷其營養價值的高低。
3 討論
本研究結果顯示,各產地芡實水溶性蛋白質含量均較低,平均值為0.4577mg/g。蛋白質在0.00501~0.1503mg/ml范圍內與吸光度值呈良好的線性關系,復合物形成后的60min內測定穩定性較好。聚類分析結果顯示,芡實水溶性蛋白質含量有明顯的產地差異,長江流域含量較高,南方芡實次之,而北方芡實的水溶性蛋白質含量最少。
考馬斯亮藍法是Bradford于1976年建立起來的測定蛋白質含量的方法,蛋白質在0~0.1mg/ml范圍內與吸光度值呈良好的線性關系,最低檢出限為1μg,且不受酚類、游離氨基酸和小分子的影響。考馬斯亮藍G-250是一種蛋白質染料,在游離狀態下呈紅色,最大吸收峰在465nm,在酸性溶液中它與蛋白質通過范德瓦爾引力結合形成考馬斯亮藍G-250-蛋白質復合物時,其最大吸收峰改變為595nm。染料與蛋白質結合迅速,大約為2min,結合物的顏色在1 h內穩定。
樣品處理方面可以考慮用PBS、HCl-NaCl緩沖液、Tris-HCl緩沖液等代替水提取蛋白質,減少pH等環境干擾。雖然考馬斯亮藍法有不少優點,但由于受到影響的因素較多,優化出一套較好的試驗條件并不容易。da Silva MA等[8]對此法的機制進行了深入的研究,認為pH、時間、溫度是本方法的重要變量。考馬斯亮藍G-250的溶解性與溫度有一定的關系。但由于溫度的影響具體操作有困難,本試驗未對溫度進行研究,確定了常用的低溫4℃。在對植物組織粗提液進行可溶性蛋白質含量測定時,取樣量應控制在一個適當的范圍內,盡可能取樣少些,以減少粗提液對測定結果可能帶來的影響。
國內外對蛋白質的分離提取已有多年的研究歷史,尤其對大豆蛋白[9]、肉類蛋白[10]等都有深入的研究。而對于芡實,除了在保鮮儲藏、淀粉特性[11]、多糖特性[12]、中藥指紋圖譜[13]等方面有相關論文發表外,對芡實蛋白質的研究,如酸性、水溶性、鹽溶性蛋白含量等方面報道均較少。水溶性植物功能蛋白是一類具有高水溶性、高蛋白質含量、高熱穩定性,以及強乳化能力(“三高一強”)的功能蛋白。芡實藥材水溶性蛋白質的研究可為藥食兩用植物的資源綜合利用提供新的方向。
[1]國家藥典委員會.中華人民共和國藥典:一部[S].2010年版.北京:中國醫藥科技出版社,2010:151.
[2]陳蓉,吳啟南,沈蓓.不同產地芡實氨基酸組成分析與營養價值評價[J].食品科學,2011,32(15):239.
[3]譚五豐,杜冰,謝藍華,等.響應面法優化酶法提取芡實蛋白工藝[J].農業工程,2014,4(4):82.
[4]韓利梅.芡實對糖尿病腎病大鼠腎組織SOCS-3、IGF-1表達的影響[D].太原:山西醫科大學,2014.
[5]董文華.芡實對糖尿病腎病大鼠腎組織GLUT1及TGF-β1表達的影響[D].太原:山西醫科大學,2014.
[6]王麗娟,劉訓紅,丁玉華,等.麋角超細粉體表征及其水溶性蛋白質溶出度研究[J].南京中醫藥大學學報,2010,26(2):132.
[7]曲春香,沈頌東,王雪峰,等.用考馬斯亮藍測定植物粗提液中可溶性蛋白質含量方法的研究[J].蘇州大學學報:自然科學版,2006,22(2):82.
[8]da Silva MA,Arruda MA.Mechanization of the Bradford reaction for the spectrophotometric determination of total proteins[J].Anal Biochem,2006,351(1):155.
[9]趙宇明,姜俊,張建寧,等.光度法快速測定大豆水溶性蛋白質的研究[J].大豆科學,2010,29(1):124.
[10]邱葵,司天潤.用考馬斯亮藍測定動物藥材中可溶性蛋白質含量方法初探[J].中國中醫藥信息雜志,2007,14(4):49.
[11]張汆,侯長平,孫艷輝,等.芡實淀粉糊黏度特性研究[J].中國糧油學報,2010,25(4):20.
[12]陳蓉,薛滿,陳偉,等.芡實多糖理化性質及抗氧化活性研究[J].中國藥學:英文版,2014,23(8):578.
[13]陳蓉,陳廣云,沈蓓,等.基于共有峰率和變異峰率雙指標序列分析法的芡實紅外指紋圖譜研究[J].中國藥房,2012,23(23):2141.

