耐多藥結核病患者治療2個月末痰培養情況及影響因素分析
周揚 許衛國 丁曉艷 竺麗梅 虞浩 陳誠 邵燕 陸偉
?
·論著·
耐多藥結核病患者治療2個月末痰培養情況及影響因素分析
周揚 許衛國 丁曉艷 竺麗梅 虞浩 陳誠 邵燕 陸偉
目的 了解MDR-TB患者痰菌轉陰情況,評價影響痰菌轉陰的相關因素。方法 在徐州市、南通市和鎮江市,對痰涂片陽性的肺結核患者的痰液進行培養及結核分枝桿菌菌種鑒定,培養陽性的結核分枝桿菌采用比例法藥敏試驗判斷患者是否耐藥。2009年1月1日至2012年6月30日納入治療的MDR-TB患者,采用標準化療方案或個體化化療方案進行治療,治療期間隨訪監測并實施DOTS 管理。對痰菌檢查結果、治療轉歸、痰菌轉陰影響因素進行分析。完成全療程的376例MDR-TB患者中男278例,女98例,平均年齡(49.33±15.36)歲。使用SPSS 13.0軟件進行單因素χ2檢驗和多因素logistic回歸分析。P<0.05為差異有統計學意義。 結果 治療2、4、6個月末時,痰培養陰性率分別為58.78%(221/376)、61.97%(233/376)和61.17%(230/376),差異無統計學意義(χ2=0.807,P>0.05)。在治療2、4、6個月末時,痰培養陰性患者的治療成功率分別為69.68%(154/221)、71.24%(166/233)和73.48%(169/230),高于培養陽性或未檢查的患者(χ2=60.804、82.619、101.047,P值均<0.01)。治療第2個月末痰培養陽性患者的治療成功率(31.33%,26/83)也高于治療第6個月痰培養陽性患者的治療成功率(16.36%,9/55)(χ2=3.912,P<0.05)。多因素logistic回歸分析顯示,既往抗結核治療史(P<0.01,OR=0.205;95%CI:0.070~0.598)、是否對二線藥耐藥(P<0.05,OR=2.609;95%CI:1.097~6.206)、是否對Km耐藥(P<0.05,OR=10.008;95%CI:1.101~90.974)等因素與MDR-TB患者治療2個月末痰培養轉陰呈負相關。結論 約60%的MDR-TB患者可以在治療2個月末時痰培養轉陰,既往抗結核治療史、是否對二線藥耐藥、是否對Km耐藥等因素與MDR-TB患者治療2個月末痰培養轉陰有關。
結核,肺/藥物療法; 抗藥性,多種,細菌; 治療結果; 回顧性研究
我國是世界上22個結核病高負擔國家之一,2007年全國結核病耐藥性基線調查報告顯示,我國肺結核的耐多藥率為8.3%,由于人口基數大,我國的耐多藥結核病(MDR-TB,同時耐異煙肼和利福平2種抗結核藥物的結核分枝桿菌引起的結核病)患者數占到了全球的1/4~1/3,達到12萬例[1],居全球第2位,僅次于印度,被WHO列為需“特別引起警示的國家和地區”[2]。MDR-TB患者的治療療程長、費用高、治療效果差,給結核病的防治工作帶來了嚴峻挑戰。痰菌轉陰被認為是失去傳染性的一個可靠指標[3],通常也是判斷治療效果的重要指標。為了解MDR-TB患者痰菌轉陰情況,評價影響痰菌轉陰的相關因素,本研究對MDR-TB患者的治療情況進行回顧性隊列分析。
對象和方法
一、研究對象
研究現場為徐州市、南通市和鎮江市,3個地區較早在江蘇省開展MDR-TB的治療和管理工作,分別處于江蘇省的北部、中部和南部,分析3個地區的MDR-TB患者治療2個月末痰菌轉陰情況,對反映江蘇省MDR-TB控制工作具有一定的參考意義。2009年1月1日至2012年6月30日,對痰涂片陽性的肺結核患者的痰標本進行培養及結核分枝桿菌菌種鑒定,培養陽性的結核分枝桿菌菌株采用比例法藥敏試驗判斷患者耐藥情況。376例MDR-TB患者納入治療并完成療程,其中男278例,女98例,年齡14.20~87.82歲,平均年齡(49.33±15.36)歲。
二、研究方法
確診患者簽署知情同意書,采用標準化治療方案[2][6/12 Z Km(Am,Cm) Lfx(Mfx) Cs(PAS,E) Pto/18Z Lfx(Mfx) Cs(PAS,E) Pto],或調整后的個體化方案(在標準化治療方案的基礎上,根據藥敏試驗結果、既往抗結核治療史、藥物使用后不良反應發生情況等進行調整)進行治療。全療程24~30個月,分為強化期和鞏固期,強化期至少6個月,使用藥物:乙胺丁醇(E,1200 mg/d,口服,1次/d)、吡嗪酰胺(Z,1750 mg/d,口服,3次/d)、卡那霉素(Km,1000 mg/d,肌內注射,1次/d)、卷曲霉素(Cm,1000 mg/d,肌內注射,1次/d)、左氧氟沙星(Lfx,750 mg/d,口服,1次/d)、丙硫異煙胺(Pto,750 mg/d,口服,3次/d)、對氨基水楊酸(PAS,8 g/d,口服,1次/d)、莫西沙星(Mfx,400 mg/d,口服,1次/d)、環絲氨酸(Cs,750 mg/d,口服,1次/d)。劑量為51~75 kg患者的標準劑量,服用劑量會根據患者體質量進行調整。采取住院和門診相結合的治療方式,推薦先住院治療,住院時間一般為2個月,可根據病情進行適當調整。本研究中有91.76%(345/376)的患者接受了4~8周的住院治療,其中74.78%(258/345)的患者住院時間小于2個月。治療過程中,前6個月每月1次,后18個月每2個月1次,對患者進行痰培養、肝功能、血尿常規、胸片等項目檢查,治療全程實施DOTS管理。
人口學數據,包括性別、年齡、居住地等,臨床數據,包括登記分類、細菌學結果、藥敏結果、既往結核病治療史、治療轉歸等,均由中國疾病預防控制中心《結核病管理信息系統》獲得。治療和管理單位每個月報送患者治療、管理情況,每個季度對登記資料進行現場審核。
三、相關定義
(一)患者治療轉歸
以實驗室痰涂片和結核分枝桿菌培養檢查作為MDR-TB患者治療轉歸判定的主要手段。
1.治愈:患者完成療程,在療程的后12個月,至少最后5次痰結核分枝桿菌培養(每次間隔至少30 d)連續陰性者;或者出現1次痰結核分枝桿菌培養陽性,其后痰結核分枝桿菌培養(其間隔至少30 d)最少連續3次陰性,且不伴有臨床癥狀加重。
2.完成治療:患者完成了療程,但缺乏細菌學檢查結果,不符合治愈的標準。
3.死亡:在治療過程中患者由于各種原因導致的死亡。
4.失敗:在療程的后12個月,最后5次痰培養中有2次或2次以上陽性;或最后的3次培養中有任何1次是陽性即為失敗(包括治療后臨床及影像學表現判斷為療效不佳,或因為不良反應而臨床決定提前中止治療)。
5.丟失:患者未經醫生允許治療中斷連續2個月或以上。
6.其他:上述5類(治愈、完成治療、死亡、失敗、丟失)之外患者的轉歸,包括遷出等。
(二)治療成功率
一定期間內治愈或完成治療的MDR-TB患者數占納入治療的MDR-TB患者總數的百分率。
四、統計學分析
通過Excel表建立數據庫,分類變量用“率”描述,使用SPSS 13.0軟件進行單因素χ2檢驗和多因素logistic回歸分析。多因素logistic回歸模型擬和治療2個月末痰培養是否轉陰與可能的影響因素之間的數量關系,采用逐步法選擇有統計學意義的影響因素并評價其效果,變量保留和剔除的標準分別是α=0.05和α=0.1。以P<0.05為差異有統計學意義。
結 果
一、治療前藥敏試驗檢查結果情況
研究期間共有376例MDR-TB患者納入治療并完成療程,其中82例耐HR;116例耐3種藥(24例耐HRE,89例耐HRS,3例耐HR+Ofx);151耐4種藥(139例耐HRES,5例耐HRE+Ofx,2例HRS+Ofx,4例HRS+Km,1例耐HR+Ofx+Km);17例耐5種藥(15例耐HRES+Ofx,1例耐HRE+Ofx+Km,1例耐HRS+Ofx+Km);10例耐6種藥(HRES+Ofx+Km)。
二、不同治療月份痰菌陰性與治療轉歸的關系
在治療2、4、6個月末時,痰培養陰性率分別為58.78%(221/376)、61.97%(233/376)和61.17%(230/376),但差異無統計學意義(χ2=0.807,P>0.05)。治療2、4、6個月末時,痰培養陰性的患者,最終的治療成功率均遠高于培養陽性或未檢查的患者(χ2=60.804、82.619、101.047,P值均<0.01)。治療2個月末痰培養陽性患者的治療成功率也高于第6個月痰培養陽性患者的治療成功率(χ2=3.912,P<0.05),見表1。患者在24個月療程結束時,最終的治療成功率為52.93%(199/376)。
三、治療2個月末痰培養轉陰單因素分析
治療2個月末,痰培養陰性患者的治療成功率與4個月末、6個月末相近。因此,可以將2個月末痰菌轉陰情況作為判斷治療結果的一個敏感指標。單因素分析顯示籍貫、既往抗結核治療史、登記分類、治療前耐藥情況、是否對二線藥物耐藥、是否對Ofx耐藥、是否對Km耐藥、是否對Sm耐藥與MDR-TB患者治療2個月末痰培養轉陰有關(表2)。
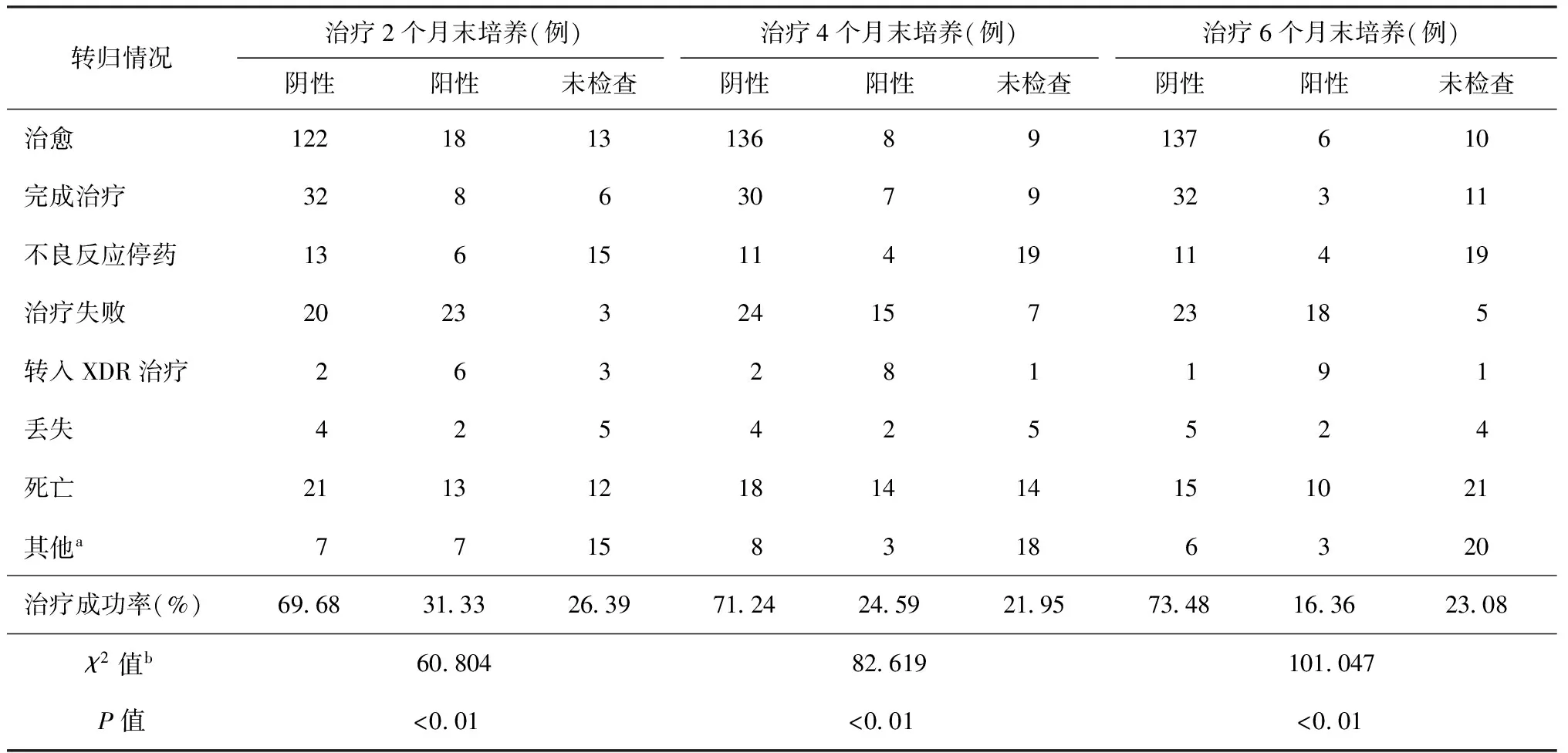
表1 不同治療轉歸在376例MDR-TB患者治療后不同時間痰培養的結果比較
注a:“其他”為轉出患者,治療結果未能獲得。b:χ2值、P值分別是治療第2、4、6個月末時,痰培養陰性、陽性和未檢查患者治療成功率間的比較所得,結果顯示治療2、4、6個月末時,痰培養陰性患者療程結束時的治療成功率均遠高于培養陽性或未檢查的患者
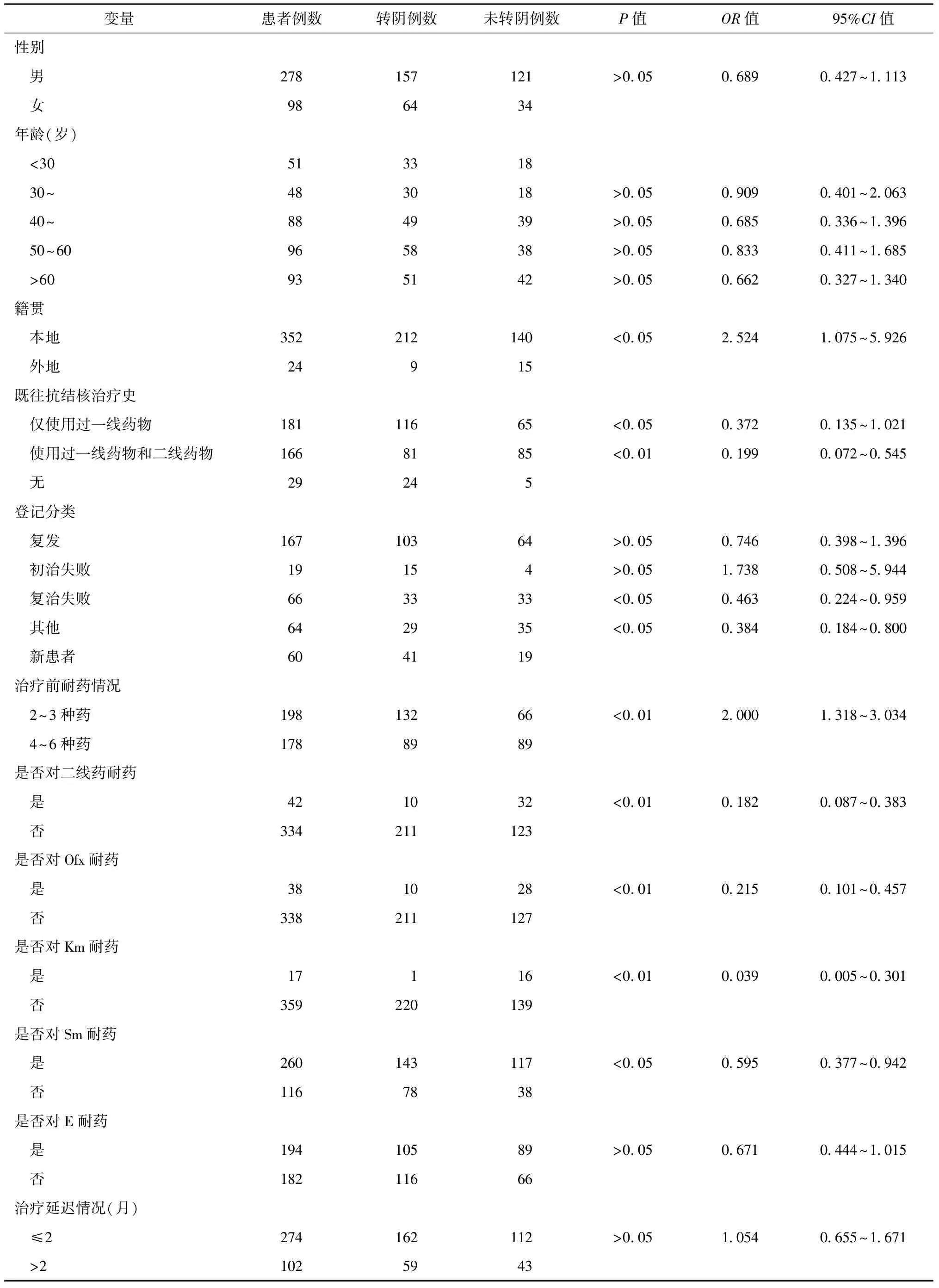
表2 不同變量在376例MDR-TB患者治療2個月末痰培養情況的單因素分析結果
注 其他:新患者、復發、初治失敗、復治失敗之外的患者
四、治療2個月末痰培養轉陰多因素分析
以治療2個月末痰培養陰性為因變量,以表3中的12個變量為協變量,進行logistic多因素回歸分析,各變量的賦值見表3。分析結果顯示既往抗結核治療史、是否對二線藥物耐藥、是否對Km耐藥等因素與MDR-TB患者治療2個月末痰培養轉陰有關(表4)。

表3 logistic多因素分析變量賦值表
討 論
近年來,全球MDR-TB的發病率已達到創記錄水平,我國MDR-TB的流行情況亦十分嚴重。WHO于2011年的全球結核病控制報告顯示,目前全球已有5000萬例受耐藥結核分枝桿菌感染患者,其中2/3處于發生耐多藥的危險之中,2010年全球MDR-TB的發病例數約為29萬例[4]。到2012年,WHO估計2012年新發MDR-TB患者達到45萬例,且58%和27%的患者發生在亞洲和非洲,并有17萬例MDR-TB患者死亡[5]。
2013年WHO公布全球MDR-TB的治療成功率約在50%左右[6]。秘魯Suárez 等[7]報道298例MDR-TB患者的治療轉歸情況為:48%治愈,12%死亡,28%治療失敗,11%退出治療。Chiang等[8]的研究表明,中國臺北299例MDR-TB患者的治療轉歸為:52.1%成功,10.4%失敗,9.4%死亡,29.1%退出,這些研究與北京、上海等國內相關機構的研究結果相似[9-10],也與本研究患者最終的治療成功率52.93%(199/376)接近。
本研究發現治療早期獲得痰菌轉陰的患者,可以獲得較好的治療轉歸,治療2個月末痰菌培養陽性的患者治療成功率要遠低于痰菌陰性的患者(P<0.001)。治療2個月末時痰菌轉陰是預測普通肺結核治療轉歸的一個有力指標[11]。同樣的,MDR-TB患者在治療早期獲得痰菌轉陰的,也能得到較好的治療轉歸結果,反之,如果MDR-TB患者在治療早期不能獲得痰菌轉陰,也將不能獲得好的治療轉歸[12]。香港的一項研究顯示,MDR-TB患者在治療2個月末時痰檢轉陰者獲得了100%的治愈[13]。另一方面,治療2個月末時痰檢不能轉陰,也會獲得較差的治療轉歸[14]。
痰菌早期獲得轉陰一方面增加了患者治療的信心;另一方面對控制MDR-TB流行有重要意義,可以降低患者家庭成員、醫務人員和公眾感染的風險。本研究多因素logistic分析顯示,既往使用過一線和(或)二線抗結核藥物治療,治療初始對二線抗結核藥物或卡那霉素耐藥與2個月末痰檢轉陰呈負相關。
初始對氟喹諾酮類、氨基糖苷類藥物耐藥的患者會延緩MDR-TB患者的痰菌轉陰時間[15-16]。氟喹諾酮類、氨基糖苷類聯合應用于MDR-TB的治療已得到國內外醫學界的一致認可,是組成MDR-TB化療方案的必要藥物。由于左氧氟沙星和卡那霉素在我國作為常規廣譜抗生素應用多年,且過度使用,導致耐藥率逐漸增高,卡那霉素的耐藥率在6.5%~15.5%[17-18],左氧氟沙星的耐藥率超過了17%[10]。提醒要合理使用左氧氟沙星和卡那霉素,特別是在非耐藥結核病治療時,應該進行嚴格限制。
本研究中,接近60%的患者在治療2個月末時痰培養轉陰,高于國外的一些相關研究[19-20]。分析原因,一方面是患者在確診MDR-TB后能盡快開展治療,本研究有72.87%(274/376)的患者在確診后2個月內開始規則的治療,另一方面采取住院與門診相結合的治療原則,91.76%(345/376)的患者接受了4~8周的住院治療,出院后也執行嚴格的DOTS管理,使大部分患者能獲得規范的抗結核治療。
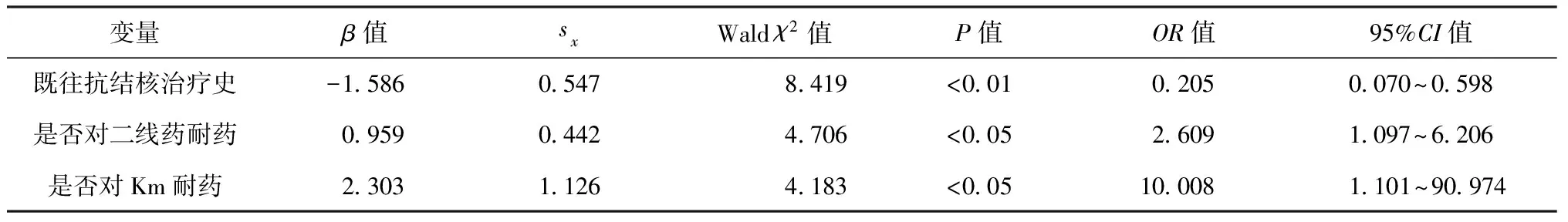
表4 MDR-TB患者治療第2個月末痰培養情況的多因素logistic回歸分析結果
本研究提示,在MDR-TB治療過程中,針對影響2個月末痰培養轉陰的影響因素,臨床治療人員可以早期鑒別并采取有力的個體化措施,對可能發生較差治療轉歸結果的患者提前干預,盡早促進痰菌轉陰。
[1] 中華人民共和國衛生部. 全國結核病耐藥性基線調查報告(2007—2008年). 北京: 人民衛生出版社, 2010.
[2] WHO. 世界衛生組織耐藥結核病規劃管理指南(2008年緊急修訂版). 北京: 中國疾病預防控制中心結核病防治臨床中心,2008.
[3] 戴麗華, 黃文華. 福建省莆田市荔城區新發涂陽肺結核患者強化期末痰涂片結果分析. 疾病監測,2011,26(12):949-951.
[4] World Health Organization. WHO report 2011: global tuberculosis control. Geneva: World Health Organization, 2011.
[5] World Health Organization. WHO global tuberculosis report 2013. Geneva: World Health Organization, 2013.
[6] World Health Organization. Multidrug-resistant TB (MDR-TB): 2013[M/OL].Geneva: World Health Organization, 2013[2014-10-10].http://www.who.int/tb/challenges/mdr/MDR_TB_FactSheet.
[7] Suárez PG, Floyd K, Portocarrero J, et al. Feasibility and cost-effectiveness of standardised second-line drug treatment for chronic tuberculosis patients: a national cohort study in Peru. Lancet, 2002,359(9322):1980-1989.
[8] Chiang CY, Enarson DA, Yu MC, et al. Outcome of pulmonary multidrug-resistant tuberculosis: a 6-yr follow-up study.Eur Respir J, 2006,28(5):980-985.
[9] 郝曉暉,唐神結,劉一典,等. 初治耐多藥肺結核臨床療效及其轉歸隊列分析研究. 中華醫學會結核病學分會2011年學術會議論文匯編, 2011:7.
[10] 洪峰,高志東,李波,等. 北京市耐多藥肺結核控制5年結果分析. 中國防癆雜志, 2013,35(9):706-710.
[11] 劉國標, 張麗好, 何霞, 等. 廣州市初治涂陽肺結核患者治療2個月末痰涂片不陰轉原因探討. 中國防癆雜志,2005,27(6):360-363.
[12] Brust JC, Berman AR, Zalta B, et al. Chest radiograph fin-dings and time to culture conversion in patients with multidrug-resistant tuberculosis and HIV in Tugela Ferry, South Africa. PloS One, 2013,8(9):e73975.
[13] Park SK, Kim CT, Song SD. Outcome of chemotherapy in 107 patients with pulmonary tuberculosis resistant to isoniazid and rifampin.Int J Tuberc Lung Dis,1998,2(11):877-884.
[14] Kwon YS, Kim YH, Suh GY, et al. Treatment outcomes for HIV-uninfected patients with multidrug-resistant and extensively drug-resistant tuberculosis. Clin Infect Dis, 2008,47(4):496-502.
[15] Migliori GB, Lange C, Girardi E, et al. Fluoroquinolones: are they essential to treat multidrug-resistant tuberculosis?Eur Respir J, 2008,31(4):904-905.
[16] Magee MJ, Kempker RR, Kipiani M, et al. Diabetes mellitus, smoking status, and rate of sputum culture conversion in patients with multidrug-resistant tuberculosis: a cohort study from the country of Georgia. PloS One, 2014,9(4): e94890.
[17] Prammananan T, Arjratanakool W, Chaiprasert A, et al. Se-cond-line drug susceptibilities of Thai multidrug-resistant Mycobacterium tuberculosis isolates. Int J Tuberc Lung Dis, 2005,9(2):216-219.
[18] Wang D, Yang C, Kuang T, et al. Prevalence of multidrug and extensively drug-resistant tuberculosis in Beijing, China: a hospital-based retrospective study. Jpn J Infect Dis, 2010,63(5):368-371.
[19] Rodriguez M, Monedero I, Caminero JA, et al. Successful management of multidrug-resistant tuberculosis under programme conditions in the Dominican Republic.Int J Tuberc Lung Dis, 2013,17(4):520-525.
[20] Janssen S, Padanilam X, Louw R, et al. How many sputum culture results do we need to monitor multidrug-resistant-tuberculosis (MDR-TB) patients during treatment? J Clin Microbiol, 2013,51(2):644-646.
(本文編輯:王然 薛愛華)
Risk factors associated with sputum culture status after two months’ treatment of multidrug-resistant tuberculosis
ZHOU Yang, XU Wei-guo, DING Xiao-yan, ZHU Li-mei, YU Hao, CHEN Cheng, SHAO Yan, LU Wei.
Department of Chronic Infectious Diseases, Jiangsu Provincial Center for Disease Prevention and Control, Nanjing 210009,China
Corresponding author: LU Wei, Email:jsjkmck@163.com
Objective To explore the situation of sputum culture conversion, and to evaluate the risk factors of sputum culture conversion for patients with multidrug-resistant TB. Methods In Xuzhou, Nantong and Zhenjiang, tuberculosis culture and strains identification were carried out on the sputum smear-positive patients, and then drug susceptibility test(DST) was carried out with proportion method. Standardized treatment regimen and individualized regimen were given to MDR-TB patients registered from 1 January 2009 to 30 June 2012. Surveillane and DOTS were implemented to each patient during the treatment. Bacteriologic, treatment outcome and risk factors of sputum culture conversion were evaluated. Three hundred and seventy-six MDR-TB patients had been analyzed, including 278 male, and 98 female. The average age was (49.33±15.36) years old. Data was analyzed using SPSS 13.0, Chi-squared test and logistic regression were used for univariate and multivariate statistics.Pvalue less than 0.05 was considered statistically significant. Results 58.78% (221/376), 61.97% (233/376) and 61.17% (230/376) patients got culture conversion at 2, 4 and 6 months’ treatment, which had no significant differences between them (χ2=0.807,P>0.05). The treatment success rates of patients got culture conversion at 2, 4 and 6 months were 69.68% (154/221), 71.24% (166/233) and 73.48% (169/230) respectively, which were all higher than patients with culture positive results or without culture results (χ2=60.804,82.619,101.047,P<0.01). The treatment success rate of patients with positive culture at 2 months’ treatment was 31.33% (26/83), and was higher than that at 6 months’ (16.36%, 9/55)(χ2=3.912,P<0.05). In a multivariate analysis, previous TB treatment (P<0.01,OR=0.205; 95%CI: 0.070-0.598), resistance to second line drugs (P<0.05,OR=2.609; 95%CI: 1.097-6.206) and resistance to kanamycin (P<0.05,OR=10.008; 95%CI: 1.101-90.974) had statistically significant negative association with culture conversion at 2 months. Conclusion About 60% MDR-TB patients get culture conversion at 2 months’ treatment. Previous TB treatment, resistance to second line drugs and resistance to kanamycin are associated with culture conversion at 2 months.
Tuberculosis, pulmonary/drug therapy; Drug resistance, multiple, bacterial; Treatment outcome; Retrospective study
10.3969/j.issn.1000-6621.2015.01.014
“十二五”國家科技重大專項(2013ZX10004905);江蘇省疾病預防控制中心科教興業工程(JKRC2011022)
210009 南京,江蘇省疾病預防控制中心
陸偉,Email:jsjkmck@163.com
2014-11-05)

