全身放射線照射對B16F10黑色素瘤小鼠的影響
王冰,屈朋歡,王艷華,崔乃鵬,蔡建輝,陳保平
(1河北大學附屬醫院,河北保定071000;2河北大學醫學部;3華北油田華苑醫院;4河北省人民醫院)
腫瘤的發生、發展過程與機體的免疫調節功能密切相關,采用過繼性細胞回輸為主要方法的免疫治療是目前公認的腫瘤治療新成就。由于腫瘤微環境中復雜多變的免疫抑制網絡限制了免疫治療的實際效果[1],目前臨床上常用干擾腫瘤微環境的方法是全身化療[2]。但是,以環磷酰胺為代表的化療藥物本身對惡性腫瘤就有治療效果,對免疫治療的效果判定存在干擾。根據既往的研究結果[3,4],荷瘤小鼠經清髓劑量全身放射線照射(TBI)后免疫力極度下降甚至消失,需經骨髓移植才能繼續存活以完成進一步的實驗觀察。2013年9月~2013年12月,我們通過觀察不同劑量TBI后荷瘤鼠的生存及腫瘤生長情況,篩選出適宜的全身照射劑量,使動物模型既能獲得腫瘤微環境的干擾又能在不應用骨髓移植的前提下保證生存,為進一步的實驗提供基礎。
1 材料與方法
1.1 材料 雌性C57BL/6小鼠(6~8周齡,體質量18~20 g)購自河北省實驗動物中心(許可證編號:SCXK冀2008-1-003);B16F10黑色素瘤細胞株購自中國科學院上海細胞生物學研究所;RPMI1640培養基購自Gibco公司;胰蛋白酶購自HyClone公司;胎牛血清購自杭州四季青生物工程材料有限公司。
1.2 方法
1.2.1 B16F10黑色素瘤細胞培養及荷瘤小鼠模型制備 B16F10黑色素瘤細胞株在含10%胎牛血清的RPMI-1640培養液中,于37℃、5%CO2飽和濕度的條件下培養,常規胰蛋白酶消化傳代。取對數生長期的細胞,經0.25%胰蛋白酶消化,PBS清洗后制備成活細胞懸液,臺盼藍染色法檢測細胞活力>95%,調整細胞濃度為1×106/mL用于實驗。取0.2 mL活細胞懸液皮下接種于C57BL/6小鼠背部皮下,建立黑色素瘤小鼠模型。對照組小鼠于背部皮下注射等量生理鹽水。
1.2.2 移植腫瘤組織學檢查 細胞接種7 d后,頸脫位法處死小鼠,剪去皮膚,觀察皮下移植腫瘤的形態、質地和活動度等;游離腫瘤組織,常規固定、石蠟包埋后切片進行HE染色,于光鏡下觀察。
1.2.3 荷瘤小鼠放療耐受實驗 細胞接種第7天,將荷瘤小鼠隨機分為4組:TBI 5 Gy組、TBI 7 Gy、TBI 7 Gy組后加骨髓移植組、荷瘤無照射組(0 Gy TBI),每組各10只。使用60Co作為荷瘤小鼠的放射源,劑量率為0.5 Gy/min,源皮距為80 cm。第3組在TBI 24 h后經尾靜脈注射1×106個健康C57BL/6小鼠新鮮骨髓細胞。
1.2.4 移植腫瘤生長曲線的繪制及荷瘤小鼠生存期記錄 每3~4 d用游標卡尺測量各組荷瘤小鼠皮下移植腫瘤的大小,記錄腫瘤結節最大長徑與平均短徑(垂直方向橫徑的平均值),腫瘤面積=最大長徑×平均短徑,繪制腫瘤生長曲線。觀察各組小鼠一般狀況,記錄生存期。
1.2.5 荷瘤小鼠外周血白細胞水平測定 荷瘤小鼠放療前后用眼球取血法取外周全血,用Coulter細胞計數儀檢測白細胞水平,并繪制變化曲線。
1.2.6 統計學方法 利用SAS統計分析軟件進行統計學處理,各組間比較采用單因素方差分析;應用Kaplan-Meier法進行生存分析并繪制生存曲線,各組生存曲線比較采用LogRank檢驗。P≤0.05為差異有統計學意義。
2 結果
2.1 B16F10惡性黑色素瘤小鼠模型的建立 將B16F10活細胞懸液接種于C57BL/6小鼠皮下第7天,可見移植腫瘤輕微突出皮面,直徑4~5 mm,呈黑色;腫瘤血供豐富,周圍可見新生血管形成,有包膜或假包膜。HE染色結果顯示,腫瘤組織中可見呈結節樣生長的B16F10移植腫瘤細胞團,呈圓形或橢圓形,周圍有豐富的新生毛細血管。
2.2 TBI對荷瘤小鼠腫瘤生長的影響 各組荷瘤小鼠腫瘤生長曲線如圖1。4組小鼠分別進行不同劑量的60Co放射線照射處理,總劑量分別為0、5、7 Gy及7 Gy+骨髓移植,定期測量腫瘤生長面積。與0 Gy TBI相比,接受5 Gy TBI、7 Gy TBI及7 Gy TBI+骨髓移植處理的荷瘤小鼠其腫瘤生長面積無統計學差異(P均>0.05)。
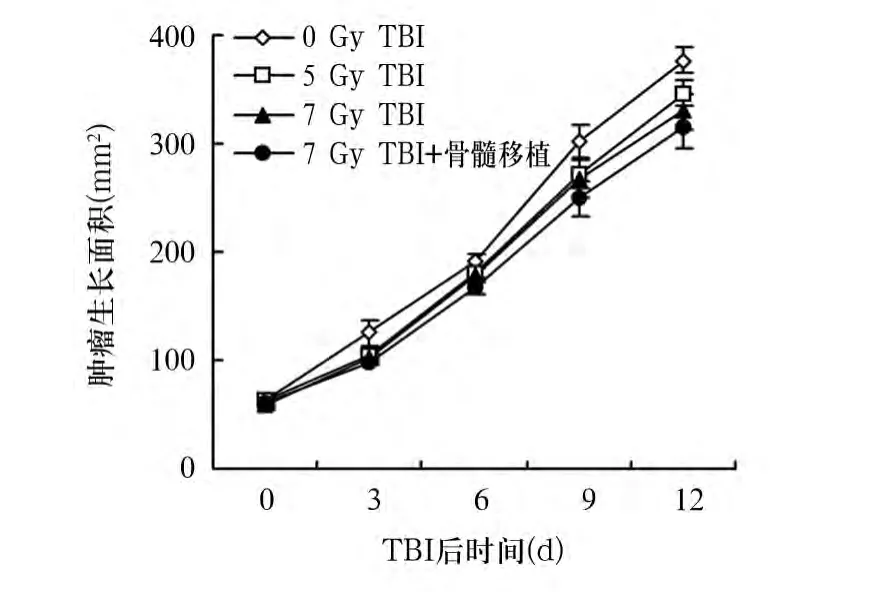
圖1 各組荷瘤小鼠移植腫瘤生長曲線
2.2 TBI對小鼠生存期的影響 經不同劑量60Co放射線照射后,觀察各組小鼠一般狀況至4周。各組小鼠的生存期比較無統計學差異(P=0.843)。見圖2。

圖2 各組荷瘤小鼠生存曲線
2.4 TBI對荷瘤小鼠外周血白細胞水平的影響荷瘤小鼠外周血白細胞水平高于對照組小鼠(P<0.05)。當給予7 Gy TBI后,與放療前比較,荷瘤小鼠白細胞水平放療后下降了86%~96%(P<0.05)。見圖3。
3 討論
腫瘤生物治療是目前公認的治療惡性腫瘤的主要手段之一,主要包括細胞過繼回輸免疫治療、細胞因子、基因治療和腫瘤疫苗治療等方法[5~9]。然而腫瘤組織自身產生的機體免疫耐受及對局部免疫微環境的抑制成為影響腫瘤生物治療療效的關鍵。如何打破機體對腫瘤的免疫耐受和改變腫瘤微環境使之產生有利于腫瘤免疫治療的趨勢是目前亟待解決的主要問題。

圖3 TBI對荷瘤小鼠外周血白細胞水平的影響
惡性黑色素瘤發病隱匿,對放化療均不敏感,其整體生存率和治愈率并不令人滿意,尤其是針對晚期惡性黑色素瘤,目前還沒有行之有效的治療方法[10]。近年來,惡性黑色素瘤免疫治療的研究備受關注。然而如何打破機體對腫瘤的免疫耐受和改變腫瘤微環境,并使經體外活化免疫治療效應細胞在腫瘤局部微環境內對腫瘤產生更佳的殺傷效果仍是目前面臨的主要問題[11]。已有研究表明,使用化療或放療預處理后再應用免疫治療手段可提高免疫治療的效果,但其作用機制及療效判定目前仍不明確[2]。
本研究采用B16F10惡性黑色素瘤細胞株皮下種植的方法制備惡性黑色素瘤小鼠移植腫瘤模型,采用不同劑量TBI作用于荷瘤小鼠,以觀察不同劑量TBI對荷瘤小鼠生存、移植腫瘤生長的影響,篩選出既能干擾小鼠腫瘤微環境又能在不應用骨髓移植的前提下保證小鼠存活的適宜TBI劑量,為后續免疫細胞過繼回輸治療奠定基礎。研究結果顯示,通過皮下接種B16F10黑色素瘤細胞的方法成功建立了惡性黑色素瘤小鼠模型。與0 Gy TBI相比,給予不同劑量TBI(5 Gy、7 Gy TBI或7 Gy TBI+骨髓移植)處理的荷瘤小鼠移植腫瘤大小無統計學差異,表明5 Gy或7 Gy照射未能影響小鼠惡性黑色素瘤移植腫瘤的生長。進一步觀察不同劑量TBI對荷瘤小鼠存活的影響,結果顯示,不同劑量照射組與無照射相比荷瘤小鼠生存期無統計學差異。同時,使用60Co作為放射源,在較低的劑量率(0.5 Gy/min)照射下,即使總劑量達到7 Gy,荷瘤小鼠在不給予同種異體骨髓回輸移植的前提下,仍能長期在清潔飼養條件下存活,生存期與給予骨髓移植組相比無統計學差異。這些結果表明,給予7 Gy TBI處理同時不給予骨髓移植,荷瘤小鼠耐受性較好,且該劑量TBI不影響腫瘤生長,此為進一步細胞過繼免疫治療的療效評價提供了必要的基礎。
此外,為了觀察7 Gy TBI處理對荷瘤小鼠免疫能力的影響,本研究進一步測定了放療前后荷瘤小鼠外周血白細胞水平。結果顯示,白細胞水平在放療第1天就迅速下降,并能在第7天降至最低值,表明7 Gy TBI可有效抑制荷瘤小鼠的免疫水平,此為進一步效應細胞免疫治療提供了條件。
[1]Zhou J,Shen X,Huang J,et al.Telomere length of transferred lymphocytes correlates with in vivo persistence and tumor regression in melanoma patients receiving cell transfer therapy[J].J Immunol,2005,175(10):7046-7052.
[2]Hatiboglu MA,Kong LY,Wei J,et al.The tumor microenvironment expression of p-STAT3 influences the efficacy of cyclophosphamide with WP1066 in murine melanoma models[J].Inter J Cancer,2012,131(1):8-17.
[3]Koh AJ,Novince CM,Li X,et al.An irradiation-altered bone marrow microenvironment impacts anabolic actions of PTH[J].Endocrinology,2011,152(12):4525-4536.
[4]Cao X,Wu X,Frassica D,et al.Irradiation induces bone injury by damaging bone marrow microenvironment for stem cells[J].Proc Natl Acad Sci U S A,2011,108(4):1609-1614.
[5]Soto BL,Hank JA,Van De Voort TJ,et al.The anti-tumor effect of resveratrol alone or in combination with immunotherapy in a neuroblastoma model[J].Cancer Immunol Immunother,2011,60(5):731-738.
[6]Rapoport AP,Aqui NA,Stadtmauer EA,et al.Combination immunotherapy using adoptive T-cell transfer and tumor antigen vaccination on the basis of hTERT and survivin after ASCT for myeloma[J].Blood,2011,117(3):788-797.
[7]Pai CC,Kuo TF,Mao SJ,et al.Immunopathogenic behaviors of canine transmissible venereal tumor in dogs following an immunotherapy using dendritic/tumor cell hybrid[J].Vet Immunol Immunopathol,2011,139(2-4):187-199.
[8]Stewart TJ,Smyth MJ.Improving cancer immunotherapy by targeting tumor-induced immune suppression[J].Cancer Metastasis Rev,2011,30(1):125-140.
[9]Ochi T,Fujiwara H,Yasukawa M.Requisite considerations for successful adoptive immunotherapy with engineered T-lymphocytes using tumor antigen-specific T-cell receptor gene transfer[J].Expert Opin Biol Ther,2011,11(6):699-713.
[10]Kammerer PW,Shabazfar N,Palarie V,et al.Therapy and prognosis of extraoral malignant melanoma metastasizing to the jaw:case report and literature review[J].J Oral Maxillofac Surg,2011,69(4):1229-1234.
[11]Boni A,Muranski P,Cassard L,et al.Adoptive transfer of allogeneic tumor-specific T cells mediates effective regression of large tumors across major histocompatibility barriers[J].Blood,2008,112(12):4746-4754.

