短時強光處理對金心吊蘭光合特性的影響
董立花,韓巧紅,楊勇,袁明
(四川農業大學生命科學學院,四川 雅安 625014)
?
短時強光處理對金心吊蘭光合特性的影響
董立花,韓巧紅,楊勇,袁明*
(四川農業大學生命科學學院,四川 雅安 625014)
強光脅迫常常導致植物的葉綠素含量下降,但是葉綠素合成受阻的突變體在光脅迫下會發生怎樣的生理生化變化目前未見報道。本研究以金心吊蘭為材料,研究了同一葉片的不同區帶對短時強光脅迫的生理響應。結果表明,1)在正常的光照下,金心部分PSⅡ的活性顯著低于其他部分,但活性氧含量卻維持在較高的水平;2)在強光脅迫的6 h內,金心部分的活性氧波動不大,抗氧化酶活性變化也較小,均低于其他部分;3)短時強光脅迫導致吊蘭葉片的非光化學淬滅上升,而金心部分上升幅度較少,說明吸收的過多光能在金心部分不是以熱耗散的形式消耗,并且金心部分能在較短的時間內恢復到脅迫前的非光化學淬滅水平。
光脅迫;金心吊蘭;光合作用;葉綠素熒光
光是植物生長發育所必須的環境因子,是光合作用的能量來源,但是植物吸收過多的光能會產生過量的活性氧,抑制光合作用,甚至損傷光合器官,因此光強是影響植物光合作用最直接最重要的環境因子[1-2]。研究表明植物在受到強光脅迫后,光合效率降低,活性氧升高,抗氧化酶活性增加[3]。
葉綠素是植物吸收光能的分子,葉綠素合成的突變體常常被用于研究植物葉綠素代謝及光合作用的分子機制。植物中葉綠素生物合成受阻往往會導致葉綠素含量下降,葉綠體發育延遲,使得葉片表現出黃化或白化的現象,嚴重時甚至會導致植物體的死亡[4]。金心吊蘭(Chlorophytumcapensevar.medio-pictum),是百合科(Liliceae)吊蘭屬(Chlorophytum)多年生植物,葉片表現為中心黃白色,邊緣綠色,形成綠-黃白-綠的嵌合縱條紋[5],賈學靜等[6]通過葉綠素原位熒光成像表明金心吊蘭的金心部分葉綠素含量極低,沒有典型的葉綠體。這種一葉雙色性狀的葉片是研究植物葉綠素代謝與光脅迫關系的極好材料。
光脅迫與光抑制一直是植物光合作用研究的熱點,但是在強光下,葉綠素生物合成受阻的葉部位會發生怎樣的生理變化,是否更能適應強光脅迫。本研究以園藝栽培突變體金心吊蘭為材料,研究強光脅迫對其葉片生理活動的影響,重點分析葉綠素生物合成受阻的金心部分對強光脅迫的生理響應,從而為探索植物葉綠素生物代謝與光脅迫的關系奠定基礎。
1 材料與方法
1.1試驗材料和處理方法
試驗于2014年6-8月進行,以野生型的全綠吊蘭作為突變體金心吊蘭的對照,以消除葉片位置效應的影響。選取生長一致的全綠吊蘭和金心吊蘭栽培于人工氣候箱(20℃,80 μmol/m2·s,16 h光/8 h暗),適應生長4周。將材料轉移至強光下(氙燈,500 μmol/m2·s),分別處理0,0.5,1,2,3 和6 h后,選取從頂部向外完全展開的第3片成熟葉的中段用于生理生化指標測定。光合參數的測定為10個重復,其余試驗均為3個重復。
1.2測定指標和方法
1.2.1葉綠素含量的測定 稱取1 g葉片,液氮冷凍研磨,加入10 mL 80%丙酮,轉入離心管,用80%丙酮定容至20 mL,5000 r/min離心5 min,取上清液測定664,662,644和440 nm 下的吸光值。參照Lichtenthaler 和Wellburn[7]的方法計算葉綠素a,葉綠素b和類胡蘿卜素的含量。
1.2.2光合能力的測定 參照Nilkens等[8]的方法采用多功能調制熒光成像系統(IMAGING-PAM,Walz公司,德國)測定光脅迫下吊蘭葉片的熒光參數,先將整盆植株暗適應20 min后,選擇從頂部向外完全展開的第3片葉進行測定,光強為500 μmol/(m2·s),間隔時間20 s。測定初始熒光(F0),最大熒光(Fm),光下最小熒光(F0′),光下最大熒光(Fm′),PSⅡ實際光化學效率(ΦPSⅡ),并利用F0和Fm,F0′和Fm′計算PSⅡ最大光化學效率(Fv/Fm),PSⅡ有效光化學量子產量(Fv′/Fm′)。使用GSF-3000(Walz公司,德國)光合儀測定蒸騰速率(Tr),氣孔導度(Gs),胞間CO2濃度(Ci)等。測定葉室為2 cm×4 cm,光強為500 μmol/(m2·s),溫度為25℃。每個測定選用10個葉片,每個葉片在中段位置選擇3個測量點。
1.2.3活性氧和抗氧化酶活性的測定 過氧化氫的測定按照Shabala和Cuin[9]的方法,取葉片液氮研磨后,加入1 mL 0.1% (w/v)三氯乙酸,4℃ 12000 r/min離心10 min,取上清加入0.5 mL 10 mmol/L磷酸鉀緩沖液(pH 7.0)和1 mL 1 mol/L碘化鉀混勻,暗反應20 min。測390 nm處的吸光值。
超氧陰離子的測定參照Shabala和Cuin[9]的方法。稱取葉片,液氮研磨,加入3 mL的50 mmol/L的磷酸鉀緩沖液,4℃ 12000 r/min離心20 min,上清液為超氧陰離子的提取液。在試驗組、對照組和空白調零組中分別加入0.5 mL的50 mmol/L的磷酸鉀緩沖液,在試驗組和空白調零組分別加入0.1 mL的10 mmol/L 鹽酸羥胺,對照組中加入0.1 mL蒸餾水,在25℃保溫10 min,取0.5 mL提取液分別加入試驗組和對照組,空白調零組中加入0.5 mL 50 mmol/L的磷酸鉀緩沖液,保溫10 min,分別加入1 mL 58 mmol/L的對氨基苯磺酸溶液和1 mL 7 mmol/L的一萘胺溶液,25℃保溫20 min。加入3 mL的三氯甲烷萃取,取粉紅色上相測定530 nm處的吸光值。
超氧化物歧化酶(SOD)活性的測定按照氮藍四唑(NBT)光還原法[9],反應體系為5 mL:4.05 mL的0.05 mol/L 磷酸緩沖液、0.3 mL的220 mmol/L 甲硫氨酸、0.3 mL的1.25 mmol/L NBT、0.3 mL的100 μmol/L EDTA、0.3 mL的33 μmol/L 核黃素,加入0.05 mL的粗酶提取液啟動反應,在4000 lx光下反應15 min,測定560 nm處的吸光值。每間隔1 min測1次,連續測量3 min。
過氧化物酶(POD)活性的測定參照愈創木酚法[9],在離心管中加入3 mL 50 mmol/L磷酸緩沖液,1 mL 0.05 mol/L愈創木酚,1 mL 2% H2O2作為底物反應體系,加入100 μL過氧化物酶粗提液啟動反應,分別測定1和3 min時470 nm處的吸光值。
過氧化氫酶(CAT)活性的測定參照過氧化氫還原法[9],具體步驟:3 mL反應液[33.33 mmol/L 磷酸緩沖液,15 mmol/L H2O2]加入50 μL 50 mmol/L粗酶提取液啟動反應,測定240 nm處的吸光值。每間隔30 s測1次,連續測量3 min。
1.2.4吊蘭葉片對光脅迫的恢復能力測定 參考Alboresia等[10]的方法稍有改動,以非光化學淬滅(NPQ)作為監測金心吊蘭對光脅迫響應及其恢復的指標,測定時的弱光及恢復光均為2 μmol/(m2·s),模擬的生長光為86 μmol/(m2·s),脅迫光強為500 μmol/(m2·s),脅迫時間為30 min,每間隔20 s測定1次。
1.3數據分析
采用Excel 2007和SPSS 19.0進行統計分析,并使用ANOVA進行顯著性檢測(P<0.05),圖中數據為平均值±標準誤差,并運用Origin 9.0進行繪圖。
2 結果與分析
2.1葉片光合色素含量
與野生型全綠吊蘭的葉片相比,金心吊蘭的葉片邊緣為綠色,主脈及其靠近的區域表現出黃白色的條紋(圖1)。吊蘭葉片由于中心主脈的存在,其中心部分葉綠素含量顯著低于邊緣部分,但是金心吊蘭中心部分葉綠素含量更少,僅為其邊緣的18%,而全綠吊蘭的中心部分葉綠素含量為邊緣部分的58%。金心吊蘭的邊緣部分與全綠吊蘭的邊緣部分葉綠素含量沒有顯著差異,但是中心部分僅為全綠吊蘭的34%。類胡蘿卜素也表現出與葉綠素相似的變化(圖1E)。這說明葉綠素與類胡蘿卜素等光合色素的合成在金心吊蘭的金心部分明顯受到抑制。

圖1 吊蘭的表型和光合色素含量
2.2光脅迫對金心吊蘭葉片光合能力的影響
光脅迫導致胞間CO2濃度(Ci)增加,氣孔導度(Gs)和蒸騰速率(Tr)下降(圖2)。強光脅迫6 h后,金心吊蘭中心部分的蒸騰速率僅為脅迫前的14%,而邊緣部分為脅迫前的33%;全綠吊蘭的中心部分和邊緣部分分別為脅迫前的34%和45%。這表明光脅迫對金心吊蘭中心部分蒸騰速率的影響遠大于其余部分。氣孔導度的變化也表現出相似的特征,但是金心吊蘭中心部分的胞間CO2濃度(Ci)卻遠高于邊緣部分,而金心吊蘭葉片的中心部分與邊緣部分處在同一環境中,光照、溫度、濕度等環境因子基本一致,此外, 蒸騰速率與光合速率呈正相關關系,由此表明金心吊蘭中心部分光合作用可能更容易受到光脅迫的影響。
2.3光脅迫對金心吊蘭葉片葉綠素熒光參數的影響
初始熒光(F0)的大小在某種程度上與葉綠素的含量有關,而與光合作用光化學反應無關[11],金心吊蘭中心部分葉綠素含量很低,其F0也很低(圖3A)。金心吊蘭的金心部分PSⅡ有效光化學量子產量(Fv′/Fm′)和PSⅡ實際光化學效率(ΦPSⅡ)也都處于一個較低的水平。
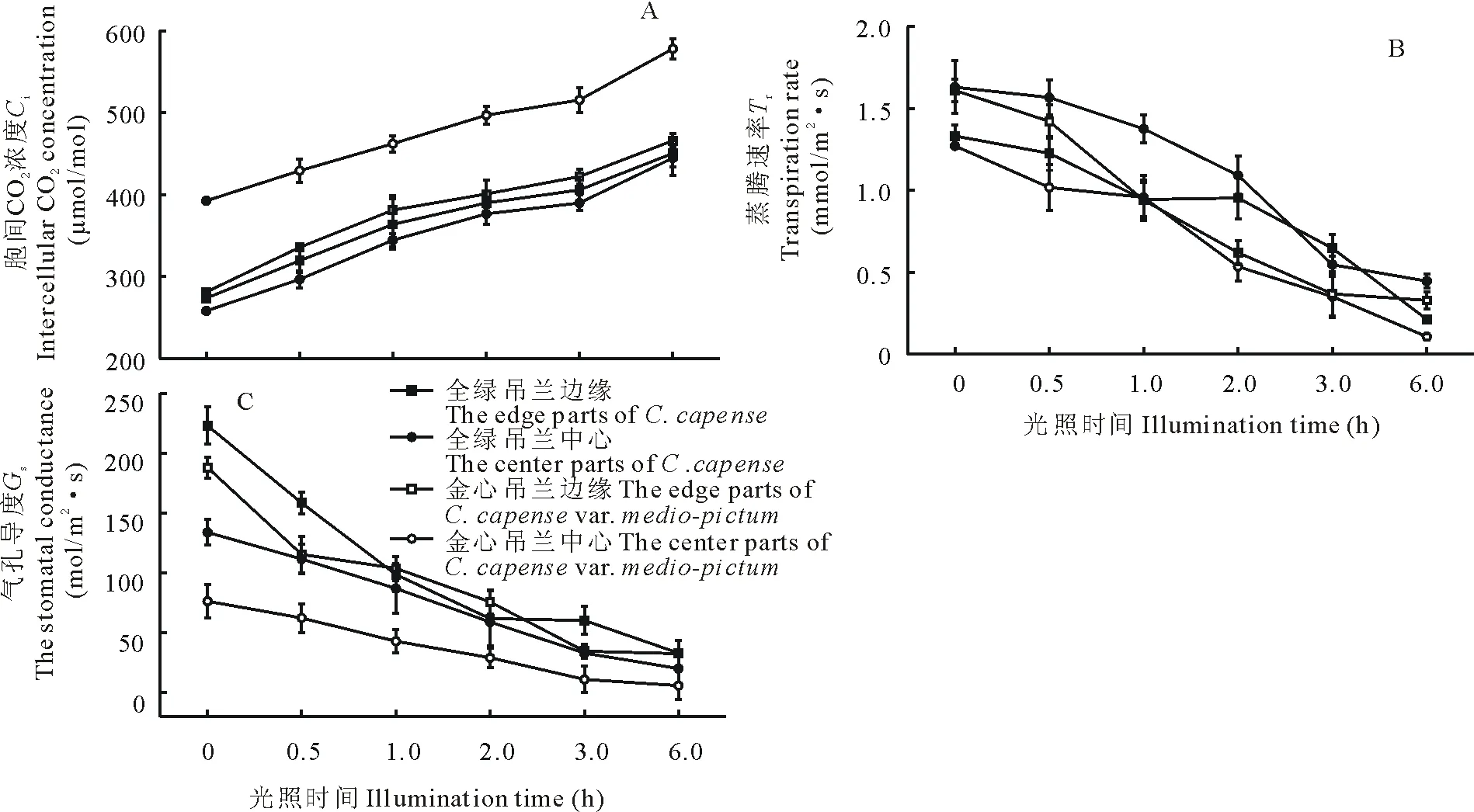
圖2 強光脅迫對葉片光合參數的影響
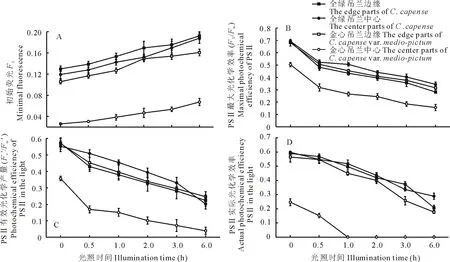
圖3 強光脅迫對葉綠素熒光參數的影響
在吊蘭葉片的不同部位,隨著光脅迫時間的延長,F0均逐漸增大,PSⅡ最大光化學效率(Fv/Fm)隨著光脅迫時間的延長逐漸降低(圖3B),表明光脅迫可能導致了吊蘭葉片PSⅡ反應中心失活,或者葉片受到了不同程度的光抑制。PSⅡ有效光化學量子產量(Fv′/Fm′)和PSⅡ實際光化學效率(ΦPSⅡ)在吊蘭葉片的不同部位均表現為隨光脅迫時間的延長逐漸減少(圖3C, D)。表明光脅迫下吊蘭葉片PSⅡ反應中心隨脅迫時間的延長而逐漸關閉,天線色素光能傳遞效率逐步下降,這可能是防止過剩光能導致光合器官被破壞的一種保護性機制[12]。從對強光脅迫0.5 h內的變化幅度來看,金心吊蘭的金心部分F0增加約20%,全綠部分增加約10%,而全綠吊蘭的中心和邊緣部分的增幅都不到10%;金心吊蘭的金心部分Fv/Fm下降約40%,其余材料均不到30%;金心吊蘭的金心部分Fv′/Fm′下降約50%,其余材料均不到25%;金心吊蘭的金心部分ΦPSⅡ下降約40%,其余材料均不到10%。從F0、Fv/Fm、Fv′/Fm′和ΦPSⅡ的變化幅度來看,光脅迫對金心吊蘭葉片金心部分的光合作用影響更大。
2.4光脅迫對金心吊蘭葉片活性氧的影響
在正常光照下生長,金心吊蘭的O2-·含量高于全綠吊蘭,中心部分均高于邊緣部分(圖4A);H2O2的含量金心吊蘭也高于全綠吊蘭,但是邊緣部分高于中心部分(圖4B),這表明金心吊蘭葉片的葉綠素代謝與葉片的活性氧代謝緊密相關。H2O2的含量在光脅迫過程中總體呈逐漸上升的趨勢,在脅迫6 h后全綠吊蘭H2O2的含量高于金心吊蘭,而且均表現為邊緣部分高于中心部分。綜合葉片各部分活性氧(O2-·和H2O2)水平在光脅迫過程中隨時間波動幅度的變化,金心部分波動幅度較小,相對平穩,說明光脅迫對金心部分的活性氧水平影響較小。
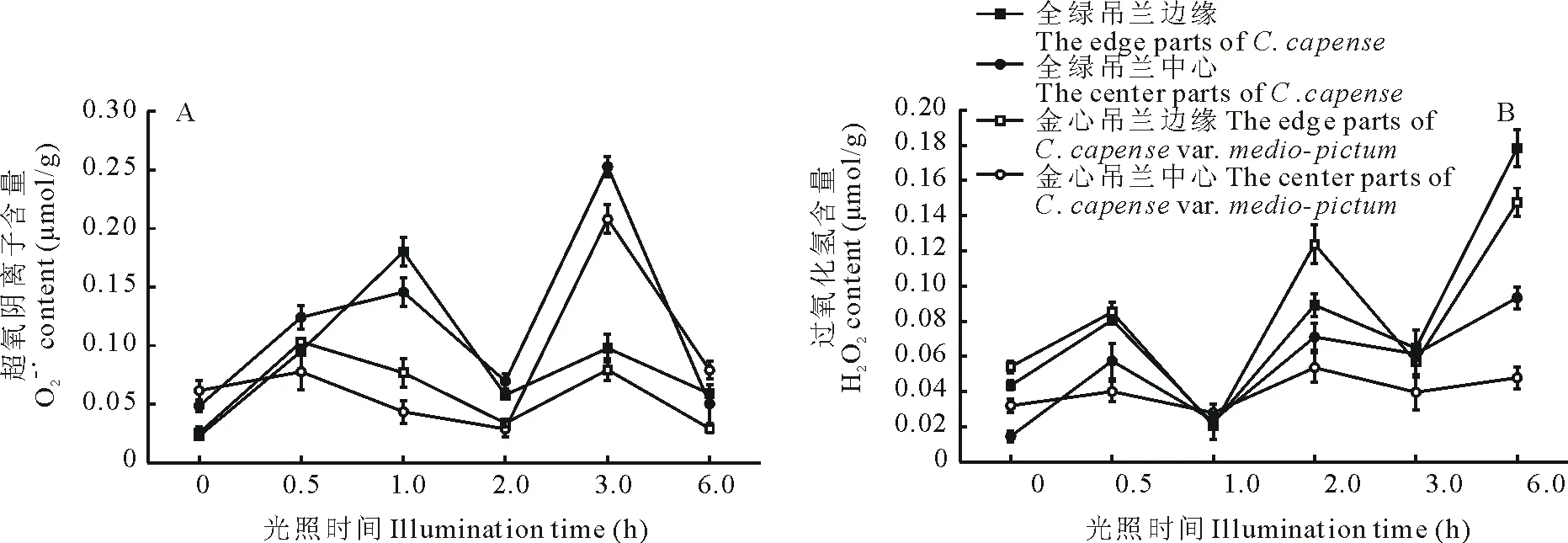
圖4 光脅迫對葉組織過氧化氫和超氧陰離子含量的影響
2.5光脅迫對金心吊蘭抗氧化酶活性的影響
超氧化物歧化酶(SOD)、過氧化物酶(POD)和過氧化氫酶(CAT)是植物體內清除活性氧的關鍵酶,其活性變化常常與植物適應脅迫生境的能力密切相關。強光脅迫導致吊蘭葉片SOD活性逐漸降低;CAT活性變化總體上與SOD相似,酶活性呈下降的趨勢;但POD活性總體是隨著強光脅迫時間的延長而增加(圖5)。強光脅迫0.5 h,SOD和CAT的活性已經發生了顯著變化,說明對于吊蘭葉片而言,這2個酶的活性對強光脅迫的反應比較靈敏。從POD和CAT在光脅迫過程中隨時間的變化幅度來看,金心部分波動幅度較小,這與活性氧的變化趨勢一致。
2.6吊蘭葉片對強光脅迫的恢復能力
經過暗適應的吊蘭,轉到正常的生長光(80 μmol/m2·s)下,其NPQ經過一個短暫的適應期(約200 s),很快達到一個穩定狀態(圖6)。在正常的光照下,吊蘭葉片中心部分的NPQ明顯低于邊緣部分;金心吊蘭的金心部分低于全綠吊蘭的中心部分,但是二者的邊緣部分相似。說明吊蘭葉片的不同部位,NPQ明顯不同;葉綠素缺少的金心部分NPQ顯著減少。在強光(500 μmol/m2·s)脅迫下,NPQ迅速增加,葉片邊緣部分增加的幅度大于中心部分,金心部分增加最少。說明吊蘭葉片的邊緣部分在強光脅迫下,能夠將更多的能量以熱耗散的形式消耗掉,從而減少光氧化損傷;而中心部分的熱耗散能力較弱。在弱光(2 μmol/m2·s)下,葉片的NPQ逐漸下降,經過500 s的弱光恢復,吊蘭葉片的中心部分基本恢復到脅迫前的水平,邊緣部分約為脅迫前的2倍。說明短時(720 s)的強光處理,不會對金心部分的光系統造成不可逆的損傷,且與其他部分相比較,金心部分能更快地恢復到脅迫前的光合能力。
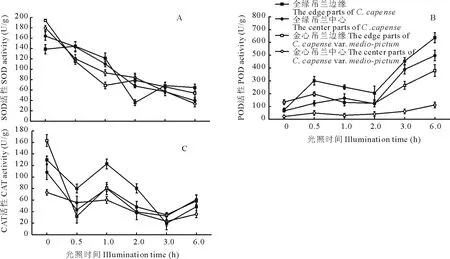
圖5 光脅迫對葉片SOD、CAT、POD酶活性的影響
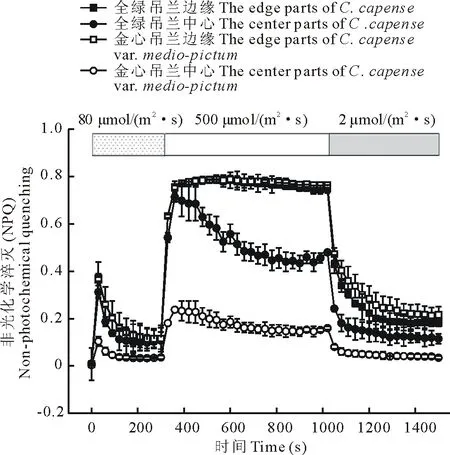
圖6 短時強光脅迫對非光化學淬滅的影響
3 討論
植物在脅迫環境下導致光合效率降低的原因主要包括氣孔和非氣孔因素,若Ci降低,Tr升高則是氣孔因素;Ci升高,Tr降低,則是非氣孔因素[13]。在強光下,吊蘭葉片的胞間CO2濃度(Ci)隨著脅迫時間的延長而增加;蒸騰速率(Tr)和氣孔導度(Gs)隨著脅迫時間的延長而下降(圖2)。這表明光脅迫導致吊蘭葉片蒸騰速率下降主要受非氣孔因素調節。
PSⅡ對環境脅迫非常敏感,強光脅迫常導致PSⅡ結構和功能發生一系列變化[14]。在本研究中, 金心吊蘭和全綠吊蘭的生理指標和葉綠素熒光指標(除金心外)都趨于一致,其中生理指標的Gs,Tr,都隨著光脅迫時間的延長而下降,Ci則隨著光脅迫時間的延長而上升,這和邱翠花[14]對溫州蜜柑的研究結果一致。
與氣體交換的光合參數相比,葉綠素熒光參數更能反映高等植物光系統Ⅱ(PSⅡ)內在的光合特征,因此, 通過測定葉綠素熒光的變化可以較直觀地研究植物光合作用的機制[15-16]。有研究表明,PSⅡ反應中心的失活會導致F0的升高[17],同時葉綠素含量、非輻射能量耗散和PSⅡ反應中心失活或破壞等因素也會導致F0的改變[18]。在強光脅迫下,Fv/Fm隨著脅迫時間的延長而降低,表明吊蘭葉片的不同區域都受到了不同程度的光抑制,而F0則隨著脅迫時間的延長而增加,說明PSⅡ反應中心可能發生了失活或破壞。
植物體受到環境脅迫后,細胞內的活性氧,包括超氧根陰離子(O2-·)、過氧化氫(H2O2)等,代謝常常發生顯著變化,因此活性氧的變化常常作為植物對逆境響應的生理指標[19]。在強光脅迫下,金心部分的變化幅度較小,這可能與其較低的葉綠素水平有關。SOD是超氧陰離子的專屬清除酶,吊蘭葉片在強光脅迫下,其活性變化與細胞內的O2-·變化沒有表現出顯著的關聯關系(圖4);CAT和POD都有清除細胞內H2O2的能力,在光脅迫的過程中,吊蘭葉片的H2O2含量與CAT的活性表現出明顯的負相關,即CAT酶活性升高時,細胞內積累的H2O2下降,反之亦然。這些結果表明,在光脅迫下,CAT是清除吊蘭葉細胞內H2O2的主要酶類,POD的作用相對較弱。
NPQ反映的是PSⅡ天線色素吸收的不能用于光合電子傳遞而以熱的形式耗散掉的光能部分,所以NPQ是一種對光合器官起保護作用的自我防護機制。在脅迫生境下植物NPQ常常會增加[20]。金心部分在正常的生長光下,其非光化學淬滅很低,說明在正常的光照下,金心部分的熱耗散能力較弱。這樣葉片吸收的過多光能不能通過熱耗散和光合作用途徑消耗,從而增加了過剩光能所激發的電子用來生成活性氧的比例。在正常的光照下,金心部分含有較高的活性氧水平證實了這一點(圖4)。在長時間的強光脅迫下,金心部分的光抑制就會加劇,引起光合器官的損壞,甚至導致葉片的壞死。6 h強光照射使得金心吊蘭和全綠吊蘭受到了嚴重的光抑制,甚至對金心部分的葉組織造成無法恢復的傷害,最終變枯死亡(數據未給出)。但是在強光照射的過程中,金心部分超氧根陰離子和過氧化氫的波動較其他組織小,抗氧化酶類活性的變化也較小(圖4,圖5),那么導致其光合能力出現較大波動及其葉組織死亡的原因應該不是超氧根陰離子和過氧化氫的變化,具體原因還需要進一步研究。楊廣東等[21]研究發現缺鎂的黃瓜葉片在強光下光化學淬滅(光合作用)和非光化學淬滅(熱耗散)都降低,使得葉片吸收的過多光能不能通過光化學反應途徑和非光化學途徑耗散,從而增加了過剩光能所激發的電子用來生成活性氧的比例,加劇光抑制,破壞光合器官,最終導致葉片的失綠壞死。這與吊蘭的情況既相似又不同,吊蘭在光脅迫下光化學淬滅(光合作用)降低,非光化學淬滅(熱耗散)小幅度增加,超氧根陰離子和過氧化氫僅發生小幅度的波動,但是最終卻也導致葉組織死亡。
[1] Cleland R E, Melis A, Neale P J.Mechanism of photoinhibition:photochemical reaction center inactivation in photosystem Ⅱ of chloroplasts.Photosynthesis Research, 1995, 9:79-88.
[2] Li X G, Meng Q W, Zhao S J.Photoinhibition and photoprotection mechanisms inGinkgobilobaleaves under strong light stress.Scientia Silvae Sinicae, 2004, 40(3):56-59.
[3] Fini A, Guidi L, Ferrini F,etal.Drought stress has contrasting effects on antioxidant enzymes activity and phenylpropanoid biosynthesis inFraxinusornusleaves:An excess light stress affair.Journal of Plant Physiology, 2012, 169:929-939.
[4] Wang P R, Zhang F T, Gao J X,etal.An overview of chlorophyll biosynthesis in higher plants.Acta Botanica Boreail-Occidentalia Sinica, 2009, 29(3):629-636.
[5] Jia X J, Ran H C, Zeng S H,etal.Study on leaf anatomical structure ofChlorophytumcapensevar.medio-pictum.Journal of Sichuan Agricultural University, 2011, 29(2):199-202.
[6] Jia X J, Dong L H, Ding C B,etal.Effects of drought stress on reactive oxygen species and scavenging system inChlorophytumcapenseVar.Acta Prataculturae Sinica, 2013, 22(5):248-255.
[7] Lichtenthaler H K, Wellburn A R.Determination of total carotenoids and chlorophylls a and b of leaf extracts in different solvents.Biochemical Society Transactions, 1983, 603:591-592.
[8] Nilkens M, Kress E, Lambrev P,etal.Identification of a slowly inducible zeaxanthin-dependent component of non-photochemical quenching of chlorophyll fluorescence generated under steady-state conditions inArabidopsis.Biochimica et Biophysica Acta (BBA)-Bioenergetics, 2010, 1797:466-475.
[9] Shabala S, Cuin T A.Plant Salt Tolerance:Methods and Protocols[M].New York:Humana Press, 2012.
[10] Alboresia A, Gerottob C, Giorgio M G.Physcomitrellapatensmutants affected on heat dissipation clarify the evolution of photoprotection mechanisms upon land colonization.PNAS, 2010, 107(24):11128-11133.
[11] Lu C M, Zhang Q D, Kuang T Y,etal.The effects of water stress on photosystem Ⅱ in wheat.Acta Botanica Sinica, 1994, 36(2):93-98.
[12] Chen D Y, Liu C Y, Yuan Y,etal.Effects of temperature and light treatments on PSⅡ photochemical activity in‘roufurong’tree peony teaves.Acta Horticulturae Sinica, 2011, 38(10):1939-1946.
[13] Hartley I P, Armstrong A F, Murthyw R,etal.The dependence of respiration on photosynthetic substrate supply and temperature:Integrating leaf soil and ecosystem measurements.Global Change Biology, 2006, 12:1954-1968.
[14] Qiu C H.Study of Mechanism of Strong Light Induced Photodamage of Photosynthetic Apparatus inSatsumamandarin(CitrusunshiuMarc.) at High Temperature[D].Hangzhou:Zhejiang University, 2011.
[15] Ivanov A G, Rosso D, Savitch L V,etal.Implications of alternative electron sinks in increased resistance of PSⅡ and PSI photochemistry to high light stress in cold-acclimatedArabidopsisthaliana.Photosynthesis Research, 2012, 113:191-206.
[16] Li R, Wen T, Tang Y P,etal.Effect of shading on photosynthetic and chlorophyll fluorescence characteristics of soybean.Acta Prataculturae Sinica, 2014, 23(6):198-206.
[17] Krause G H, Weis E.Chlorophyll fluorescence and photosynthesis.Annual Review Plant Physiology and Plant, 1991, 42:313-349.
[18] Xu D Q, Wu S.Three phases of dark-recovery course from photoinhibition resolved by the chlorophyll fluorescence analysis in soybean leaves under field conditions.Photosynthetica, 1996, 32:417-423.
[19] Zhou C F, Zheng G S, Zhang Y X,etal.Strong light stress on peony leaf antioxidant system.Jiangsu Agricultural Sciences, 2011, 39(3):232-233.
[20] Li X, Feng W, Zeng X C.Advances in chlorophyll fluorescence analysis and its uses.Acta Botanica Boreali-Occidentalia Sinica, 2006, 26(10):2186-2196.
[21] Yang G D, Zhu Z J, Ji Y M.Effect of light intensity and magnesium deficiency on chlorophyll fluorescence and active oxygen in cucumber leaves.Plant Nutrition and Fertilizer Science, 2002, 8(1):115-118.
參考文獻:
[2] 李新國, 孟慶偉, 趙世杰.強光脅迫下銀杏葉片的光抑制及其防御機制.林業科學, 2004, 40(3):56-59.
[4] 王平榮, 張帆濤, 高家旭, 等.高等植物葉綠素生物合成的研究進展.西北植物學報, 2009, 29(3):629-636.
[5] 賈學靜, 冉何陳, 曾順華, 等.園藝觀賞植物金心吊蘭的葉片解剖結構.四川農業大學學報, 2011, 29(2):199-202.
[6] 賈學靜, 董立花, 丁春邦, 等.干旱脅迫對金心吊蘭葉片活性氧及其清除系統的影響.草業學報, 2013, 22(5):248-255.
[11] 盧從明, 張其德, 匡廷云, 等.水分脅迫對小麥光系統Ⅱ的影響.植物學報, 1994, 36(2):93-98.
[12] 陳大印, 劉春英, 袁野, 等.不同光強與溫度處理對“肉芙蓉”牡丹葉片PSⅡ 光化學活性的影響.園藝學報, 2011, 38(10):1939-1946.
[14] 邱翠花.高溫強光誘導的溫州蜜柑光合機構光破壞機理研究[D].杭州: 浙江大學,2011.
[16] 李瑞, 文濤, 唐艷萍, 等.遮陰對大豆幼苗光合和熒光特性的影響.草業學報, 2014, 23(6):198-206.
[19] 周傳鳳, 鄭國生, 張玉喜, 等.強光脅迫對牡丹葉片抗氧化系統的影響.江蘇農業科學, 2011, 39(3):232-233.
[20] 李曉, 馮偉, 曾曉春.葉綠素熒光分析技術及應用進展.西北植物學報, 2006, 26(10):2186-2196.
[21] 楊廣東, 朱祝軍, 計玉妹.不同光強和缺鎂脅迫對黃瓜葉片葉綠素熒光特性和活性氧產生的影響.植物營養與肥料學報, 2002, 8(1):115-118.
Photosynthetic characteristics ofChlorophytumcapensevar.medio-pictumunder short duration high light intensity
DONG Li-Hua, HAN Qiao-Hong, YANG Yong, YUAN Ming*
CollegeofLifeScience,SichuanAgriculturalUniversity,Ya’an625014,China
It is well known that high light often causes decreased chlorophyll in plants, but the photosynthetic and physiological characteristics of reduced chlorophyll variants under high light is not well understood.Physiological responses to high light intensity in the green stripe and yellow stripe leaf variants ofChlorophytumcapensevar.medio-pictumwere investigated in this study.The results showed that under normal light levels, PSⅡ activity of yellow stripe plants was lower than those of green stripe.However, the level of reactive oxygen species remained elevated.After 6 hours of high light stress, the level of reactive oxygen species and activity of antioxidant enzymes varied less in yellow stripe plants.Under a few minutes of high light stress, non-photochemical quenching increased in all tissues, but the non-photochemical quenching of the yellow stripe plants increased less than the others.These results demonstrated that excess light energy in yellow-stripe leaf tissue was not dissipated in the form of heat; furthermore, the level of non-photochemical quenching in yellow stripe plants was restored in a few minutes.
high light stress;Chlorophytumcomosumvar.medio-pictum; photosynthesis; chlorophyll fluorescence
10.11686/cyxb2015059
http://cyxb.lzu.edu.cn
2015-01-27;改回日期:2015-03-18
四川省教育廳青年項目(11ZB054)資助。
董立花(1989-),女,河北邯鄲人,在讀碩士。E-mail:dlh_scau@163.com
*通信作者Corresponding author.E-mail:yuanming@sicau.edu.cn
董立花, 韓巧紅, 楊勇, 袁明.短時強光處理對金心吊蘭光合特性的影響.草業學報, 2015, 24(12):245-252.
DONG Li-Hua, HAN Qiao-Hong, YANG Yong, YUAN Ming.Photosynthetic characteristics ofChlorophytumcapensevar.medio-pictumunder short duration high light intensity.Acta Prataculturae Sinica, 2015, 24(12):245-252.

