DNS法檢測灰略紅鏈霉菌JSD1產纖維素酶的CMC酶活條件的優化
羅艷青,張 丹,馮海瑋,柴曉彤,支月娥,周 培
(上海交通大學農業與生物學院,上海交通大學陸伯勛食品安全研究中心,農業部都市農業(南方)重點實驗室,上海 200240)
羅艷青,張 丹,馮海瑋,柴曉彤,支月娥*,周 培
(上海交通大學農業與生物學院,上海交通大學陸伯勛食品安全研究中心,農業部都市農業(南方)重點實驗室,上海 200240)
為研究3,5-二硝基水揚酸法(DNS)檢測纖維素酶的CMC酶活條件,采用單因素實驗探討了波長、酶促反應溫度與時間、pH、粗酶液和底物添加量、底物濃度、顯色時間及空白實驗對測定結果的影響,并通過響應面(Box-Behnken)實驗設計及方差分析確定了一種較優的CMC酶活檢測條件組合。結果表明,CMC酶活檢測最佳條件為:波長520nm、酶促反應溫度和時間分別為45℃和30min、pH7.0、底物濃度12g/L、顯色15min。
3,5-二硝基水揚酸法,響應面,CMC酶活檢測條件
纖維素(Cellulose)是地球上最豐富的可再生生物高聚物[1],這類物質大多以秸稈的形式存在,占植物秸稈干質量的 40%至50%,通常難以被降解,人類對其合理開發利用極其有限[2-3]。目前公認最合理的途徑是纖維素的酶學降解,水解此類生物聚合物,酶活測定是不可或缺的部分[4-5]。纖維素酶是一組能夠將纖維素降解成較小糖成分(葡萄糖單元)的酶系的總稱,CMC酶活力主要代表外切β-1,4葡萄糖苷酶和內切酶的活力總和,在研究中常作為纖維素酶活性的判斷依據。不同來源的纖維素酶組分及其活性存在差異,對底物的作用方式也比較復雜,致使纖維素酶活力的測定方法多樣化[6-7],造成同一體系用不同方法或者同一方法在不同條件下測定的結果都會有很大的差異。因此,必須選擇適宜的測定方法與條件,提高測定結果的準確性與重復性。
3,5-二硝基水揚酸(DNS)比色法具有操作簡便、快速、精確等優點,在國內外被廣泛采用。Miller GL等[8]和Tasun K等[9]較早的利用DNS法檢測還原糖,Goksyr J等[10]進一步證明了利用DNS法檢測纖維素酶活的靈敏性以及方法的可靠性。王琳等[11]和孫盈等[12]都對DNS法檢測定纖維素酶活的最適條件進行了探討,鄒水洋等[13]則探討了DNS法測定CMC酶活的空白實驗對檢測結果的影響。但以上方法得出的結論不適用于本實驗室篩選分離的灰略紅鏈霉菌JSD-1[14-15]產CMC酶活力的研究。因此,本文利用單因素法和響應面實驗系統分析DNS檢測條件,提出了一種最適于JSD-1產CMC酶活的檢測方案,為合理的開發利用高產纖維素酶菌株奠定基礎。
1 材料與方法
1.1 材料與儀器
菌種:灰略紅鏈霉菌(Streptomycesgriseorubens),編號為CGMCC No. 5706,由本實驗室分離并保藏。
試劑:羧甲基纖維素鈉(CMC-Na)、3,5-二硝基水楊酸、酒石酸鉀鈉、苯酚、葡萄糖等 均購自生工生物工程(上海)股份有限公司。
儀器:多功能酶標儀 M200 PRO 瑞士TECAN;雙層真彩觸摸屏搖床ZWYR-2112B 上海智誠分析儀器制造有限公司;離心機 CT14RD 天美(中國)科學儀器有限公司。
1.2 培養基及菌種培養條件
固體培養基:CMC-Na 10.0g,K2HPO41.0g,MgSO4·7H2O 0.1g,FeSO4·7H2O 0.1g,MnSO41.0×10-4g,蛋白胨10.0g,酵母膏5.0g,瓊脂粉15~20g,pH7.2~7.4[16]。
CMC發酵培養基:CMC-Na 10.0g,蛋白胨5.0g,酵母膏1.0g,蒸餾水1000mL,pH7.2~7.4。
培養條件:將灰略紅鏈霉菌(JSD-1)于固體培養基培養3~4d,活化后移一環至滅菌的CMC發酵培養液中,發酵液量為500mL的錐形瓶中裝80mL,于32℃,200r/min搖床培養4~5d。
1.3 測定方法
1.3.1 粗酶液的制備 將培養后發酵液于4℃下,8000r/min離心5min,通過0.22μm的一次性針頭過濾器收集所得的液體即為粗酶液。
1.3.2 纖維素酶活測定方法 采用DNS法[8,17],以羧甲基纖維素鈉(CMC-Na)為底物,取粗酶液0.5mL,加入含0.5%CMC-Na、pH為4.8的檸檬酸緩沖液1.5mL,50℃恒溫水浴30min,加入DNS 1.5mL沸水浴顯色5min,迅速冷卻定容至20mL,搖勻后用多功能酶標儀在特定波長下測定CMC酶活。CMC酶活單位為每分鐘每毫升酶液催化纖維素水解生成1.0μg葡萄糖所需的酶量為一個酶活力單位U,即1U/mL。
DNS試劑配制參照高培基方法[18],稍作改進:取酒石酸鉀鈉91g,溶于500mL蒸餾水中,加熱至50℃溶解,再依次加入3,5-二硝基水楊酸3.5g、NaOH 20g、苯酚2.5g、無水亞硫酸鈉2.5g,攪拌至完全溶解,冷卻后用蒸餾水定容至1L,儲于棕色瓶中,放置1周后使用。
1.3.3 葡萄糖標準曲線的繪制 將葡萄糖在80℃恒溫干燥烘干至恒重,精確稱取0.10g完全溶解于100mL蒸餾水中,具體操作見表1。以葡萄糖含量(mg/mL)為橫坐標,以對應的吸光度OD值為縱坐標,繪制葡萄糖標準曲線。

表1 葡萄糖標準曲線的繪制Table 1 Drawing of glucose standard curve
備注:沸水浴中顯色5min,冷卻定容至20mL,520nm處測定OD值。
1.4 CMC酶活力測定條件
掃描葡萄糖標準液在波長(480、490、500、510、520、530、540、550、560nm);固定波長設置酶促反應溫度(30、35、40、45、50、55、60℃)和酶促反應時間(5、10、20、30、40、50、60min)共49種組合;固定波長、酶促溫度和時間,設置兩種不同pH的緩沖體系:濃度為0.05mol/L的檸檬酸緩沖液體系(pH=4.0、4.4、4.8、5.2、5.8、6.2、6.6)和濃度為0.1mol/L的磷酸緩沖液體系(pH=5.8、6.6、7.0、7.5、8.0);在波長、酶促溫度和時間、緩沖液體系確定后將底物濃度(3、5、8、10、12、15、20g/L)與粗酶和底物添加量(0.5+1.5mL、1+3mL、1+2mL、1+1mL、2+2mL)結合設計共35種組合;固定優化后的酶活條件,設置顯色時間(3、5、8、10、12、15、20min),測定各單因素和組合實驗對CMC酶活力的影響,每一實驗設3個重復。
1.5 空白實驗處理
條件設定具體方案見表2。

表2 空白實驗處理條件的設定Table 2 Set of processing conditions for blank test
1.6 Box-Behnken實驗設計
基于上述單因素及組合實驗結果,研究溫度、pH、反應時間、底物濃度、顯色時間五因素對酶活測定結果的影響,實驗設計見表3。

表3 響應面因素水平表Table 3 Factors and levels in RSA
1.7 數據分析方法
采用Statistica 8.0軟件,Experimental Design模塊中的3**(k-p)與 Box-Behnken Design對實驗數據進行回歸擬合,結合SAS軟件對數據進行方差分析,利用OriginPro 8.0軟件作圖。
2 結果與討論
2.1 波長對CMC酶活力的影響
由圖1可知,OD值在480nm處有最大吸光值,并隨著波長的增加逐漸減小,標準曲線的斜率也逐漸降低,不同濃度的標準品在同一波長下測定值的波動范圍也隨之縮小,這種變化趨勢可能與DNS顯色液本身在較低波長下有較高的吸光值有關。此外,隨著葡萄糖濃度的增加,不同波長檢測條件下的OD值差異逐漸增大。結合表4分析可知,還原糖在480nm 處的R2最小(R2=0.9921),吸光值在此波長下穩定度偏低,線性較差,隨著波長的增大吸光值的線性回歸系數逐漸上升且在520nm 處有最高值(R2=0.99933)。由于是同一批樣品在不同波長下掃描的結果值,單個波長下的R2大小可以排除人為操作誤差。實驗過程中共掃描了3次,平行組間差異較小,文章中呈現的是三組平行的平均值,基本可以排除系統誤差。綜合線性變化規律和回歸系數可得,最適測定波長為520nm,這一結論與文獻[19]報道的結果基本一致。

圖1 系列葡萄糖標準品與DNS顯色后 在不同波長下的OD值Fig.1 OD values under different wavelength of a series of glucose standards colorized by DNS

波長/nm斜率(Slope)截距(Intercept)葡萄糖標準曲線的R2480048270249309921490045680145909961500041480086809972510035830059609980520031430051009993530027280048709978540023350048009967550020470044209957560017550044109939
2.2 酶促反應溫度和時間對CMC酶活力的影響
酶促反應溫度和時間對CMC酶活力的影響見圖2,不同時間段的溫度與酶活的趨勢呈鐘罩型曲線狀,5~20min 時CMC酶活在50℃ 出現最高值,30~60min 酶活最高點在45℃ 出現,其中酶促反應30min、45℃出現最大值23.979U/mL。分析其原因:一方面酶活力隨著溫度的升高而增大,由于酶是蛋白質,當溫度偏高時造成部分酶蛋白逐漸變性而失活,從而引起酶反應速率下降;另一方面,酶活力的表達速率隨時間的延長而增大,達到一定時間點后其速率增長曲線逐漸平穩并且下降,這主要是因為隨著反應進行,底物濃度降低,產物濃度增加,逆反應從無到有逐漸變得顯著,所以酶促反應時間以30min為最適。綜合以上分析,檢測酶活力最佳反應溫度和時間分別為45℃、30min。
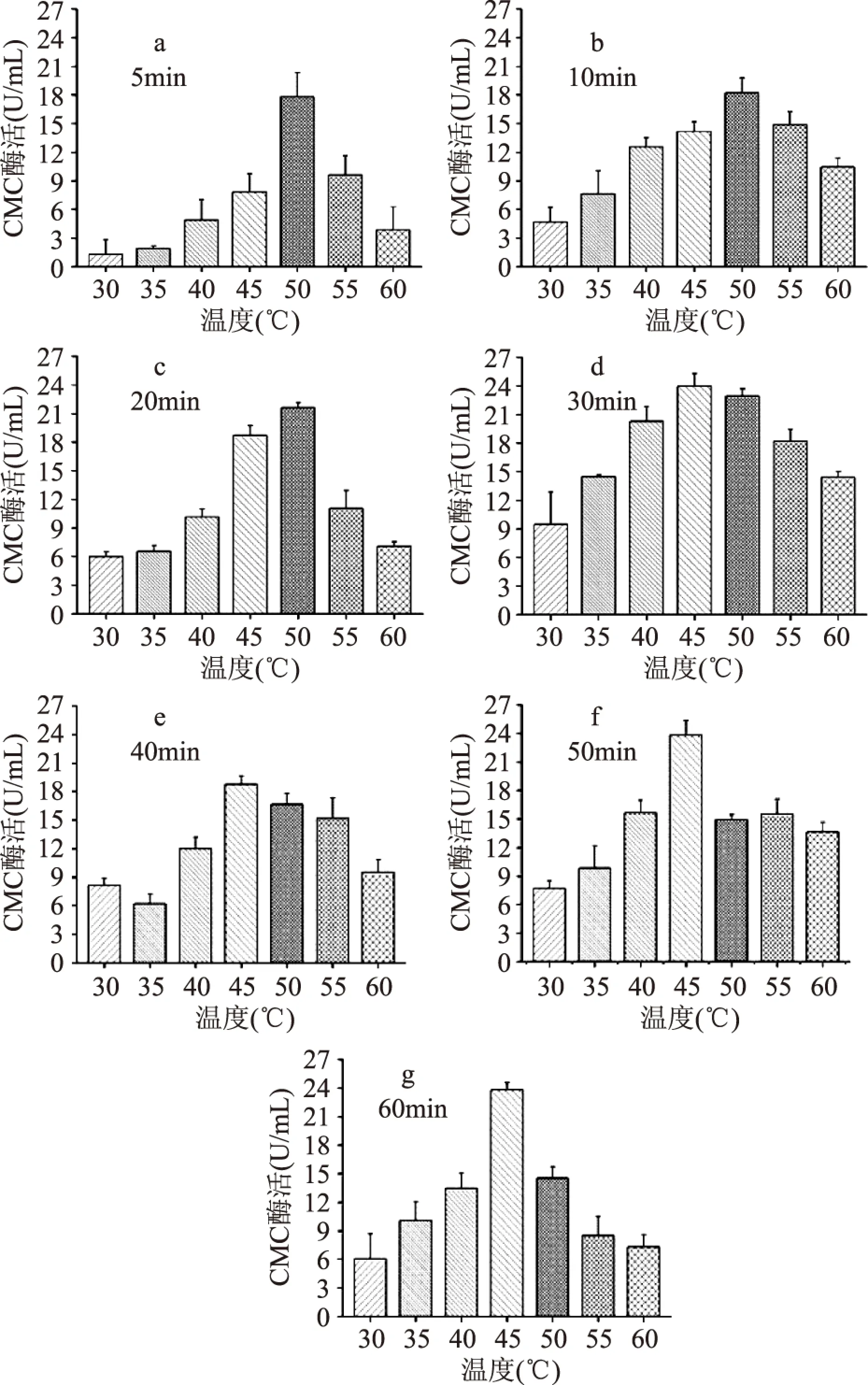
圖2 酶促反應時間在不同的溫度下對CMC酶活的影響Fig.2 Effect of enzymatic reaction time under different temperature on the determination of CMCase activity
2.3 pH和緩沖液對CMC酶活力的影響
pH對酶活力的影響極為顯著,在一定pH的適宜緩沖體系下,酶表現出最大活力,高于或低于此pH,酶活力降低[20]。目前,對于本株灰略紅鏈霉菌的酶學性質尚未有研究報道,在兩種緩沖體系下測定的結果如圖3所示。

圖3 不同緩沖體系的系列pH測定纖維素酶活OD值Fig.3 OD values of cellulose enzyme activity under different buffer systems of a series of pH
從圖3可以看出,菌株JSD-1所表達的纖維素酶活力在磷酸緩沖液體系中較高,其中pH為7.0 時測定的酶活力最高,且測定值的平行組之間差異相對較小,高于或低于此條件下測出的酶活力都較低。究其原因可能有兩點:不同緩沖體系所含離子對纖維素酶的激活或抑制不同;同一緩沖體系中,不同pH的狀態下其底物和分子的帶電狀態不同,酶的活性部位及底物的解離狀態也不同,當酶反應處于最適pH時,酶分子上的活性基團的解離狀態最易與底物結合,故在pH7.0的條件下,酶反應速率最高,其他條件下的活性基團解離狀態不同程度的發生改變,酶和底物的結合力降低,因而酶反應速度降低。
2.4 底物濃度以及粗酶液和底物添加量對CMC酶活力的影響
根據酶反應動力學原理及參考文獻[21-23],同時研究底物濃度以及粗酶液和底物添加量這三個因子的交互作用對酶活力測定的影響,結果如圖4所示。
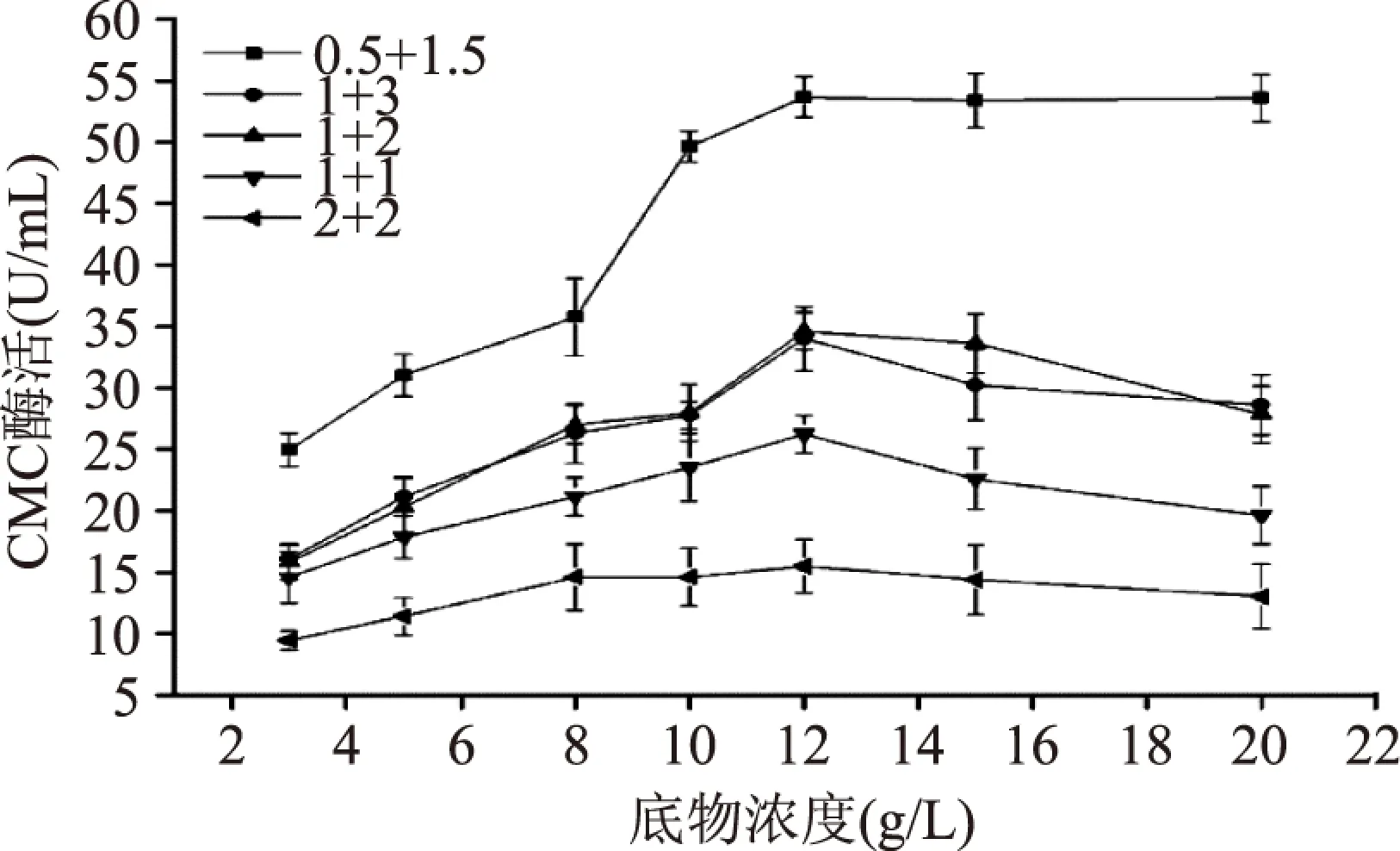
圖4 底物濃度以及粗酶量 和底物添加量對CMC酶活的影響Fig.4 The influences on CMCase activity of substrate concentration as well as solvent amount of crude enzyme and substrate
從圖4可以看出,纖維素酶活力隨著底物濃度的增加而增大,當底物濃度達到12g/L時,酶活表達量達到最大,酶活趨于極限值,底物濃度超過該飽和濃度后酶活反應速率趨于平穩并緩慢下降。原因是底物CMC濃度較低時,酶活反應速率與底物濃度成正相關;當底物濃度恰好被酶所飽和時反應速率達到最大,此后再增加底物濃度酶活力不但不會增加反而會慢慢下降,這是由于高濃度條件下CMC 溶解性較差,反應速率在一定程度上被阻遏,且實驗結果的準確性和重復性也較差。
圖4還表明粗酶液和底物添加量對酶活測定結果影響顯著,可以看出當粗酶液和底物添加量比例為1∶3時酶活力反應速率較高,其中當粗酶液和底物添加量的組合為0.5+1.5mL 時所測得的纖維素酶活力均比其他組合高,當底物濃度為12g/L時其所測的酶活值最高,說明該組合在整個體系反應中飽和率較高。因此,綜合分析,酶活檢測體系的最適底物濃度為12g/L,最適粗酶液和底物添加量分別為0.5mL和1.5mL。
2.5 DNS顯色時間對CMC酶活力的影響
由圖5可知,顯色時間為1~5min 時,顯色反應速率增長較快,在5~12min CMC酶活值基本保持平穩,12min 后反應速率再次上升,并在15min 時出現最大值,比平穩期的平均值提高了14.75%,且其數值穩定性和重復性較高,15min 后呈緩慢下降趨勢,這與文獻[24]測得的顯色時間超過5min 后基本趨于穩定的說法不一致。可能是由于不同來源的纖維素酶酶活不同,產生的還原糖量也不同。因此,采用最高測量值的還原糖標準液來確定顯色時間,即顯色15min。

圖5 系列顯色時間對CMC酶活力的影響Fig.5 Influence on CMCase activity of a series of coloration time
2.6 空白(對照)實驗對CMC 酶活測定的影響
國際理論和應用化學協會(IU PAC)對纖維素酶酶活測定中的空白實驗沒有做明確的規定,根據實際測定中選擇不同處理方法,這就使得同一酶樣品的酶活測定值各異[6]。為了最小程度的降低人為因素造成的誤差和提高酶活測定值的可比性,本實驗設計了六個不同的空白處理,具體實驗設計和結果見圖6。
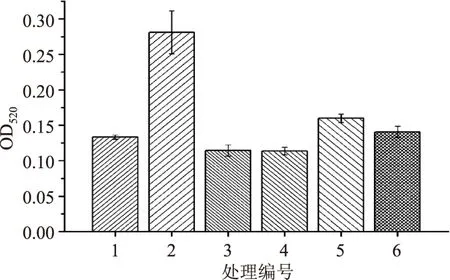
圖6 不同空白處理對酶活吸光值的影響Fig.6 Effects on absorbance values of enzyme activity with different blank treatments
由結果可知,JSD-1所產CMC酶活耐高溫,100℃處理15min難以將其徹底滅活。處理3和處理4酶活樣本滅活比較徹底,且樣本誤差也較低,但處理4的設計更為合理。空白以底物作為對照,可消除酶活測定的系統誤差,其結果更具說服力和代表性。處理2和處理5的空白測定值都偏高,原因是由于酶液和底物混合在緩慢升溫過程中已經發生部分反應,尤其是在滅菌鍋里升溫的時間較長,故酶和底物結合后反應生成較多還原糖。處理5和處理6利用常規的100℃沸水浴滅酶活并不徹底,殘留酶活形成的空白值導致測定結果產生較大的負偏差。
有文獻[13]研究指出總空白等于底物空白與酶液空白吸光度的算術和,依據此算法總和達到0.18左右,比處理3和處理4高出許多。由以上分析可知,將單獨酶液1×105Pa 滅菌的空白處理比較徹底,負偏差<1%,方法操作簡便,結果可靠,故最終確定處理4為空白實驗體系進行纖維素酶酶活力的空白測定。
2.7 響應面設計(Box-Behnken Design)優化CMC酶活測定條件
根據以上單因素實驗結果,選取酶促反應溫度(X1)、pH(X2)、反應時間(X3)、底物濃度(X4)和顯色時間(X5)五個主要影響因素為自變量,以纖維素酶活力為響應指標,采用Box-Behnken方法設計響應面分析實驗,實驗設計及實施結果見表5。
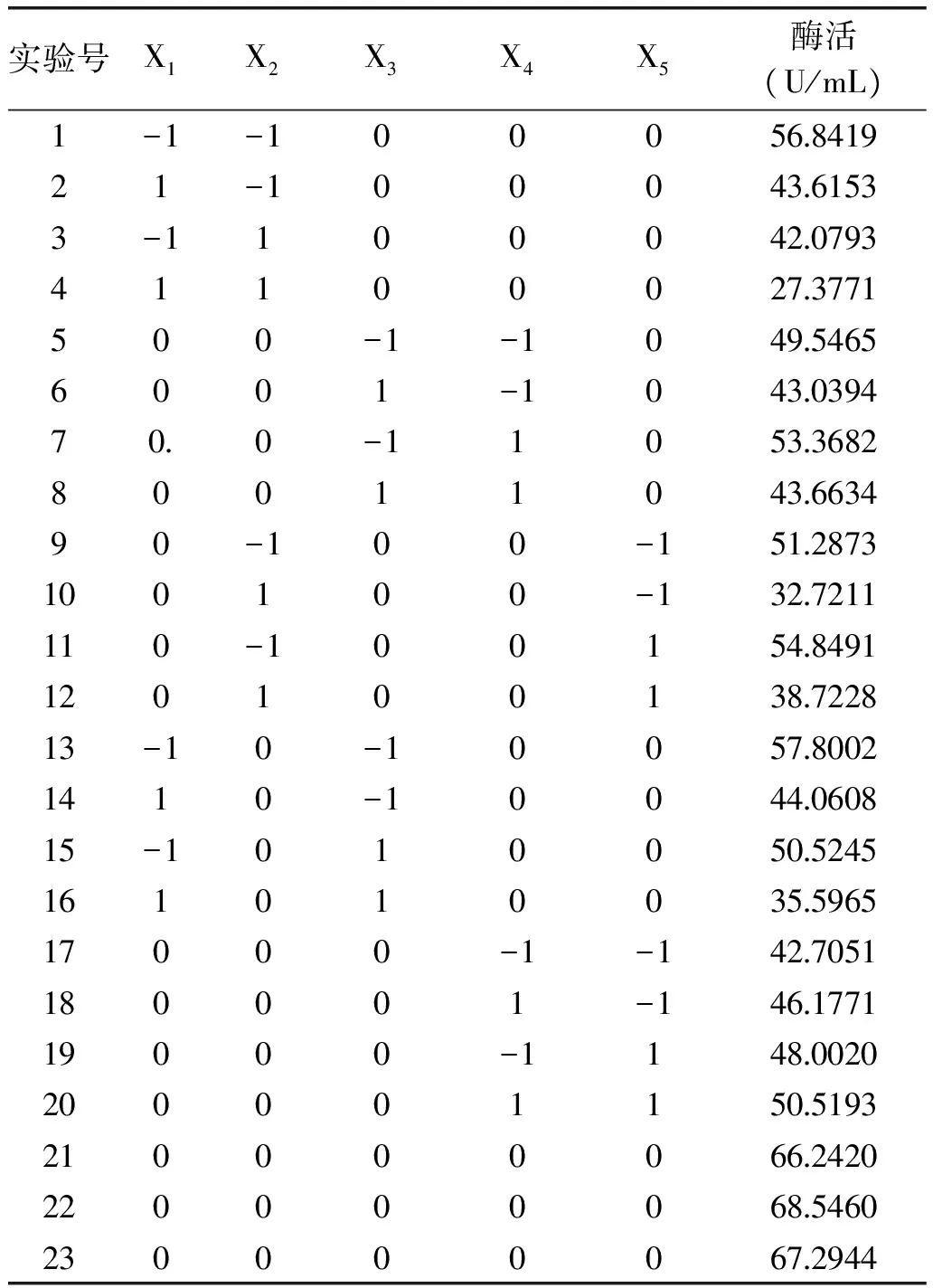
表5 Box-Behnken優化實驗設計與結果Table 5 Optimizationexperimental design and responses of Box-Behnkendesign
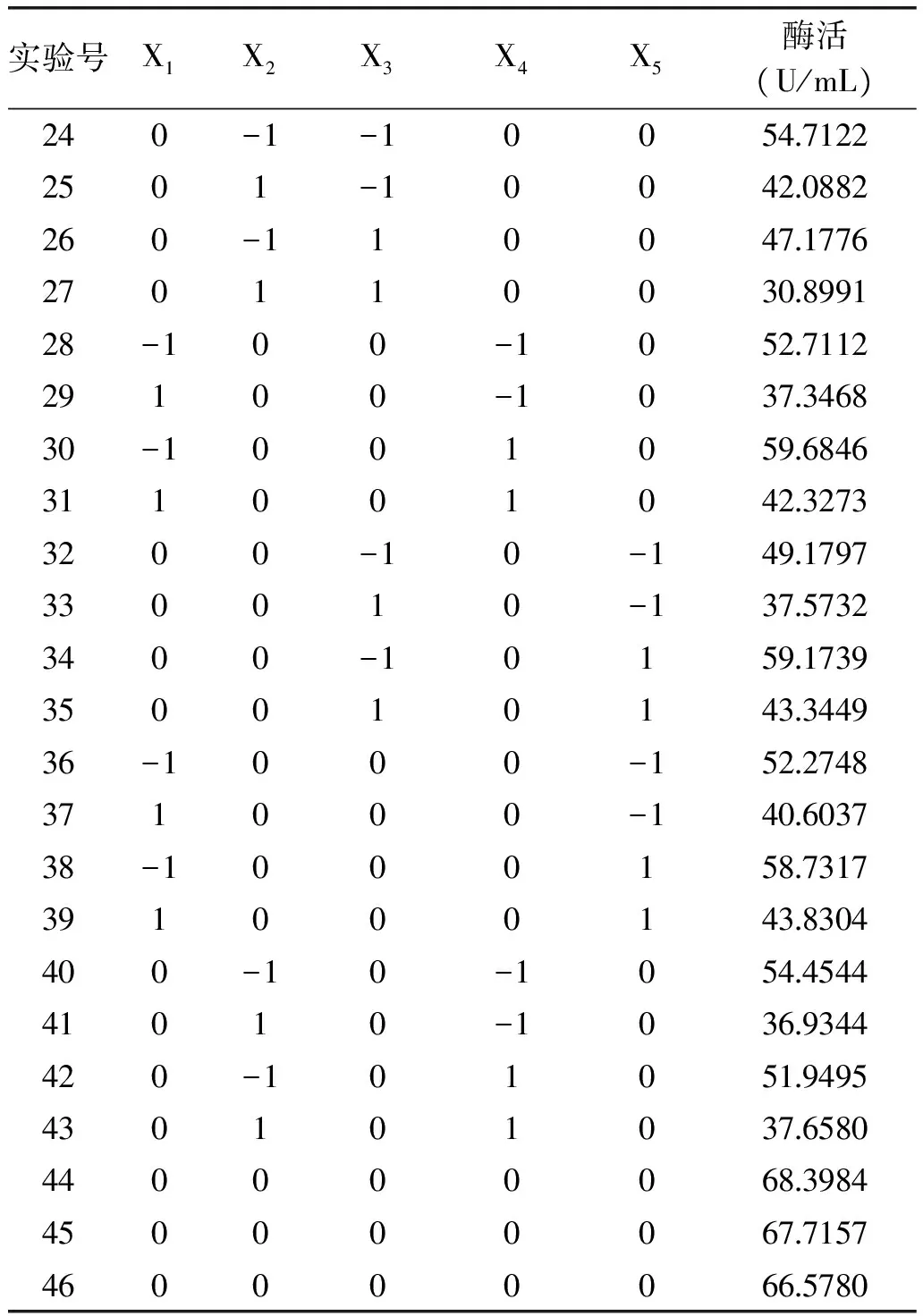
續表
通過采用Statistica 8.0軟件分析得到目標響應值與各因素關系的二階經驗模型(如下式所示):Y=67.46240-7.24316X1-7.90046X2-4.88195X3+1.28797X4+2.79076X5-10.05468X12-13.55794X22-10.35951X32-9.66461X42-9.69721X52,該方程系數極顯著(Pr>F小于0.01),自動剔除差異非極顯著的交叉項。

根據回歸模型預測出CMC酶活檢測的最高值,即當酶促溫度為43℃,pH6.7,酶促時間28min,底物濃度12g/L,顯色時間16min時,預測出CMC酶活的最大值為70.7366U/mL,實際測CMC酶活最大值為68.546U/mL,實際值比預測值誤差為±3.19%,可見該模型較好的預測了實驗結果。
保持其中單一因素最優條件,其他兩個因素與響應值關系用響應面立體圖如圖7所示。
由圖7可知,圖a、b、c、d 交互作用對酶活影響顯著,這與表6中的p值結果一致。
2.8 模型的驗證
為證實預測值與真實值之間的擬合程度,進行3次平行驗證實驗,即在底物濃度為12g/L、pH7.0的磷酸緩沖液、45℃酶促反應30min的條件下,顯色15min后于520nm處檢測CMC酶活,分別為64.985、65.156和66.509U/mL,實驗值略低于模型預測值,實驗值與模型估計值最大相差8.1%,二者非常接近,表明預測值與實驗值有較好的擬合性,進一步驗證了該模型的可信程度。
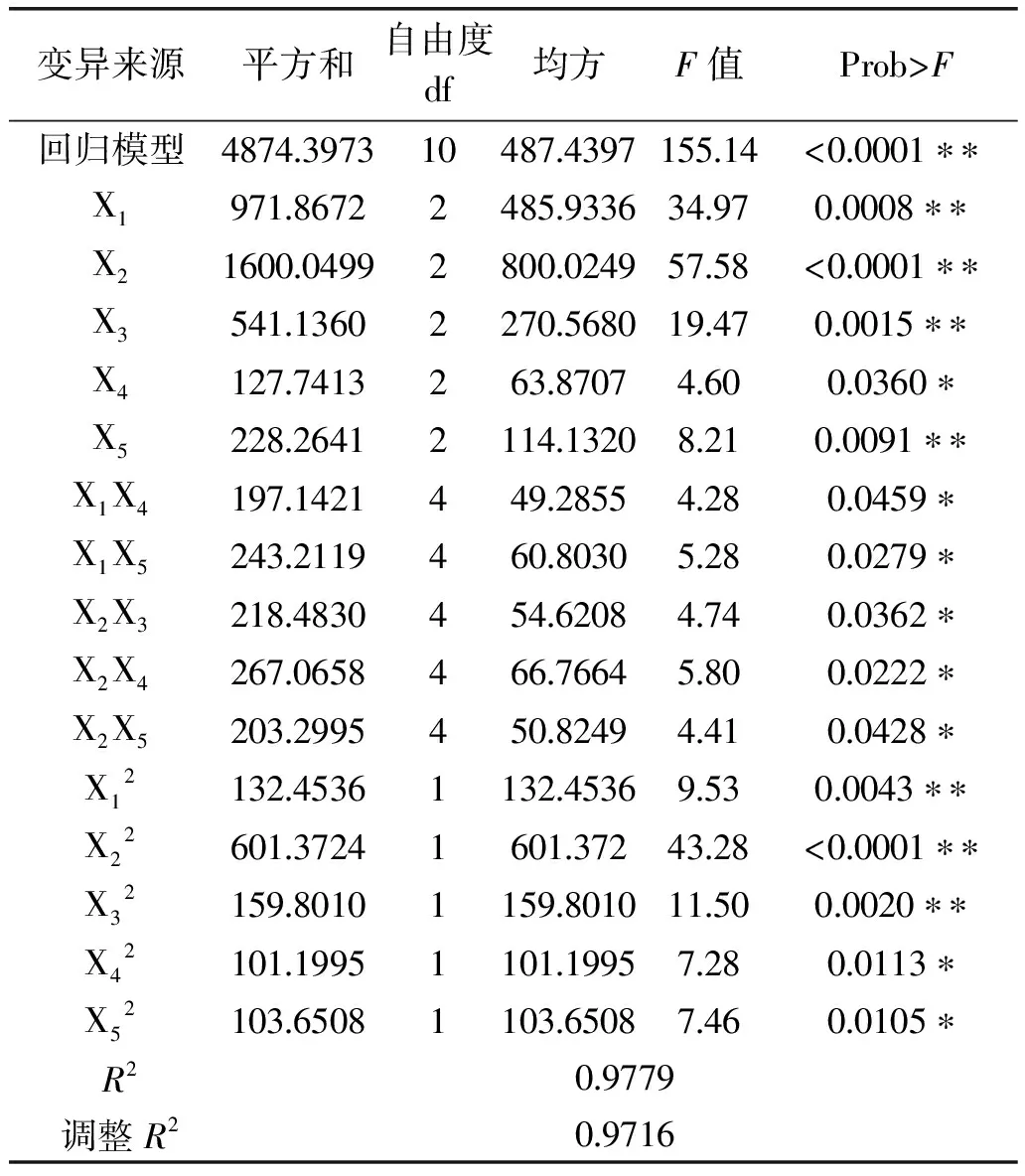
表6 回歸與方差分析結果Table 6 Results of regression and variance analysis
注:*差異顯著,p<0.05;**差異極顯著p<0.01。
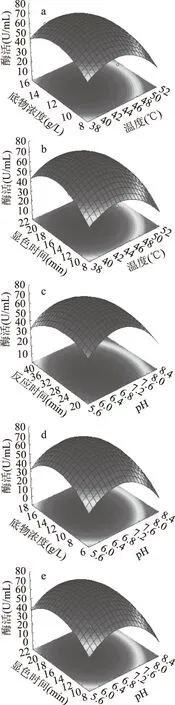
圖7 五個因子交互作用對CMC酶活影響的響應面圖Fig.7 Response surface of effect of interaction of with five factors on CMCase activity注:a:反應溫度和底物濃度交互對CMC酶活的響應; b:溫度和顯色時間交互對CMC酶活的響應; c:pH和反應時間交互對CMC酶活的響應; d:pH和底物濃度交互對CMC酶活的響應; e:pH和顯色時間的交互對CMC酶活的影響。
3 結論
本文通過單因素實驗分析了DNS法檢測條件對CMC酶活的影響,并結合Box-Behnken 的中心組合設計及響應面分析了DNS法中5個主要影響因子及其交互作用對CMC酶活檢測條件的影響。CMC酶活在pH為7.0的磷酸緩沖液、底物濃度為12g/L、45℃酶促反應30min的條件下,顯色15min后于520nm處檢測最適宜。BBD實驗結果顯示五個因子的顯著性大小依次為pH>反應溫度>反應時間>顯色時間>底物濃度,pH、反應時間和溫度對CMC酶活檢測影響較大,在適宜的溫度范圍內(45~55℃),足夠的酶促反應時間可使CMC酶活的表達量較高。因此,在測定不同菌株產纖維素酶活的實驗中需對其酶學性質進行分析,然后在一定pH的緩沖體系中進行測定。此外,空白實驗酶液1×105Pa處理15min滅活作為纖維素酶活最優空白對照組。
[1]Bhat M K,Bhat S. Cellulose degrading enzymes and their potential industrial applications[J]. Biotechnology advances,1997,15(3):583-620.
[2]王建榮,張曼夫. 綠色木霉纖維素酶CBHII 基因的分子克隆[J]. 真菌學,1994,13(3):235-240
[3]Ragauskas AJ,Williams CK,Davison BH,etal.The path forward for biofuels and biomaterials[J].Science,2006,311(5760):484-489.
[4]王驥. 福壽螺多功能纖維素酶EGX的研究[D],上海:中國科學院研究生院:上海生命科學研究院,2004.
[5]Dashtban M,Maki M,Leung K T,etal. Cellulase activities in biomass conversion:measurement methods and comparison[J]. Critical reviews in biotechnology,2010,30(4):302-309.
[6]Ghose T K. Measurement of cellulase activities[J]. Pure and applied Chemistry,1987,59(2):257-268.
[7]Goksyr J,Eriksen J. Microbial Enzymes and Bioconversions(e d.Hose A. H.),London,NewYork,Torouto,Sydney,San Francisco[J]. 1980,5:301~306
[8]Miller GL,Blum R,Glennon WE. Measurement of carboxymethylcellulase activity[J]. Analytical biochemistry 1960;2:127-32.
[9]Tasun K,Chose P,Ghen K. Sugar determination of DNS method[J]. Biotechnology and Bioengineering,1970,12:921.
[10]Breuil C,Saddler J N. Comparison of the 3,5-dinitrosalicylic acid and Nelson-Somogyi methods of assaying for reducing sugars and determining cellulase activity[J]. Enzyme and microbial technology,1985,7(7):327-332.
[11]王琳,劉國生,王林嵩,等. DNS 法測定纖維素酶活力最適條件研究[J]. 河南師范大學學報:自然科學版,1998,26(3):66-69.
[12]孫盈,田永強,趙麗坤. 纖維素酶的 CMC 酶活測定條件的研究[J]. 食品工業科技,2013,34(2):68-71.
[13]鄒水洋,郭祀遠. 空白實驗及測試條件對纖維素酶活測定的影響[J]. 食品工業科技,2010(6):344-346.
[14]馮海瑋,周培,毛亮,等. 一株高效纖維素降解菌的篩選及其產酶條件優化[J]. 上海交通大學學報:農業科學版,2013,31(2):24-29.
[15]Feng H W,Zhi Y E,Shi W W,etal. Isolation,identification and characterization of a straw degrading Streptomyces griseorubens JSD-1[J]. African Journal of Microbiology Research,2013,7(22):2730-2735.
[16]張麗青,吳海龍,姜紅霞,等. 纖維素降解細菌的篩選及其產酶條件優化[J]. 環境科學與管理,2007,10(33):110-113.
[17]趙玉萍. 稻殼對綠色木霉產纖維素酶的影響[J]. 中國糧油學報,2006,21(6):18-21.
[18]高培基. 纖維素酶活力測定方法研究進展[J]. 工業微生物,1985,6(5):5-8.
[19]王俊麗,聶國興,李素貞,等. DNS 法測定還原糖含量時最適波長的確定[J]. 河南農業科學,2010,4(4):115-118.
[20]劉宗林,彭義交,胡阿偉. 一株纖維素酶酶學特性的研究[J]. 食品科學,2003(3):32-35.
[21]B施特馬赫. 酶的測定方法[M].錢嘉淵譯,北京:中國輕工業出版社,1992:103-107.
[22]姜心,陳偉,周波,等. 纖維素酶活測定影響因素的研究[J]. 食品工業科技,2010(5):65-68.
[23]夏服寶,邱雁臨,孫憲迅. 纖維素酶活力測定條件研究[J]. 飼料工業,2006,26(16):23-26.
[24]李蘭曉,杜金華,李軍訓,等. CMC 糖化力法測定纖維素酶活性條件的研究[J]. 飼料工業,2007,27(24):49-52.
Optimization of conditions for CMCase activity of cellulase detected withDNS method forStreptomycesgriseorubens(JSD-1)
LUO Yan-qing,ZHANG Dan,FENG Hai-wei,CHAI Xiao-tong,ZHI Yue-e*,ZHOU Pei
(School of Agriculture and Biology&Bor S. Luh Food Safety Research Center,Shanghai Jiaotong University,Key Laboratory of Urban Agriculture(South),Ministry of Agriculture,Shanghai 200240,China)
In order to study the experimental conditions of 3,5-Dinitrosalicylic acid(DNS)to measure the activity of carboxymethyl cellulase(CMCase),factors including wavelength,enzymatic reaction temperature and time,pH,solvent amount of crude enzyme and substrate,substrate concentration,coloration time and blank experiment were used by a single factor test to explore the influence on the results of CMCase activity. A relatively optimal solution which was applicable to CMCase activity was established by using the method of response surface analysis(RSA)and variance analysis. Results showed that the best conditions for detecting the activity of CMCase was at 520nm wavelength,45℃ and 30min for enzymatic reaction,pH7.0,substrate concentration 12g/L,coloration 15min.
3,5-Dinitrosalicylic acid;response surface;detection conditions for CMCase activity
2014-04-21
羅艷青(1988-),女,碩士研究生,研究方向:農業微生物。
*通訊作者:支月娥(1961-),女,本科,副教授,研究方向:農業微生物。
國家高技術研究發展計劃(863計劃)課題(2012AA101405);公益性行業(農業)科研專項經費項目(200903056);國家自然科學基金 (31071860)。
TS201.3
A
1002-0306(2015)03-0156-07
10.13386/j.issn1002-0306.2015.03.024

