Fe3O4-SiO2載體制備和脂肪酶固定化條件優化
易笑生,胡 鐵,馮 超,谷政偉,黎繼烈,*,李昌珠
(1.經濟林培育與保護省部共建教育部重點實驗室(中南林業科技大學),湖南長沙 410004;2.廣州航海學院,廣東廣州 510725;3.湖南省林業科學院,湖南長沙 410004)
Fe3O4-SiO2載體制備和脂肪酶固定化條件優化
易笑生1,胡 鐵2,馮 超1,谷政偉1,黎繼烈1,*,李昌珠3
(1.經濟林培育與保護省部共建教育部重點實驗室(中南林業科技大學),湖南長沙 410004;2.廣州航海學院,廣東廣州 510725;3.湖南省林業科學院,湖南長沙 410004)
通過共沉淀法和溶膠-凝膠法制備了Fe3O4-SiO2磁性納米粒子,將Fe3O4-SiO2磁性納米粒子表面進行氨基化修飾得到磁性納米復合載體,用掃描電子顯微鏡和傅里葉變換紅外光譜對載體進行了表征。通過考察加酶量、戊二醛濃度,固定化時間和溫度等因素對蛋白固載率和脂肪酶活力的影響,獲得了脂肪酶固定化的最適條件。在0.02g/mL脂肪酶液加入量為8.30mL,戊二醛濃度為8.20%時,在溫度24℃條件下,固定化4h,制備的固定化脂肪酶酶活3449U/g。
磁性納米復合載體,脂肪酶,固定化
脂肪酶包括羧酸酯酶和真脂肪酶[1]。脂肪酶的天然底物是油脂,能水解油脂中脂肪酸和甘油相連接的酯鍵[2],能在油-水界面上催化酯水解、醇解、酯交換、酯合成、內酯合成、高聚物合成、多肽合成及立體異構體拆分等反應[3-4]。由于脂肪酶具備高度底物特異性、位置特異性和立體特異性,是食品與油脂加工良好的生物催化劑[5]。
由于在生產中使用游離酶存在難以分離和利用率低的缺點,酶固定化技術得到了迅速發展。目前用于固定化酶的載體種類很多,磁性載體用于脂肪酶的固定化,具有易于分離和在磁場中定位性好的特點而備受關注[6-8]。但是脂肪酶價格高且穩定性較低,其規模化應用仍然面臨許多問題。磁性納米Fe3O4-SiO2載體是一種價格相對低廉的樹脂載體,能與酶分子表面的氨基(-NH2)、羥基(-OH)或巰基(-SH)形成共價結合使其固定化[9-10]。為了獲得合適的磁性納米Fe3O4-SiO2載體和固定化脂肪酶的最佳工藝條件,本文通過合成Fe3O4-SiO2載體和對其表面改性,探討固定化脂肪酶的優化條件,旨在改善脂肪酶的催化性能和穩定性,降低脂肪使用成本。
1 材料與方法
1.1 材料與儀器
脂肪酶 實驗室分離純化制得,酶活力為1400U/g,配制成0.02g/mL脂肪酶液備用;正硅酸乙酯(TEOS),酒石酸,FeCl3·6H2O,FeSO4·7H2O,乙醇,氨水,γ-氨丙基三乙氧基硅烷(3-APTES),甲苯,丙酮,三羥甲基氨基甲烷(Tris,AR),戊二醛(25%),聚乙烯醇(PVA),95%乙醇等 均為國產分析純。
JEOL-6380LV型掃描電子顯微鏡(scanning electron microscope,SEM) 日本電子公司;330FT-IR型傅里葉變換紅外光譜(Fourier Transform Infrared Spectrometer,FTIR) 美國Nicolet Co。
1.2 載體制備
共沉淀法制備Fe3O4納米粒子:在250mL三口燒瓶中分別加入100mL去離子水、0.01mol FeCl3·6H2O和0.005mol FeSO4·7H2O,在氮氣保護下,升溫至80℃,在轉速500r/s條件下,加入10mL濃氨水溶液,繼續攪拌反應30min后冷卻至室溫,用去離子水洗至中性。將得到的納米粒子分散于50mL水中,加1mL酒石酸作為穩定劑,70℃下攪拌30min,得到Fe3O4納米流體。
溶膠-凝膠法制備Fe3O4-SiO2磁性復合載體:取Fe3O4納米流體10mL,加入含有10mL TEOS、10mL乙醇、10mL水、0.3mL氨水的混合物中,室溫條件下控制轉速500r/s,反應12h。
Fe3O4-SiO2磁性復合載體表面氨基化:在500mL圓底燒瓶中,加入100mL甲苯,3g干燥的磁性Fe3O4-SiO2納米粒,超聲處理10min后,加入10mL 3-APTES,在120℃油浴中連續磁力攪拌4h,甲苯和丙酮各洗滌3次,真空干燥,得到表面經氨基修飾后的磁性Fe3O4-SiO2納米載體。
1.3 脂肪酶的固定化
在50mL錐形瓶中,加入0.05g氨基修飾的磁性Fe3O4-SiO2納米載體,0.2mol/L pH7.5的磷酸鹽緩沖溶液和一定濃度的戊二醛,放入100r/min轉速的搖床,室溫條件下反應12h,用去離子水充分洗滌,得到表面醛基化的磁性載體。在50mL錐形瓶中加入0.05g醛基化載體,10mL pH7.5磷酸鹽緩沖溶液和0.02g/mL脂肪酶液10mL,在設定溫度下,水浴搖床反應一定時間,離心后得固定化脂肪酶。
1.4 載體表征
1.4.1 載體粒徑檢測 用SEM檢測載體的粒徑,按文獻[11]進行樣品處理與測定。
1.4.2 載體表面氨基化程度檢測 用FTIR檢測載體表面氨基化程度,按文獻[11]進行樣品處理與測定。
1.5 蛋白固載率、酶活力及酶活回收率測定
蛋白固載率、酶活力及酶活回收率按文獻[11]測定。
1.6 固定化酶的單因素實驗
1.6.1 加酶量對固定化脂肪酶活力的影響 取濃度5%的戊二醛為交聯劑,25℃下分別取0.02g/mL酶液2、4、6、8、10、12mL固定化4h。
1.6.2 戊二醛濃度對固定化脂肪酶活力的影響 取濃度分別為2%、4%、6%、8%、10%的戊二醛溶液10mL為交聯劑,25℃下加10mL酶液固定化4h。
1.6.3 固定化時間對固定化脂肪酶活力的影響 取濃度為5%的戊二醛為交聯劑,25℃下加入10mL酶液固定不同時間,分別為2、4、6、8、10h。
1.6.4 固定化溫度對固定化脂肪酶活力的影響 取濃度為5%的戊二醛為交聯劑,固定化溫度分別為20、25、30、35、40、45℃時加入10mL酶液固定化4h。
1.7 固定化脂肪酶響應面實驗
為了進一步提高固定化脂肪酶的效果以及對其重要影響因素在全局范圍內進行優化,根據單因素實驗結果選4h為最佳固定化時間,取其余三個因素作為Box-Benhnken 實驗因素設計實驗。
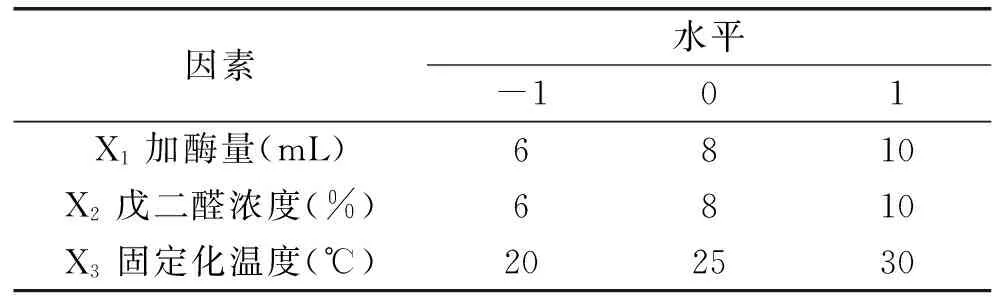
表1 Box-Benhnken 實驗因素及其水平表Table 1 Factors and levels of the variables tested in Box-Benhnken design
2 結果與分析
2.1 載體粒徑分析
通過掃描電鏡觀察Fe3O4-SiO2磁性復合載體的形態和大小。圖1為Fe3O4-SiO2磁性復合載體的SEM照片,載體粒徑較為均一,呈球狀,各載體間分散性良好,載體平均粒徑為300nm左右。

圖1 磁性Fe3O4-SiO2復合載體SEM圖Fig.1 SEM graph of compound magnetic Fe3O4-SiO2 carriers
2.2 載體表面氨基化程度分析
在FTIR下測定干燥的氨基化磁性復合Fe3O4-SiO2載體與未氨基化磁性復合Fe3O4-SiO2載體的各基團的特征吸收峰。對該圖譜進行紅外圖譜[12]分析,可知-NH:1579cm-1,-NH彎曲振動;Si-O-R,1100cm-1,伸縮振動。所以說明SiO2已包覆到Fe3O4上,-NH鍵吸收峰說明氨基已加至載體表面,磁性復合載體表面氨基化良好。

圖2 氨基化載體和未氨基化載體FTIR圖Fig.2 Infrared spectrogram of silanized magnetic silica and magnetic silica
2.3 固定化酶的單因素實驗
2.3.1 加酶量對固定化脂肪酶活力的影響 隨加酶量增加,蛋白固載率也增加,但當加酶量達到10mL后,蛋白固載率維持不變。酶活回收率在加酶量達到8mL時達到最大值。說明雖然蛋白固載率增加,但酶活并沒有隨其明顯增加。這是因為載體可固定的酶量是有限的。當加酶量濃度較低時,隨著酶液濃度的增加,固定到載體上的酶量增加,活性也相應提高,但當酶液濃度過高時,酶分子相互聚集成團致使酶分子的活性中心互相遮蓋,影響了酶與底物的結合,使酶活降低。

圖3 加酶量對固定化脂肪酶活力的影響Fig.3 Effect of the amount of lipase enzyme on activity of immobilized lipase
2.3.2 戊二醛濃度對固定化脂肪酶活力的影響 戊二醛濃度升高蛋白固載率和酶活回收率均升高,在戊二醛濃度8%時蛋白固載率和酶活回收率均達到最大值,但隨戊二醛濃度的進一步升高,蛋白固載率與酶活回收率均降低,說明過高濃度的戊二醛使部分酶蛋白失活。
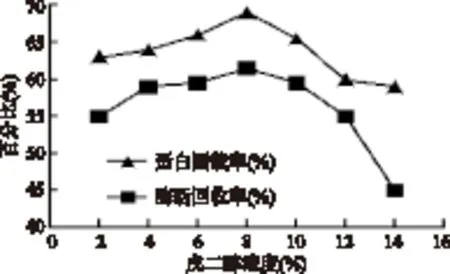
圖4 戊二醛濃度對固定化脂肪酶活力的影響Fig.4 Effect of glutaraldehyde concentration on activity of immobilized lipase
2.3.3 固定化時間對固定化脂肪酶活力的影響 隨固定化時間增加,蛋白固載率和酶活回收率都在4h后達到一個穩定值,繼續延長固定化時間對增加酶活力影響不大,故后續實驗中固定化時間取4h。
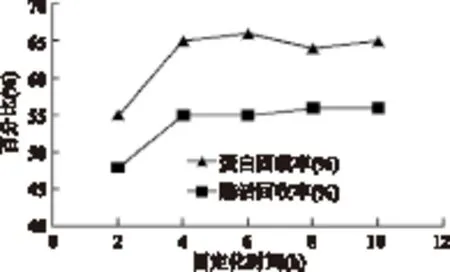
圖5 固定化時間對固定化脂肪酶活力的影響Fig.5 Effect of the immobilized time on activity of immobilized lipase
2.3.4 固定化溫度對固定化脂肪酶活力的影響 隨固定化溫度的升高,蛋白固載率與酶活回收率也升高,在25℃時,酶活回收率達到最大值,隨溫度升高,蛋白固載率在較小的范圍內變動,但酶活回收率降低,說明該酶對溫度比較敏感,雖然酶固定到了載體上,但有部分酶失活。
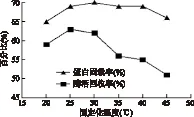
圖6 固定化溫度對固定化脂肪酶活力的影響Fig.6 Effect of the immobilized temperature on activity of immobilized lipase
2.4 固定化脂肪酶響應面實驗
2.4.1 Box-Benhnken實驗 Box-Benhnken實驗設計及結果如表2所示。

表2 Box-Benhnken 實驗設計及結果Table 2 Experimental design and results of Box-Benhnken design
2.4.2 方差分析及二次回歸擬合 對表2的數據進行二次多項回歸擬合,建立二次響應面回歸模型,各因素經回歸擬合后,解得回歸方程為:
Y=3430.97+57.01X1+19.81X2-17.93X3+47.55X1X2+31.07X1X3-20.67X2X3-183.12X1X1-142.27X2X2-34.84X3X3
式中,Y為固定化酶活力,U/g;X1為加酶量,mL;X2為戊二醛濃度,%;X3為固定化溫度,℃。
全模型的方差分析及顯著性檢驗結果如表2所示,模型F值為13.23,整體模型的概率(Pr>F)值<0.01,表明該二次方程模型極顯著,失擬項p=0.827>0.05,差異為不顯著,說明模型擬合度好,實驗誤差較小,可以較好地預測固定化脂肪酶活力隨各參數變化的規律。同時可以看出X1達到顯著水平(Pr<0.05),X12和X22達到極顯著水平(Pr<0.01)。通過方差分析結果可知,各因素影響固定化脂肪酶的酶活大小依次是加酶量(X1)>戊二醇濃度(X2)>固定化溫度(X3)。

表3 全模型方差分析Table 3 ANOVA(Analysis of Variables)for master model
2.4.3 最佳條件的取得及實驗驗證 為了求得 X1、X2和X3的最佳取值,對所得的回歸擬合方程分別對各自的變量求一階偏導數,并令其為0,得到三元一次方程組,求解此方程組可以得出模型的極值點:X1=0.15,X2=0.10,X3=-0.22;即加酶量為8.30mL(酶量166mg)、戊二醛濃度為8.20%、固定化溫度為24℃時,固定化脂肪酶的酶活達到最大值3440.64U/g。在確定的最優條件下進行重復的5次驗證實驗,固定脂肪酶的平均酶活為(3449±1.55)U/g,與模型預測值相差為0.28%,說明所建立的模型與實驗結果相符,此時蛋白固載量為79.21%,酶活回收率為72.46%。
利用design-expert 8.0軟件進行響應面分析,繪出各因素交互作用對酶活影響的響應面分析圖和等高線如圖7所示,每個響應面分析圖分別代表著兩個獨立變量之間的相互作用,此時第三個變量保持在最佳水平。由響應面分析圖可知響應變量Y有最大值,即X1、X2和X3存在極值點。
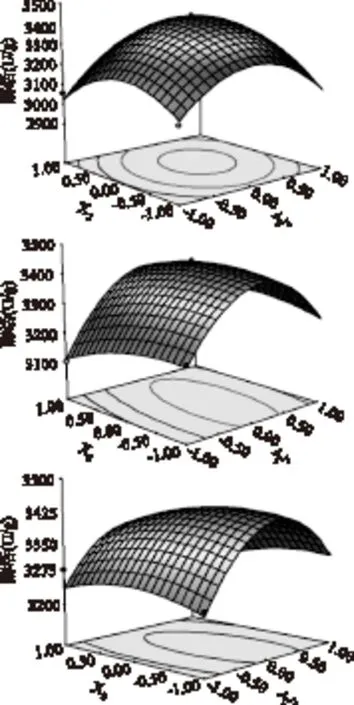
圖7 各因素交互作用對酶活影響的 響應面分析圖和等高線圖Fig.7 Coutour map and reponse surface analysis graph about the influence of the interaction of various factors on enzyme activity
3 結論與討論
制備的Fe3O4-SiO2磁性復合載體粒徑較為均一,呈球狀,分散性良好,載體平均粒徑為300nm左右。
Fe3O4-SiO2載體固定化脂肪酶的最優條件:脂肪酶∶載體(g/g)=166∶50,戊二醛濃度8.20%,溫度24℃條件下,固定化4h,固定化脂肪酶平均酶活3449U/g。
用磁性納米Fe3O4-SiO2納米粒子作為固定化脂肪酶的載體,有利于固定化脂肪酶從反應體系中分離和回收,操作簡便;利用外部磁場可以控制磁性材料固定化酶的運動方式和方向,替代傳統的機械攪拌方式,可減少酶活損失,從而提高固定化酶的使用效率。
[1]Ruiz C,Falcocchio S,Pastor F IJ,etal. Helicobacter pyloti EstV:Identification,cloning,and characterization of the first lipase isolated from anepsilonp rote bacterium[J]. Applied and Environmental Microbiology,2007,73(8):2423-2431.
[2]陳秀琳.脂肪酶固定化的研究概況[J].海峽藥學,2007,19(12):114-116.
[3]Jascanu V,Stefoane D. Comparative effects ofinfluence of lipase,lipoxygenase and provaflor on the rheological characteristics of flour[J]. Acta Universitatis Cibiniensis Series E:Food Technology,2005,6(2):11-20.
[4]曹茜,馮鳳琴.微生物脂肪酶的研究進展及其在食品中的應用[J].中國食品學報,2013(10):141-144.
[5]Hasan F,Shah AA,Hameed A. Industrial applications of microbial lipase[J]. Enzyme and Microbial Technology,2006,9:235-251.
[6]Deng Yonghui,Deng Chunhui,Deng Dawei,etal. Synthesis of Core/Shell Colloidal Magnetic ZeoliteMicrospheres for the Immobilization of Trypsin[J].Advanced Materials,2009,21:1337-1382.
[7]任廣智,李振華,何炳林.磁性高分子微球用于固定化酶的研究進展[J].離子交換與吸附,2000,16(1):83-87.
[8]黃朋,向育君,周建紅,等.磁性高分子微球合成及其固定化脂肪酶的研究[J].湖南科技大學學報:自然科學版,2008,23(4):94-98.
[9]王燕佳,蔣惠亮,方銀軍,等.磁性聚丙烯酰胺-丙烯酸共聚納米粒子固定脂肪酶的研究[J].應用化工,2008,37(5):491-494.
[10]肖志紅,吳紅,李昌珠,等.磁性多孔微球固定化假絲酵母脂肪酶的研究[J].中國糧油學報,2013,28(12):68-73.
[11]馮超.磁性納米載體的制備及其固定化脂肪酶催化性能研究[D].長沙:中南林業科技大學,2012.
[12]陳集,饒小桐,蔣曉慧.波譜分析[M].北京:電子科技大學出版社,2003,78.
Preparation for Fe3O4-SiO2carrier and optimization of the conditions for lipase immobilized
YI Xiao-sheng1,HU Tie2,FENG chao1,GU zheng-wei1,LI Ji-lie1,*,LI Chang-zhu3
(1.Key Laboratory of Cultivation and Protection for Non-Wood Forest Trees(Central South University of Forestry and Technology),Ministry of Education,Changsha 410004,China;2.Guangzhou Maritime Institute,Guangzhou 510725,China;3.Hunan Academy of Forestry,Changsha 410004,China)
Through co-precipitation and sol-gel method,the Fe3O4-SiO2nanoparticles was prepared. The surface of Fe3O4-SiO2magnetic nanoparticles was modified with amino. Finally,the magnetic nano-composite carrier was obtained. The surface features of the carrier by Scanning electron microscope and Fourier Transform Infrared Spectrometer was described. Through the investigation of the effect of amount of enzyme,concentration of glutaraldehyde,immobilization time and temperature on protein solid load rate and lipase activity,the optimum conditions of lipase immobilization was obtained. Under the condition of the amount of lipase solution(0.02g/mL)was 8.30mL,the concentration of glutaraldehyde was 8.20%,the temperature was 24℃ and the immobilization time was 4h,the obtained immobilized lipase enzyme activity was 3449U/g.
magnetic nanometer composite carrier;Lipase;immobilization
2014-04-02
易笑生(1991-),男,碩士研究生,研究方向:農產品生物加工。
*通訊作者:黎繼烈(1959-),女,博士,教授,研究方向:農產品生物加工。
國家科技支撐計劃項目(2011BAD22B04)。
TS201.1
B
1002-0306(2015)01-0235-05
10.13386/j.issn1002-0306.2015.01.040

