黃連中阿魏酸對小檗堿在HepG2細胞中降糖活性的影響
陳紅英,李學剛,葉小利,徐建蓉
(1.西南科技大學生命科學與工程學院,四川綿陽 621010;2. 西南大學藥學院黃連研究開發中心,重慶 400715)
黃連中阿魏酸對小檗堿在HepG2細胞中降糖活性的影響
陳紅英1,李學剛2,葉小利2,徐建蓉1
(1.西南科技大學生命科學與工程學院,四川綿陽 621010;2. 西南大學藥學院黃連研究開發中心,重慶 400715)
為了考察黃連中酸性成分對小檗堿降糖作用的影響,用柱層析法分離鑒定酸性成分,以HepG2細胞建立高糖細胞模型,用MTT法測定細胞的生長,細胞消耗的葡萄糖用試劑盒檢測。結果從酸性組分中分離出阿魏酸,其結構經光譜與色譜確證。阿魏酸在高效液相色譜圖中有明顯的信號,與小檗堿在黃連浸膏中的質量比約為32∶1。細胞實驗中,含小檗堿的培養液中加入阿魏酸后,細胞存活率和細胞消耗的葡萄糖明顯增加;在含36mg/L小檗堿的培養液中加入64mg/L阿魏酸,可使細胞的存活率上升到69%,細胞消耗的葡萄糖增加29.4%。此結果說明黃連中酸性成分阿魏酸能促進小檗堿處理的HepG2細胞對葡萄糖的吸收生長,并降低小檗堿對HepG2細胞的毒性,顯示一定的協同增效作用。
黃連,阿魏酸,小檗堿,HepG2細胞,協同增效
黃連(CoptischinensisFranch.)為中國常見的一種中藥材,其化學成分有異喹啉生物堿小檗堿、黃連堿、巴馬汀、藥根堿及部分酸性成分阿魏酸、綠原酸等,其中小檗堿為主要化學成分,含量約10%[1]。黃連有降糖作用,在古今很多中藥降糖方劑均含有黃連[2-3]。普遍認為,黃連降糖活性成分為小檗堿[4]。但有報道黃連浸膏或水煎液的降糖活性高于同等劑量的小檗堿[5]。事實上,黃連降糖方劑在臨床上也多以煎煮的方式用藥。在此過程中,除小檗堿外,其它成分也會溶出,其中部分酸性成分阿魏酸和綠原酸也有降糖作用的報道[6]。在臨床中藥的配伍中,對藥是中醫經常使用的藥物,有很多酸堿對藥的配伍案例如大黃與附子、附子與甘草,甘草皂苷配伍小檗堿,麻黃和甘草,黃芩和黃連等[7]。為初步考察黃連中酸性組分對小檗堿降糖作用的影響,特別是其中高含量酸性成分的影響,酸性組分通過層析法被進一步分離純化,酸性成分與小檗堿之間的相互作用用體外細胞實驗來進行。
1 材料與方法
1.1 材料與儀器
人肝癌胚胎瘤細胞HepG2 購自中國典型培養物保藏中心;黃連 重慶石柱黃連GAP種植基地,由西南大學藥學院袁呂江教授鑒定,樣品保存在西南大學黃連研究開發中心標本館,樣品編號:20130317。
胎牛血清和RPMI 1640培養基 購自Gibco公司;四甲基偶氮唑鹽(MTT)和胰蛋白酶 購自Sigma公司;葡萄糖酶法測定試劑盒 購自南京建成生物工程研究所;鹽酸小檗堿、黃連堿、巴馬汀、表小檗堿、藥根堿、木蘭堿和反式阿魏酸對照品 購自成都曼斯特公司,純度均為98%;格蘭地新 自制,結構已經NMR、MS、IR確證;鹽酸二甲雙胍(純度98%) 購自南京澤朗植提;色譜甲醇、乙腈;其它試劑均為分析純。
LC-20A液相色譜儀、二極管陣列檢測器(DAD) 日本島津公司;Hypersil BDS C18色譜柱(5μm,4.6mm×250mm) 大連依利特科學儀器有限公司;Elix/Rios純水系統儀 Millipore公司;JJ-CJ-2F潔凈工作臺 蘇州市金凈凈化設備公司;ZEISSAxiovert40 CFL倒置顯微鏡 深圳九天實業;AM-300M超導核磁共振儀 Bruker公司;Thermo 6500二氧化碳培養箱 上海旦鼎國際貿易公司;Eos BravoW全自動生化分析儀 上海安泰分析儀器廠;BioTek ELX800酶標儀 上海天呈科技有限公司;超聲波清洗器 江蘇昆山。
1.2 實驗方法
1.2.1 酚酸性成分的分離與結構鑒定 黃連藥材5公斤粉粹后過20目篩,用3倍量70%乙醇浸泡三次,浸泡液合并濃縮至干得浸膏。浸膏用甲醇溶解后,用活性炭進行吸附脫色。脫色液用聚酰胺柱層析,pH=4的冰醋酸水洗脫,分部收集洗脫液,TLC檢測。
1.2.2 HPLC分析
1.2.2.1 定性分析 流動相:乙腈-50mmol/L磷酸二氫鉀溶液(50∶50),其中含15mmol/L十二烷基磺酸鈉,磷酸調節pH為4.0;流速:1.0mL/min;柱溫:30℃;進樣量:20μL;檢測波長:254nm;標準溶液:表小檗堿,巴馬汀,藥根堿,黃連堿,木蘭堿,格蘭地新,分別配制成5mg/L的甲醇溶液;小檗堿,配成10mg/L的甲醇溶液;阿魏酸,配成100mg/L的甲醇溶液。
1.2.2.2 定量分析 酸性成分阿魏酸的含量測定:對照溶液的制備:稱取阿魏酸對照品20mg,精密稱定,用甲醇∶甲酸(5∶95)溶解并制成0.5mg/mL的儲備溶液。用時用70%甲醇稀釋成相應的倍數。臨用前用0.45μm濾膜過濾。
樣品溶液的制備:取黃連藥材5g,粉碎后過20目篩,精密稱取0.2g,加入甲醇∶甲酸(5∶95)50mL,超聲加熱(70℃)提取30min,放冷,補足損失的甲醇,搖勻,取上清液過0.45μm濾膜,取續濾液2mL,用甲醇∶甲酸(5∶95)稀釋至10mL。
流動相由甲醇∶2%冰醋酸(20∶80)組成;流速為1mL/min;柱溫為30℃;檢測波長為322nm;HPLC-DAD在線收集紫外光譜的范圍為200~400nm;進樣量為10μL。
黃連中小檗堿的含量測定:小檗堿對照溶液的制備:取鹽酸小檗堿對照品10mg,精密稱定,用甲醇溶解并定容至100mL,制成100mg/L的儲備溶液。臨用前用0.45μm濾膜過濾,取續濾液作為供試溶液。
小檗堿的含量測定方法按照中國藥典2010版第一部中黃連的含量測定方法進行。
1.2.3 細胞實驗
1.2.3.1 細胞培養 用含10%胎牛血清的RPMI 1640培養液培養HepG2細胞,CO2濃度為5%,并保持飽和濕度。用0.25%的胰酶消化增殖狀況良好的細胞并進行傳代。
1.2.3.2 樣品溶液制備 小檗堿、阿魏酸、MTT均用pH7的磷酸緩沖液配制,濾過除菌。使用時與不含血清的培養基按1∶9混溶。阿魏酸最終質量濃度為2、4、8、16、32、64mg/L溶液。小檗堿濃度參考實驗的半數抑制濃度,最終質量濃度為1,36,72mg/L溶液。二甲雙胍最終質量濃度為1mg/L溶液。
1.2.3.3 細胞降糖實驗 將消化并稀釋好的HepG2細胞加入到96孔板中,按照文獻方法[8]建立高糖細胞模型,進行體外降糖實驗。待細胞鋪滿率達80%,每孔換用250μL含藥或不含藥的培養液。二甲雙胍作為陽性對照。對照組和實驗組均重復三次。24h后利用酶法在505nm處用生化分析儀檢測培養液中葡萄糖剩余量。
1.2.3.4 MTT實驗 細胞降糖實驗完成后,按照文獻方法[9],在HepG2細胞葡萄糖消耗實驗結束時將待測培養液移出,換上含5mg/mL MTT的培養基,繼續孵育4h,然后將培養液倒盡,吸干,每孔再加入200μL二甲亞砜,混勻后置酶標儀上于490nm處測吸光度。吸光度值A與活細胞數成正比關系。細胞存活率計算公式為:
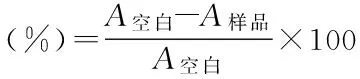
2 結果與討論
2.1 酚酸性成分的分離與鑒定
浸膏用活性炭脫色后,生物堿被吸附,得到酸性組分。酸性組分用聚酰胺柱層析后得到兩個化合物1(147mg),2(7mg)。它們的結構鑒定分別為:
1,白色針晶,1HNMR(300Hz,CD3OD)δ:6.32(d,J=15.9Hz,H-2),7.52(d,J=15.9Hz,H-3),6.78(d,J=8.1Hz,H-3′),7.02(d,J=8.1Hz,H-4′),7.13(H-6′),3.81(s,-OCH3,);13CNMR(75MHz,CD3OD)δ:168.1(-COOH),149.2(C-2′),148.1(C-1′),144.6(C-3),125.9(C-5′),122.9(C-6′),115.8(C-2),115.7(C-3′),111.3(C-6′),55.8(-OCH3)。1HNMR與13CNMR數據與文獻[10]中反式阿魏酸的一致。
2,白色粉末,1HNMR(300Hz,CD3OD)δ:6.74(1H,d,J=7.5Hz,H-9),6.59(2H,s,H-8,H-3),4.10(1H,brd,J=12.9Hz,H-6a),3.83(3H,s,10-OCH3),3.81(3H,s,2-OCH3),3.59(1H,m,H-5),3.47(1H,m,H-5),3.32(3H,m,N-CH3),3.24(1H,m,H-4),3.08(1H,brd,J=11.7Hz,H-7),2.92(s,3H,N-CH3),2.78(1H,m,H-4),2.64(1H,brt,J=12.9Hz,H-7);13CNMR(CD3OD,75Hz):24.7(C-4),31.8(C-7),43.4(N-CH3),53.8(N-CH3),56.0(10-OCH3),56.3(2-OCH3),62.5(C-5),71.3(C-6a),109.4(C-3),110.5(C-9),115.8(C-3a),117.0(C-8),121.0(C-6b),123.5(C-11a),123.6(C-11b),126.0(C-7a),149.8(C-11),150.8(C-1),151.8(C-10),153.2(C-2)。1HNMR與13CNMR數據與木蘭堿[11]一致。
從酸性組分中得到大量阿魏酸,說明它在黃連中的含量較高。而木蘭堿從酸性組分中分離出,一方面其本身是多羥基生物堿,極性較大的原因,另一方面,可能活性炭對這種極性相對較強的阿樸菲型生物堿吸附力較弱。
2.2 HPLC分析與討論
2.2.1 定性分析 黃連的HPLC色譜圖見圖1,為了進一步了解阿魏酸在黃連中的含量,在查閱文獻及實驗前期分離工作的基礎上,對黃連中主要生物堿及阿魏酸的混合標準溶液進行色譜分析,結果見圖1A。圖1B為樣品色譜圖。根據加樣回收實驗及每個信號的色譜行為,5個主要色譜峰分別判定為5個異喹啉型生物堿小檗堿、表小檗堿、藥根堿、黃連堿、巴馬汀(圖1中1~5號峰);6、7號峰為酚性生物堿格蘭地新和木蘭堿。8號峰與標準反式阿魏酸的紫外及保留時間一致,加樣實驗的色譜行為也一致,判定為阿魏酸。色譜圖中的8個色譜峰基本上得到了指認。其中7個生物堿的色譜峰及紫外吸收均較強,而阿魏酸的相關信號在樣品色譜圖中則相對弱得多。雖然文獻報道黃連中還含有綠原酸,但與標準綠原酸色譜圖比對,發現在相應的位置并無信號,可能原因與綠原酸含量少或在相應色譜條件下保留時間短有關。
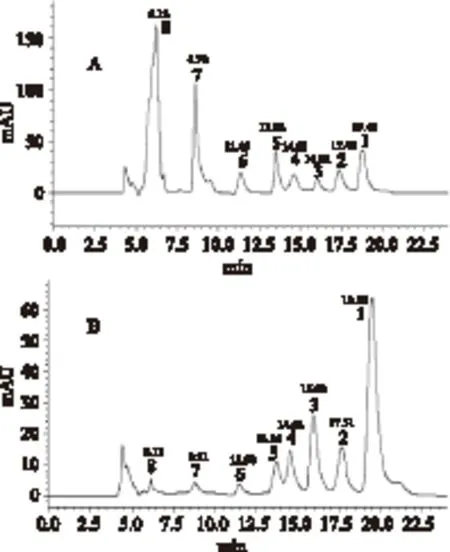
圖1 對照溶液(A)和黃連浸膏(B)的HPLCFig.1 HPLC of contrast solution and Coptis chinensis Franch.extracts注:1:小檗堿;2:巴馬汀;3:黃連堿;4:表小檗堿; 5:藥根堿;6:格蘭地新;7:木蘭堿;8:阿魏酸。
2.2.2 定量分析 為考慮阿魏酸對小檗堿細胞降糖的影響,分別測定了黃連中阿魏酸及小檗堿的含量。阿魏酸HPLC分析結果見圖2。在實驗條件下,阿魏酸峰形對稱,塔板數為3750,分離度較好。外標法測得黃連中阿魏酸的含量為0.25±0.033mg/g;以峰面積對進樣濃度進行線性回歸,線性方程為y=3750 x+174500(R2=0.9764),在2.2~13.1mg/L內具有良好線性關系。樣品的平均回收率為97%±2.35%。保留時間RSD均小于0.5%,色譜峰的峰面積RSD均小于1.5%。樣品溶液在12h內穩定。目前尚無黃連中阿魏酸含量的相關文獻報道。
因阿魏酸溶液易氧化,隨著光照時間及存放時間的延長,反式阿魏酸變為順式阿魏酸的幾率增高。樣品溶液的色譜圖(圖2)中1號峰后的小峰經二級陣列管檢測器檢測,與順式阿魏酸的紫外圖譜一致,兩峰的峰面積之比約為16∶1。進行阿魏酸含量測定時,樣品和標準溶液須現配現用。另一方面,阿魏酸在極性太小和太大的溶劑中均不易溶出。實驗中發現原料用甲醇∶甲酸(5∶95)超聲加熱(70℃)提取30min后,殘渣中幾乎檢測不出阿魏酸。在色譜分離條件下,黃連中存在的生物堿基本上不被洗脫,而保留在色譜柱上,因此,它們對阿魏酸的測定影響較小。
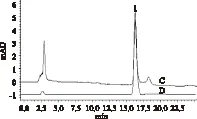
圖2 阿魏酸含量測定的HPLC圖Fig.2 HPLC of ferulic acid reference standard(C) and extracts of Coptis chinensis Franch(D)注:C:樣品溶液;D:對照溶液;1:反式阿魏酸的色譜峰。
小檗堿HPLC圖見圖3。按照2010版中國藥典標準測定,石柱黃連中小檗堿的含量為7.91±0.022mg/g,與文獻報道[12]一致。上述實驗結果測得黃連中阿魏酸的含量為0.25±0.033mg/g,由此說明黃連浸膏中小檗堿與阿魏酸的質量比約為32∶1。
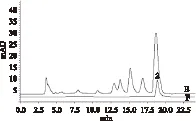
圖3 小檗堿含量測定的HPLC圖Fig.3 HPLC of berberine reference standard(E) and extracts of Coptis chinensis Franch.(F)注:E:樣品溶液;F:對照溶液;2:小檗堿的色譜峰。
2.3 細胞實驗
2.3.1 阿魏酸對小檗堿處理的肝細胞增殖作用的影響 MTT實驗結果見圖4。結果表明,在一定濃度下,阿魏酸本身有微弱的促進HepG2細胞增殖作用,而小檗堿有一定的細胞毒性。這與文獻報道[13-14]一致。在實驗中,用不同濃度小檗堿處理HepG2細胞后,計算其半數抑制率為36mg/L。在36mg/L的小檗堿溶液中混合加入0 ~64mg/L的低濃度阿魏酸后,HepG2細胞的存活率明顯上升,效果非常顯著。當含64mg/L阿魏酸后,存活率上升到69%。
小檗堿引起肝細胞凋亡的機理可能與其能引起細胞信號分子ASK1,AKT,MAPKs變化,從而導致活性氧的產生有關[15]。雖有報道高劑量的阿魏酸對HepG2細胞的生長有一定的抑制作用,其凋亡機理可能與此細胞中NADPH氧化酶系統激活產生的ROS有緊密聯系[16],但低劑量0 ~64mg/L的阿魏酸對HepG2細胞的影響很小。Sudheer等[17]發現10 ~300μmol/L(相當于1.94 ~60mg/L)阿魏酸對3μmol/L尼古丁所誘導的大鼠外周血淋巴細胞DNA損傷及細胞改變有顯著的保護效應。該研究認為尼古丁引起內源性抗氧化因子,如SOD、CAT、GSH-Px等的減少,而加入阿魏酸治療后這種趨勢得到抑制。小檗堿處理的HepG2細胞中加入阿魏酸后,細胞存活率提高是否也與抗氧化因子有關還有待進一步驗證。

圖4 阿魏酸與小檗堿混合對HepG2細胞增值作用的影響Fig.4 cytotoxity effect of berberine in combination with ferulic acid on HepG2 cells注±s,n=4;小檗堿同一濃度下 a-g表示組內差異顯著,p<0.05。
2.3.2 阿魏酸對小檗堿處理的細胞吸收葡萄糖的影響 小檗堿能促進細胞吸收葡萄糖,但阿魏酸對其降糖作用的影響鮮有報道。本實驗選用阿魏酸來考察此影響,一方面中藥配伍中有酸堿藥對配伍的模式,另一方面阿魏酸有一定降糖效果[18],常有與它藥聯用用于糖尿病并發癥治療的報道[19-20]。近年來也發現它對某些降糖藥物有協同增效的作用[21]。從圖5中可看出,在同一濃度下,阿魏酸促進肝細胞吸收葡萄糖的效果不如二甲雙胍和小檗堿。在小檗堿的三個不同濃度中加入阿魏酸后,細胞吸收葡萄糖的前后效果有顯著差異(p<0.05),呈現顯著正相關。36mg/L的小檗堿與阿魏酸的組合明顯優于另兩個濃度1mg/L和72mg/L。當在含有36mg/L小檗堿的培養液中加入64mg/L阿魏酸后,葡萄糖消耗量增加29.4%。隨著阿魏酸加入量的增加,葡萄糖消耗增加量先快后慢。結果表明,二者合用后,能明顯促進HepG2細胞增殖,并能促進細胞吸收葡萄糖,體現了一定的協同增效。
小檗堿能促進肝細胞吸收葡萄糖可能與其抑制細胞線粒體功能,導致肝中糖原異生和脂肪積累受阻有關[22]。閆忠卿等認為小檗堿可使HepG2細胞的葡萄糖消耗量增加69.11%,小檗堿能通過肝細胞發揮顯著的降糖作用可能與其調節肝細胞核因子4的表達進而調節GK活性有關。也有報道認為小檗堿降糖與下調HepG2細胞HNFs mRNA表達,調節肝臟葡萄糖代謝相關激酶活性有關[23]。阿魏酸這種行為機理目前不是很明確。阿魏酸為藥用植物當歸、川芎及很多中藥方劑中單一的主要藥效成份,臨床研究證實其具有十分廣泛的治療作用(如抗炎、抗糖尿病、抗癌、抗衰老、抗細胞凋亡)和眾多的靶器官保護作用(如肝、肺、神經及抗輻射保護)。阿魏酸的降糖作用與其能改善胰島素抵抗有關[24]。目前,相關合成藥物阿魏酸鈉片、阿魏酸哌嗪片早已用于臨床心腦血管疾病治療。高利臣等發現一定濃度范圍內阿魏酸顯著增加了藥物代謝酶及轉運體活性CYP3A4、2C9、2B6、MDR及MRP2-ER-8啟動子活性,顯示了對藥物代謝酶及轉運體體外誘導活性[25]。文獻報道[26]阿魏酸、小檗堿在肌小管細胞中有不同的降糖機制。
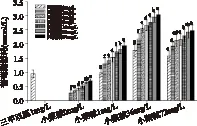
圖5 阿魏酸與小檗堿混合 對促進HepG2細胞葡萄糖消耗作用的影響Fig.5 Glucose-lowering effect of berberine in combination with ferulic acid on HepG2 cells注±s,n=4;小檗堿同一濃度下 a-g表示組內差異顯著,p<0.05。
3 結論
用柱層析法從黃連的酸性組分中分離出阿魏酸。酸性成分阿魏酸與黃連主要降糖活性成分小檗堿都有不同程度的促進HepG2細胞吸收葡萄糖的作用。二者按照不同比例混合后,顯示一定的協同增效作用,阿魏酸能促進小檗堿的細胞降糖作用,并在一定程度上減弱小檗堿的細胞毒性。當在含36mg/L小檗堿的培養液中下加入64mg/L阿魏酸后,可使HepG2細胞的存活率上升到69%,細胞消耗的葡萄糖增加29.4%。
HPLC結果表明,阿魏酸與小檗堿在黃連中的近似質量比約為32∶1。由此推測,黃連中酸性成分阿魏酸一方面能減弱小檗堿對肝細胞的細胞毒性,另一方面也能在一定程度上促進含小檗堿的培養液中肝細胞對葡萄糖的吸收,二者對肝細胞的葡萄糖消耗呈現一定的協同增效作用。黃連中阿魏酸對小檗堿降糖作用的影響還需動物實驗及進一步的分子機制研究,同時,黃連中其它酸性成分是否對小檗堿降糖作用產生影響也需進一步的探討。
[1] 匡艷輝,朱晶晶,王智民,等. 一測多評法測定黃連中小檗堿,巴馬汀,黃連堿,表小檗堿,藥根堿含量[J]. 中國藥學雜志,2009(5):390-394.
[2]劉繼林,孟憲麗,劉詠松. 古代中醫用黃連治療消渴的方藥探討[J]. 四川中醫,2010,28(4):41-43.
[3]馬燕,袁月新,張俊梅,等. 黃連相關中藥復方治療糖尿病及其并發癥的研究概況[J]. 中國實驗方劑學雜志,2011,17(12):272-275.
[4] 李彩虹,周克元. 黃連活性成分的作用及機制研究進展[J]. 時珍國醫國藥,2010,21(2):466-468.
[5]喬琳琳,黃飛,閆小光,等. 黃連煎劑對代謝綜合征大鼠模型骨骼肌 AMPK 表達的影響[J]. 中華中醫藥雜志,2010(1):145-148.
[6]吳衛華,康楨,歐陽冬生,等. 綠原酸的藥理學研究進展[J]. 天然產物研究與開發,2006,18(4):691-694.
[7]裴妙榮,段秀俊,裴香萍,等. 中醫方劑中酸堿對藥的配伍化學研究[J]. 中國中藥雜志,2009(15):1989-1993.
[8]殷峻,胡仁明,唐金鳳,等.小檗堿的體外降糖作用[J].上海第二醫科大學學報,2001,21(5):425-427
[9]殷峻,胡仁明. 小檗堿,齊墩果酸和大蒜新素對糖代謝作用的體外研究[J]. 北京中醫藥大學學報,2003,26(2):36-38
[10]Jiang W,Wang C H,Wang Z T. Water-soluble chemical constituents of Angelica Sinensis(Oliv.) Diels[J]. Chin Pharm J,2010,45(2):101-103.
[11]Jung H A,Yoon N Y,Bae H J,etal. Inhibitory activities of the alkaloids from Coptidis Rhizoma against aldose reductase[J]. Archives of pharmacal research,2008,31(11):1405-1412.
[12]黃小平,張毅,鐘國躍. 不同產地和生長年限黃連的總生
物堿含量測定[J]. 現代中藥研究與實踐,2004,18(1):42-43.
[13]Chen H Y,Ye X L,Cui X L,etal. Cytotoxicity and antihyperglycemic effect of minor constituents from Rhizoma Coptis in HepG2 cells[J]. Fitoterapia,2012,83(1):67-73.
[14]Ma B L,Ma Y M,Shi R,etal. Identification of the toxic constituents in Rhizoma Coptidis [J]. Journal of ethnopharmacology,2010,128(2):357-364.
[15]Hyun M S,Hur J M,Mun Y J,etal. BBR induces apoptosis in HepG2 cell through an Akt‐ASK1‐ROS‐p38MAPKs‐linked cascade[J]. Journal of cellular biochemistry,2010,109(2):329-338.
[16]Lee YS. Role of NADPH oxidase-mediated generation of reactive oxygen species in them echanism of apoptosis induced by phenolic acids inHepG2 human hepatoma cells[J]. Arch Ph arm R es,2005,28(10):1183 - 1189.
[17]Sudheer A R,Muthukumaran S,Kalpana C,etal. Protective effect of ferulic acid on nicotine-induced DNA damage and cellular changes in cultured rat peripheral blood lymphocytes:A comparison with N-acetylcysteine[J]. Toxicology in vitro,2007,21(4):576-585.
[18]Choi R,Kim B H,Naowaboot J,etal. Effects of ferulic acid on diabetic nephropathy in a rat model of type 2 diabetes[J]. Experimental & molecular medicine,2011,43(12):676-683.
[19]龐彩云. 前列地爾聯合阿魏酸鈉治療糖尿病腎病的臨床觀察[J]. 中國實用醫刊,2011,38(3):27-28.
[20]藺樞勇,吳瑞格,周蕾. 阿魏酸鈉聯合低分子肝素鈣治療糖尿病腎病蛋白尿 20 例[J]. 中國藥業,2012,21(Z1):144-145.
[21]Prabhakar P K,Prasad R,Ali S,etal. Synergistic interaction of ferulic acid with commercial hypoglycemic drugs in streptozotocin induced diabetic rats[J]. Phytomedicine,2013,20(6):488-494.
[22]Xia X,Yan J,Shen Y,etal. Berberine improves glucose metabolism in diabetic rats by inhibition of hepatic gluconeogenesis[J]. PLoS one,2011,6(2):e16556.
[23]劉鋒,冷三華,陸付耳,等. 小檗堿對 HepG2 細胞肝細胞核因子基因表達的影響[J]. 中國中西醫結合消化雜志,2007,15(3):141-144.
[24]劉志霞,韓淑英,李繼安. 人肝癌細胞胰島素抵抗模型建立及有效中藥成分的篩選[J]. 中國組織工程研究與臨床康復,2011,15(28):5241-5244.
[25]高利臣. 阿魏酸對藥物代謝酶,轉運體基因的影響及其與 CYP2B6,POR 和 PXR 基因多態性關系[D]. 長沙:中南大學,2012.
[26]Prabhakar P K,Doble M. Synergistic effect of phytochemicals in combination with hypoglycemic drugs on glucose uptake in myotubes[J]. Phytomedicine,2009,16(12):1119-1126.
Effect of ferulic acid fromCoptischinensisFranch on hypoglycemic acitivity of berberine in HepG2 cells
CHEN Hong-ying1,LI Xue-gang2,YE Xiao-li2,XU Jian-rong1
(1. College of Life Science and Engineering,Southwest University of Science and Technology,Mianyang 621010,China;2. College of Pharmaceutical Sciences,Southwest University,Chongqing 400715,China)
In order to study impact of acidic component fromCoptidisRhizomaon glucose-lowering effect of berberine in HepG2 cells,acidic constituents were separated fromCoptidisRhizomaextracts by column chromatography,and cell assay was performed by MTT and Kit methods in high glucose model. From acidic constituents,ferulic acid was separated and identified by chromatography and spectrum methods. It had obvious peak signal in HPLC. Quantitative determination of ferulic and berberine was finished by HPCL-DAD. Their weight ratio inCoptidisRhizomaextracts was approximately 32∶1. Cell experiment showed that berberine 36mg·L-1in combination with ferulic acid 64mg·L-1could make glucose consumption increase by 29.4% and elevate cell livability up to 69% in HepG2 cells,compared with same dose of berberine. The result suggested that ferulic acid,had some synergistic effect on improving glucose-lowering effect of berberine and decreasing cytotoxicity of berberine in HepG2 cells.
CoptischinensisFranch;ferulic acid;berberine;HepG2 cells;synergistic effect
2014-04-08
陳紅英(1973-),女,博士,主要從事藥品食品檢測及天然產物化學方向的教學及科研工作。
西南科技大學實驗室開放基金(13xnkf10);西南科技大學博士基金(13zx7118)。
TS201
A
1002-0306(2015)01-0361-05
10.13386/j.issn1002-0306.2015.01.068

