單純高血糖誘發大鼠動脈粥樣硬化的實驗研究
唐 英,吳曉牧,胡 凡,柴 文,胡國柱,吳梨華,張昆南
糖尿病(DM)患者大血管病變是其死亡的主要原因,其心、腦血管疾病的發病率均顯著高于非糖尿病人群[1,2]。但單純高血糖與動脈粥樣硬化的關系及其可能機制仍不十分清楚。本研究以單純高血糖為特征的2型糖尿病模型大鼠為研究對象,觀察高血糖是否能引起頸動脈脂紋、脂質斑塊形成,以及其與血糖、血脂、同型半胱氨酸及果糖胺之關系,探討糖尿病動脈粥樣硬化的形成和發展機制。
1 材料與方法
1.1 材料 12周齡SPF級SD雄性大鼠(260g~280g)50只(購自湖南斯萊克景達實驗動物中心),40%脂肪的胰島素抵抗誘導模型食料(上海斯萊克實驗動物有限責任公司),大鼠胰島素(INS)酶聯免疫試劑盒(美國 Millipore公司),全自動生化儀(日本HITACHI 7600-120)。
1.2 方法
1.2.1 動物模型制備及分組 SD雄性大鼠適應性喂養1周后按體重隨機分為正常對照組(對照組12只)和糖尿病模型組(38只),均高脂飼料喂養,每只大鼠每天定量25g,自由飲水,自然晝夜照明,相對濕度為50% ~70%,室溫(22~24)℃。4周后,隔夜空腹12 h,造模組大鼠腹腔注射鏈脲佐菌素(Streptozocin,STZ)溶液35mg/kg;對照組腹腔注射0.1mol/L檸檬酸鈉緩沖液。72h后禁食8h~12h大鼠尾靜脈采血測定空腹血糖(FBG),以血糖濃度>16.7mmol/L以上為2型糖尿病大鼠模型造模成功,達到模型標準且未死亡的共30只。30只糖尿病模型大鼠隨機分為糖尿病1月組(DM1組),3月組(DM3組)和5月組(DM5組),每組10只大鼠。但實驗終點由于糖尿病模型大鼠出現死亡,因此DM1組最后為9只,DM3組為10只,DM5組為8只。
1.2.2 大鼠體重 采用電子盤稱每1周稱體重1次。
1.2.3 大鼠血液樣本采集 0月,1月,3月,5月空腹大鼠乙醚麻醉后內眥靜脈取血,室溫放置30min后3 000r/min離心15min分離血清,-80℃保存。
1.2.4 空腹血糖測定 采用已糖激酶法通過全自動生化儀測定外周血空腹血糖(fasting blood glucose,FBG)。
1.2.5 胰島素測定 采用ELISA方法測定大鼠空腹血清胰島素,實驗步驟嚴格按照試劑盒說明書實驗程序進行,胰島素含量根據試劑盒標準曲線測得。
1.2.6 血清生化指標測定 三酰甘油(TG)、總膽固醇(TC)、高密度脂蛋白膽固醇(HDL-C)、低密度脂蛋白膽固醇(LDL-C)、同型半胱氨酸 (HCY)和果糖胺(FMN)含量采用全自動生化儀測定。
1.2.7 形態學觀察 分別于采血后經水合氯醛腹腔麻醉大鼠,開胸、開腹,夾閉腹主動脈,將連有輸液器的針頭插入左心室并剪開右心耳,先灌注150mL生理鹽水,隨后用4.0%多聚甲醛進行灌注。待灌注完成后取出左側頸總動脈,將所得血管放入裝有4.0%多聚甲醛的容器中固定4h~6h,包埋,石蠟切片厚4 μm,切片脫蠟水化,常規HE染色,光鏡觀察動脈粥樣硬化病變。
1.2.8 統計學處理 采用SPSS 20.0軟件處理,計量資料以均數±標準差(x±s)表示,多組間比較采用單因素方差分析,方差齊時采用LSD比較,方差不齊時用秩和檢驗。相關性分析統計采用Person法。
2 結 果
2.1 各組動脈壁的病理改變 糖尿病組動脈內膜內皮細胞層下基質層變厚,有核細胞增多,核變大,3月時可見血管壁局限增厚,可觀察到少許泡沫細胞,5月時泡沫細胞數量未見明顯增多,但較3月時多,尚未形成典型粥樣斑塊,符合動脈粥樣硬化的早期病理改變。糖尿病組中膜層結構變疏松,彈性纖維減少,間距變大,許多平滑肌細胞核變大,變圓,細胞變短,由收縮型變為合成型,并出現了平滑肌細胞的遷移。而對照組動脈壁結構平整,內皮細胞光整,排列規則,動脈中膜平滑肌仍為收縮型,為正常大鼠血管。
2.2 各組血糖、血脂、同型半胱氨酸和果糖胺水平比較 糖尿病各組與對照組比較,FBG,TC,TG,LDLC,HCY,FMN等差異均有統計學意義(P<0.01);DM1組 HDL-C 高于對照組(P<0.01);各模型組之間FBG,TC,HCY,FMN差異有統計學意義(P<0.01)。詳見表1。
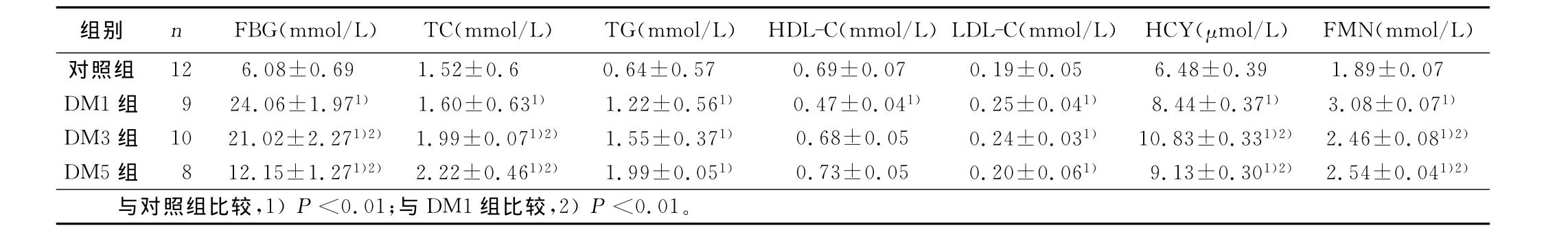
表1 各組血糖、血脂、同型半胱氨酸和果糖胺水平比較(x±s)
3 討 論
根據2型糖尿病發病機制,本實驗選用SD大鼠先喂以高脂飼料1月誘導胰島素抵抗,然后一次性腹腔注射低劑量STZ 35mg/kg誘導胰島素抵抗大鼠產生高血糖。STZ注射后72h時,與正常對照組相比,模型組大鼠FBG急劇增加至16.7mmol/L以上,同時出現多飲、多食、多尿等癥狀,雖然隨著實驗進行,模型組血糖水平有逐漸下降的趨勢,但是至成模5月后仍高于正常水平,糖尿病模型建立成功且穩定。糖尿病動物模型造模前后均給高脂飼料喂養。
本研究中,用HE染色觀察糖尿病大鼠動脈壁結構,發現該糖尿病動物模型動脈壁特點為:內皮細胞層下基質層變厚,有核細胞增多,核變大,變圓,細胞變短,向內皮遷移,內皮細胞聚集變形,形成纖維帽;血管壁局限增厚,可觀察到泡沫細胞,至5月時已形成脂紋,此變化符合動脈粥樣硬化病理變化的早期改變[3],中膜層結構變疏松,彈性纖維增生,呈玻璃樣變,許多平滑肌細胞由收縮型變為合成型,并出現了平滑肌細胞的遷移。而對照組大鼠動脈內膜層光滑,無脂質沉積,無泡沫細胞,中膜層平滑肌細胞排列整齊,細胞核清晰。上述病理結果提示,糖尿病大鼠已發生動脈粥樣硬化,其顯著特點是泡沫細胞和脂紋的形成,以及早期出現的平滑肌細胞的變形、遷移和增殖。
動脈粥樣硬化是一種脂質相關的慢性炎癥免疫疾病,動脈粥樣硬化的形成是一個緩慢而復雜的過程,血脂沉積于損傷的動脈內膜,脂肪沉積刺激動脈內壁平滑肌細胞和纖維細胞增生,增生不斷發展連成纖維斑塊,大量炎癥免疫細胞聚集在動脈粥樣斑塊中[4],從而造成血管病變、微循環障礙及血液流變學改變,最終導致心腦血管病變發生,嚴重影響人類健康和生活質量。LDL-C、高濃度的TG和TC已被證實是動脈粥樣硬化疾病的主要危險因素[5]。在本研究中,模型組各組的TC、TG、LDL-C與對照組比較差異均有統計學意義(P<0.01);說明模型組在血糖升高的同時也伴隨著血脂濃度的升高,它們共同促進血管的動脈粥樣硬化。
高同型半胱氨酸可能通過以下機制導致動脈粥樣硬化、血栓形成及腦梗死的發生:①通過氧化應激損傷血管內皮細胞;②LDL形成復合物后被巨噬細胞吞噬,形成泡沫細胞;③刺激血管平滑肌細胞的增殖;④增加血小板凝血烷的合成,破壞機體凝血與纖溶系統之間的平衡;⑤促進細胞凋亡;⑥其他如炎癥反應等。通過上述機制過多、過高的同型半胱氨酸可以腐蝕損害血管造成血栓的形成。在本研究中,模型組各組的HCY與對照組比較差異均有統計學意義(P<0.01);說明模型組在血糖升高的同時也伴隨著HCY濃度的升高,它們共同促進血管的動脈粥樣硬化。輕度升高的同型半胱氨酸血癥與心腦血管疾病之間無內在的必然聯系或聯系很小[6]。同型半胱氨酸的致動脈粥樣硬化機制仍需要進一步深入研究和探討。
高血糖動物模型出現了明確的動脈粥樣硬化的部分特征性表現,說明高血糖是動脈粥樣硬化的一個重要原因;糖尿病動物模型存在高三酰甘油、高膽固醇、高低密度脂蛋白、高同型半胱氨酸及血果糖胺的升高;上述指標的增高可能是糖尿病動脈粥樣硬化的危險因素,其作用可能與內皮細胞受損,動脈壁局部炎癥介質表達有關,但它們導致動脈粥樣硬化的分子機制仍有待進一步的研究。
[1] Morrish NJ,Wang SL,Stevens LK,etal.Mortality and causes of death in the WHO multinational study of vascular disease in diabetes[J].Diabetologia,2001,44(suppl 2):s14-s21.
[2] Jeerakathil T,Johnson JA,Simpson SH,etal.Short-term risk for stroke is doubled in persons with newly treated type 2diabetes compared with persons without diabetes:A population based cohort study[J].Stroke,2007,38:1739-1743.
[3] Peter Libby.Current concepts of the pathogenesis of the acute coronary syndromes[J].Circulation,2001,104:365-372.
[4] Ross R.Atheroselerosis-an inflammatory disease[J].N Engl J Med,1999,340:115-126.
[5] Cannon C,Braunwald E,McCabe C,etal.Intensive versus moderate lipid lowering with stains after acute coronary syndromes[J].N Engl J Med,2004,350:1495-1504.
[6] Homocysteine Studies Collaboration.Ametaanalysis[J].J Am Med Assoc,2002,288:2015-2022.

