競爭性ELISA、HPLC測定清燥救肺湯中甘草酸的含量
吳振起,王思源,平 靜,于 艷,南春紅
(1.遼寧中醫藥大學附屬醫院兒科,沈陽110032;2.遼寧中醫藥大學附屬醫院中藥實驗室,沈陽110032)
競爭性ELISA、HPLC測定清燥救肺湯中甘草酸的含量
吳振起1,王思源1,平 靜1,于 艷2,南春紅1
(1.遼寧中醫藥大學附屬醫院兒科,沈陽110032;2.遼寧中醫藥大學附屬醫院中藥實驗室,沈陽110032)
目的 建立清燥救肺湯中甘草酸(GA)快速靈敏的免疫分析檢測方法。方法 以制備出的甘草酸特異性單克隆抗體為基礎,選擇單抗最佳工作濃度,建立GA間接競爭酶聯免疫分析方法(ELISA),并應用此方法檢測清燥救肺湯中的GA含量。同時結合高效液相色譜法(HPLC)進行比較確證。結果 ELISA測定清燥救肺湯中成分GA在0.312 5~10 μg/mL(r=0.996 9)范圍內線性關系良好,平均回收率不低于92.5%;3批樣品中GA含量均值為10.125 mg/g,與HPLC測定結果相近,RSD<1%。結論 ELISA對中藥成分測定準確可靠,重復性好,是HPLC測定有益的技術補充。
清燥救肺湯;甘草酸;ELISA;HPLC;含量測定
清燥救肺湯是治療燥熱傷肺的經典名方,首見于《醫門法律》,為清代醫家喻嘉言創制,由桑葉、石膏、甘草等中藥組成。清燥救肺湯在臨床上廣泛應用,然而目前尚缺乏質量控制的方法。現代研究[1-2]表明,甘草酸(GA)具有抗腫瘤、抗炎、抗病毒、增強免疫功能等作用,是清燥救肺湯中主要的活性成分之一,可作為其質量控制、作用機制等研究的對象。目前,對于甘草酸的含量測定主要采用HPLC[3-4]、毛細管電泳法[5]、液相色譜-串聯質譜法[6]等,尤以HPLC最為常用。中藥復方活性成分復雜,應用高效液相色譜法測定活性成分存在前處理繁瑣、耗時等困難。隨著酶聯免疫分析法(Enzyme-Linked Immunosorbent Assay,ELISA)的發展,應用ELISA可快速處理樣品、靈敏度高、對大量樣品可同時檢測[7],在科學研究、生物制品生產中開始被應用[8]。因此本實驗擬建立快速檢測甘草酸的ELISA方法,并進行HPLC、ELISA同時測定清燥救肺湯中甘草酸含量的比較研究,進一步對免疫分析技術在活性成分測定的可行和可信性進行確證。
1 材料
清燥救肺湯中各飲片,購自遼寧中醫藥大學附屬醫院;甘草酸對照品(批號110731-200614),由中國藥品生物制品檢定所提供;抗GA單克隆抗體(GAMAb)、GA-人工抗原(GA-HSA),由日本長崎國際大學藥學院正山征洋教授惠贈;標記用羊抗鼠酶標抗體(Pierce,美國);ABTS顯色劑(日本和光純藥工業株式會社)。磷酸鹽、甲醇等均為國產分析純,96孔酶標板(Corning,美國)。電熱恒溫培養箱(上海精宏實驗設備有限公司),酶標儀(bio-rad,美國)。
2 方法
2.1 供試品的制備 清燥救肺湯(桑葉、枇杷葉、杏仁、麥冬、人參、甘草、胡麻仁等7味中藥飲片)經70%乙醇提取,回收溶劑,減壓濃縮,阿膠烊化,石膏水提另煎,并與乙醇濃縮液合并,進一步干燥得清燥救肺湯干粉。取本品粉末0.5 g,精密稱定,置具塞錐形瓶中,精密加入甲醇10 mL,超聲處理,每次15 min。以4 000 r/min離心10 min,取上清液;甲醇重復提取5次,合并所得溶液,氮氣吹干。以1 mL甲醇溶解殘余物,測定前經0.45 μm濾膜過濾。
2.2 GA-MAb最佳工作濃度的確定 GA-MAb以TPBS分別稀釋為1∶1 000,1∶3 000,1∶6 000之后,于已預先包被并封閉好的酶標板中,每孔加入100 μL。采用常規間接ELISA法測定。
2.3 競爭性ELISA法的建立 采用碳酸緩沖液(50 mol/L)稀釋GA-HSA(1∶1 000),加入96孔酶標板中,每孔100 μL,37℃恒溫1 h,PBS清洗5次。封閉∶每孔加入300 μL封閉液,37℃孵育1 h,PBS清洗5次。加樣∶以10%甲醇分別將待測樣品與GA-MAb混合(1∶1),加入酶標板的測定孔中;陽性對照孔加入GA-MAb與10%甲醇的混合液(1∶1);空白孔為100 μL 10%甲醇。混合振蕩1 min,37℃培養箱中孵育l h。加酶標二抗∶加入TPBS稀釋的二抗羊抗小鼠IgG(1∶1 000),每孔100 μL,溫育30 min,PBS清洗5次;顯色∶ABTS顯色20 min,450 nm處測定吸光度A值。
2.4 方法學驗證
2.4.1 線性試驗 取不同質量濃度(0.312 5、0.625、1.25、2.5、5、10 μg/mL)的GA溶液,按照“2.3”項下測定。以GA質量濃度的對數(X)為橫坐標,其對應的吸光度(A/A0)為縱坐標,繪制標準曲線(見圖1)。
2.4.2 精密度試驗 取3個不同質量濃度的GA對照品溶液(1、4、8 μg/mL),按照“2.3”項下測定,每個濃度3個復孔。本實驗連續測定3 d,并重復3次實驗,測定日內精密度和日間精密度。
2.4.3 回收率試驗 精密吸取甘草酸溶液(4 μg/mL)3分,分別加入等體積甘草酸對照品溶液(1、4、8 μg/mL),按照“2.3”項下測定,每個濃度平行測定3次。
2.5 含量測定 ELISA分析方法∶將清燥救肺湯供試品稀釋成100、200、400、800、1 600倍。參照2.2方法,選定清燥救肺湯的最佳稀釋濃度為1∶800。將3批稀釋度為1∶800的供試品,參照“2.3”方法測定,計算GA平均值。
HPLC分析方法,色譜柱:PhenomsilC18(250 mm×4.6 mm,5 μm);流動相:乙腈-0.1%磷酸水溶液(32∶68),檢測波長254 nm,柱溫∶30℃;進樣量∶20 μL。
2.6 GA-Mab特異性的測定 將類似物(脫氧膽酸、甘草次酸3-O-β-D-葡萄糖醛酸、熊果酸、齊墩果酸),等比稀釋液替代甘草酸稀釋液,其他條件相同,測定其與GA-MAb之間的交叉反應。以50%抑制的甘草酸濃度與50%抑制的類似物濃度的百分比為其交叉反應率[8],反應抗單克隆抗體的特異性。交叉反應率(%)=(GA標準品的IC50/類似物IC50)×100%
3 結果
3.1 GA-MAb最佳工作濃度的確定 結果測得由3個Anti-GC MAb的A450值分別為1.358、0.887、0.443。有報道[9],酶標儀測定A值的敏感范圍在1.00左右,為保證測定結果靈敏可靠,抗體稀釋比可選擇1∶3 000。
3.2 方法學驗證
3.2.1 線性關系 實驗顯示,采用對照品擬合出的GA ELISA標準曲線(見圖1),回歸方程為Y=1.436 5-0.566 ln(X),r=0.996 9。表明GA在0.312 5~10 μg/mL范圍內線性關系良好。
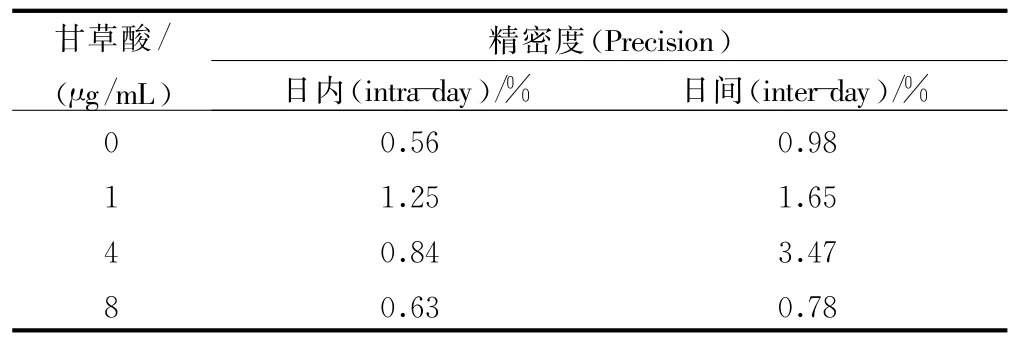
表1 間接競爭ELISA法測定不同濃度梯度的GA標準溶液的精密度(n =3)
3.2.2 精密度、回收率 對3次平行測定顯示,日內精密度RSD為0.56%~1.25%,日間精密度RSD為0.78%~3.47%,見表1。GA的回收率結果表明低、中、高單個劑量的GA的加樣回收率不低于92.5%。以上驗證結果說明實驗方法和數據科學有效。
3.3 含量測定 清燥救肺湯進行800倍稀釋后,競爭ELISA測定,在450 nm波長處測得吸收值為0.493,計算甘草酸含量為6.315 μg/mL,則未稀釋原樣品中甘草酸含量為5.052 mg/mL,折合成生藥中含量為10.125 mg/g。HPLC條件,甘草酸與雜質峰可完全分離,空白樣品無干擾(見圖2~圖3)。GA出峰時間約在24 min,標準曲線為Y=700.589C+0.756,r=0.999 7。測定的平均含量為10.897 mg/g。2種方法比較,相對誤差為0.55%,結果差異小,可以互為比照、參考。含量見表2。
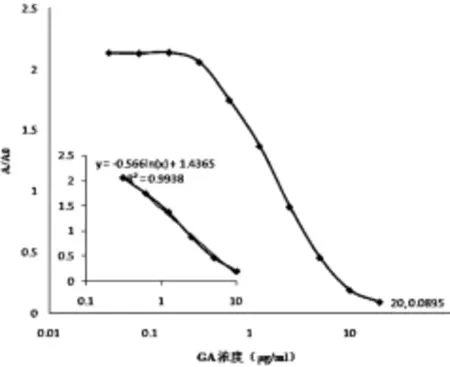
圖1 GA測定用的ELISA 標準曲線
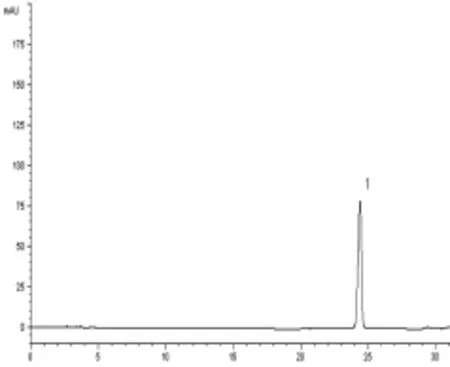
圖2 清燥救肺湯中GA標準品HPLC色譜圖(1∶GA)
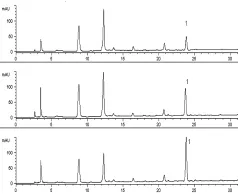
圖3 清燥救肺湯樣品HPLC色譜圖(1∶GA)
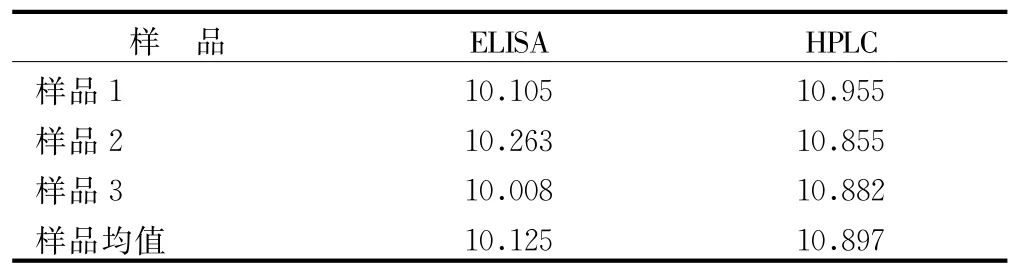
表2 GA提取物的ELISA和HPLC檢測結果(n=3)mg/g
3.4 GA-Mab特異性的測定 結果見表3。GA-MAb與甘草次酸有一定的交叉反應,而與其他幾種化合物的交叉反應極小,推測GA是由甘草次酸和兩分子的葡萄糖醛酸構成的,屬于苷與苷元的關系,結構比較相近。

表3 GA-MAb與GA 結構類似化合物的交差反應性
4 小結
目前對中藥的檢測大部分是通過色譜來分析,而免疫分析方法在中藥活性成分分析比較少見。免疫分析方法具有特異性強、靈敏度高、檢測快速等特點,已應用到中藥活性成分的快速分析上[10]。
一般來說,抗原與抗體間反應具有高度特異,但某些競爭物于抗原結構相同或類似時,可能存在一定的交叉反應,因此測定化合物抗體特異性具有一定意義。本研究顯示,GA單克隆抗體除了與GC存在一定的特異性反應外,與其化學結構類似物交叉反應較小。這表明抗GA的單克隆抗體具有很強的特異性,避免了ELISA中假陽性的存在。
除了抗體的因素外,免疫分析方法的建立還受抗體工作濃度等因素影響。本研究確定了GA-MAb稀釋比為1∶3 000,并對間接競爭ELISA方法進行考察。結果表明,該方法的日內精密度差異0.56%~1.25%、日間精密度差異0.78%~3.47%、平均回收率不低于92.5%,均符合分析方法的要求。
本實驗對3批次清燥救肺湯中GA含量的ELISA和HPLC測定結果表明,樣品的檢測結果接近,說明用ELISA測定GA的方法可行。與HPLC法相比,ELISA樣品前處理簡單,不需大型儀器設備,檢測時間快。
綜上,清燥救肺湯中甘草酸的免疫分析方法的建立,為中藥中GA的質量控制提供檢測依據,同時也可對其他中藥活性成分的分析提供思路。
[1]韓瑤聃,王彬,王政雨,等.甘草酸藥理作用的研究進展[J].中國新藥雜志,2012,21(21):2499-2505.
[2]王兵,王亞新,趙紅燕,等.甘草的主要成分及其藥理作用的研究進展[J].吉林醫藥學院學報,2013,34(3):215-218.
[3]鄧陽,丁雯雯,顏苗,等.HPLC法測定甘草制劑中甘草酸的含量[J].湖南中醫雜志,2013,29(8):126-129.
[4]張振巍,張娜娜,李國慶,等.甘草流浸膏中甘草酸含量測定方法的建立[J].中國藥師,2014,17(8):1419-1421.
[5]許重遠,李國鋒,陳志良,等.高效毛細管電泳法測定甘草酸栓中甘草酸和甘草次酸的含量[J].中成藥,2000,22(11):792-793.
[6]趙白云,朱臻宇,王彬,等.HPLC-DAD-TOF/MS法測定小柴胡湯中柴胡皂苷a、黃芩苷和甘草酸的含量[J].第二軍醫大學學報,2007,28(5):527-530.
[7]劉萍,陳苗苗,劉學榮,等.單克隆抗體研究進展[J].中國畜牧獸醫,2012,39(1):67-70.
[8]朱學泰,馬瑞軍,謝溱.單克隆抗體在中草藥中的研究前景[J].中草藥,2005,36(6):945-947.
[9]金仁耀,吳建祥.慶大霉素單克隆抗體的研制及ELISA分析方法的建立[J].核農學報,2013,27(1):88-92.
[10]XU YU,LIU JINHUA,WANG JING,et al.A monoclonal antibody-based competitive ELISA forthe determination of ruscogenin in Chinese traditional medicines and biological samples[J].Chinese Journal of Natural Medicines,2014,12(10):794-799.
Competitive ELISA and HPLC in determination of glycyrrhizic acid in Qingzaojiufei decoction
WU Zhenqi1,WANG Siyuan1,PING Jing1,YU Yan2,Nan Chunhong1
(1.Department of Pediatrics,Affiliated Hospital of Liaoning University of Traditional Chinese Medicine,Shenyang 110032,China;2.Laboratory of Chinese Medicine,Affiliated Hospital of Liaoning University of Traditional Chinese Medicine,Shenyang 110032,China)
Objective To establish an immunoassay method for the determination of glycyrrhizic acid(GA)in Qingzaojiufei Tang.Methods Indirect competitive ELISA was developed by using anti-GA monoclonal antibody(anti-GA MAb),and then it was applied to GA measurement in the traditional Chinese medicine Qingzaojiufei Tang.Simultaneously,using analysis method of HPLC confirm.Results GA had good linearity in the ranges of 0.312 5~10 μg/mL(r=0.996 9),the average recoveries not less than 92.5%,respectively.The average content of GA in three sample was 10.125 mg/g by using ELISA.The RSD of GA determinations between ELISA and HPLC less than 1%,showed a high similarity.Conclusion The developed ELISA method is accurate with high repeatability,which is helpful to provides useful technical supplement for the determination of HPLC.
Qingzaojiufei decoction;glycyrrhizic acid;ELISA;HPLC;content determination
R284.2
A
2095-6258(2015)03-0478-04
??輯:張海洋
2014-11-17)
10.13463/j.cnki.cczyy.2015.03.014
國家自然科學基金面上項目(81373687);遼寧省教育廳優秀人才基金(LJQ2011102);沈陽市科技基金(F11-264-1-62)。
吳振起(1974-),男,醫學博士,副主任醫師,主要從事中醫藥防治感染性疾病研究。

