P促進Pd/C高效催化甲酸制氫的研究
焦曉新,鄭瀟瀟,張鴻斌,李海燕
(廈門大學 化學化工學院,固體表面物理化學國家重點實驗室,醇醚酯化工清潔生產國家工程實驗室,福建廈門361005)

P促進Pd/C高效催化甲酸制氫的研究
焦曉新,鄭瀟瀟,張鴻斌,李海燕*
(廈門大學 化學化工學院,固體表面物理化學國家重點實驗室,醇醚酯化工清潔生產國家工程實驗室,福建廈門361005)
以次亞磷酸鈉(NaH2PO2)為還原劑,成功地制備出一種新型高效的Pd-P/C催化劑,其對甲酸-甲酸鈉混合液分解制氫具有較高催化活性.經過優化后得到的3%Pd-P/C催化劑,在30 ℃,反應液甲酸和甲酸鈉濃度比為1∶5,總濃度為4 mol/L條件下,前1 h平均轉化頻率可達565 h-1,該Pd-P/C催化劑的催化活性是傳統的以NaBH4還原制得的Pd/C催化劑活性的3.5倍.聯合譜學表征結果表明,在Pd粒子的形成生長過程中,P的摻入提高了Pd納米粒子的分散性,減少了粒子的團聚,最終得到了粒徑較小的Pd粒子,從而極大地提高了催化劑的活性.動力學研究表明Pd-P/C催化劑催化甲酸分解的反應活化能為18.63 kJ/mol,相比以NaBH4還原所得催化劑(反應活化能為26.69 kJ/mol),反應活化能更低.
甲酸;氫能源;NaH2PO2;Pd/C
工業革命以來,傳統的化石能源日益枯竭,且引發了一系列資源與環境問題.人們迫切需要開發一種清潔廉價的新能源來逐步代替傳統能源.而氫能以其清潔、可再生、化學活性高、資源豐富等優點引起了越來越多的關注[1].雖然氫能源有無可比擬的優點,但是實際開發應用中還有一些關鍵的技術問題,尤其是關于其制備與儲備的問題尚待解決[2].
最近研究表明甲酸(FA)是潛在的再生能源[3],可由CO2加氫獲得,它有較高的氫含量,使用簡單、運輸方便,被認為是最有前景的氫儲存材料之一.FA分解有2種可能反應途徑[4-6]:1) 脫氫,得到H2和CO2;2) 脫水,生成CO和H2;具體途徑取決于所用催化劑、FA濃度以及反應溫度.
目前,多相催化劑在催化FA分解上取得很大進展.其優點在于能使FA在較低溫度下反應且容易分離和重復循環利用.目前,常見報道的為Pt、Au、Pd負載型多相催化劑,其中Pd最廉價,且Pt催化劑在反應中易產生大量CO,更容易使催化劑中毒[7-8],需進行表面改性處理.Pd基納米催化劑是FA分解制氫反應最具潛力的金屬催化劑[9-13].而目前報道的Pd基催化劑,大都局限于Pd和Au、Ag[9,12,14]的合金形式,因此開發低成本有效的Pd基催化劑對FA分解制氫的工業化應用更具現實性.
本文以NaH2PO2為還原劑,研發出一類新型高效的Pd-P/C催化劑,其對FA分解制氫具有較高催化活性.考察該催化劑對FA分解的反應活性,研究該反應的動力學過程的同時,聯合利用X射線衍射(XRD)、掃描電子顯微鏡/能量色散光譜(SEM/EDX)等多種物理化學表征手段,進一步探討了Pd-P/C高效催化FA分解的原因.
1 實驗部分
1.1 試 劑
活性炭(AC)、PdCl2、NaH2PO2、NaBH4、NaOH、FA、甲酸鈉(SF)、無水乙醇試劑均購買于國藥集團化學試劑有限公司,均為分析純.實驗中所用蒸餾水皆為二次蒸餾水.
1.2 催化劑的制備
AC改性:實驗對AC進行堿預處理,取2 g AC于10%(質量分數,下同)NaOH溶液中,超聲0.5 h,90 ℃下攪拌1.5 h,冷卻,洗滌至中性,80 ℃烘箱中干燥24 h.
催化劑制備:取200 mg處理后的AC,加入到10 mL 0.02 g/mL PdCl2溶液中,超聲攪拌1 h,加5% NaOH溶液調節pH至9.5,后加入含0.38 g NaH2PO2(Pd和P原子比為1∶60)的水溶液,90 ℃下攪拌2 h,冷卻后蒸餾水洗滌至Cl-全部去除,抽濾,烘干即得Pd-P/C催化劑.
作為比較,制備以NaBH4還原的Pd/C催化劑:取200 mg處理后的AC,加入到10 mL 0.02 g/mL PdCl2溶液中超聲攪拌1 h,加5% NaOH溶液調混合液pH至9.5,加入含300 mg NaBH4的水溶液,于常溫下攪拌2 h,洗滌,抽濾,烘干即得Pd/C催化劑.
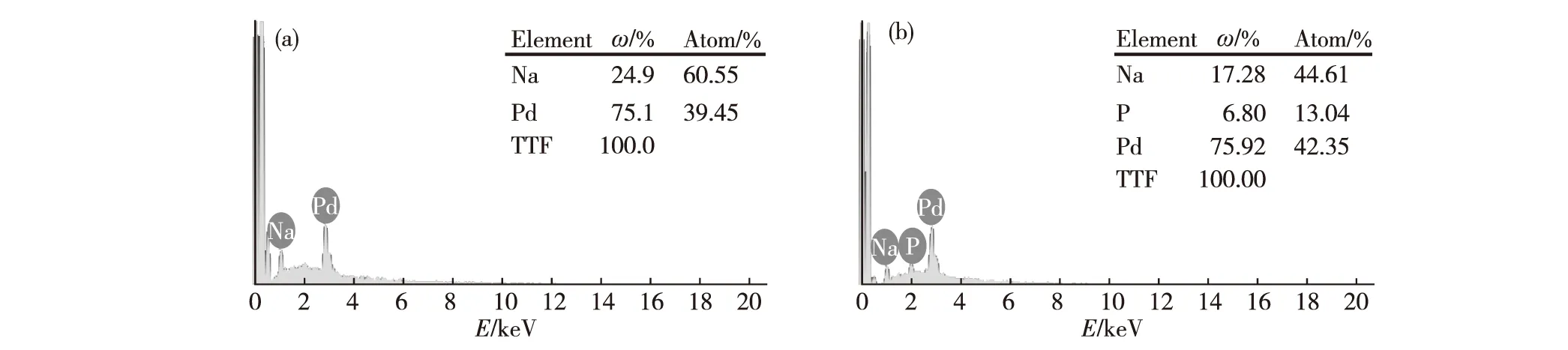
圖2 Pd/C (a)和Pd-P/C (b)的EDX譜圖
1.3 FA分解的評價和檢測
將催化劑置于裝有FA和SF的混合溶液(或純FA和純SF溶液)中,磁力攪拌,反應釋放的氣體通過導管引出,采用排液(飽和NaHCO3溶液)法測量一定時間內產生氣體的體積,用轉化頻率(TOF)表示催化劑的催化活性,該TOF是基于催化劑總Pd原子數目,而不是催化劑活性中心數目進行計算,TOF計算公式為:
其中:patm為標準大氣壓力(101.325 kPa),VH2+CO2為反應液反應第一個小時內產生氣體的體積,單位為L,R為理想氣體常數(8.314 5 m3·Pa/(mol·K)),T為室溫(298 K),nPd為催化劑所含Pd的物質的量,單位為mol,t為反應測試時間(1 h),文中的TOF均為反應第一個小時的平均TOF.
1.4 催化劑的物化性能表征
SEM測試于日本Hitachi公司的S-4800 SEM系統上進行,加速電壓15 kV;樣品的結構分析在Rigaku Ultima IV X射線衍射儀上完成,Cu靶材,Kα射線,管電壓40 kV,管電流40 mA,掃描速率20 (°)/min,掃描范圍10°~90°.
2 結果與討論
2.1 還原方法的比較
本實驗的創新性在于用NaH2PO2作為還原劑制備出Pd-P/C,并應用于催化FA分解的反應,為了突出該還原方法的優點,將其與傳統NaBH4還原法制備的Pd/C催化劑的活性進行了對比.圖1示出NaBH4還原所得催化劑Pd/C和NaH2PO2還原所得Pd-P/C催化劑催化FA分解反應活性的評價結果.從圖中可以看出,在相同的反應條件下,由P促進的Pd-P/C催化劑催化FA分解的TOF可達473 h-1,是Pd/C催化劑(TOF為83 h-1)的5.7倍.
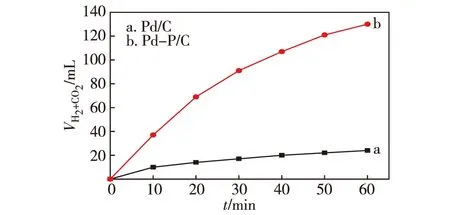
反應條件:20 mg 3%Pd-P/C或3%Pd/C催化劑,10 mL反應液(c(FA)∶c(SF)=1∶9,總濃度為2 mol/L),303 K.
圖2(a)和(b)是Pd/C和Pd-P/C的EDX譜圖.圖2(a)的元素分析顯示以NaBH4為還原劑時生成的Pd/C催化劑中并未檢測到P元素的存在.而圖2(b)顯示NaH2PO2為還原劑時所得催化劑的組分為:Pd(質量分數75.92%),P(質量分數6.80%),有P的存在.該測試結果驗證了Pd納米粒子和P的共存關系,而Pd和P原子比為3.25∶1,說明大部分P已洗掉,只有少量的P與Pd共存,推測P的存在為該催化劑活性高的關鍵因素.
圖3是Pd/C和Pd-P/C的XRD譜圖.圖中顯示2種催化劑的C(002)晶面衍射峰都在25°,另外3個衍射峰40.15°,46.76°,和68.19°對應Pd晶面(111),(200),(220),說明此Pd納米粒子在Pd-P/C和Pd/C 2種催化劑中都存在面心立方結構.對比圖3-a和b可以看出,Pd-P/C的衍射圖比Pd/C衍射圖寬泛很多,Pd(200)的衍射峰據謝樂公式估算出Pd-P/C和Pd/C中Pd粒子的平均粒徑分別為9和17 nm,說明Pd-P/C中Pd粒子的粒徑更小.XRD圖中并未觀察到P的特征峰,說明P是以原子形式存在于Pd的晶格中.

圖5 不同Pd負載量的Pd-P/C活性對比(a)及XRD譜圖(b)

圖4 Pd/C (a)和 Pd-P/C (b)的SEM圖
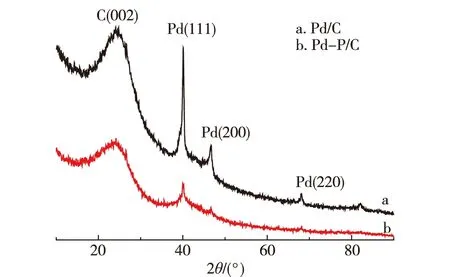
圖3 Pd/C和Pd-P/C的XRD譜圖
圖4(a)和(b)為Pd/C和Pd-P/C的SEM圖,圖4(a)為存在于Pd/C催化劑表面團聚Pd顆粒的SEM圖,而Pd-P/C催化劑表面未發現Pd團聚現象,均為圖4(b)顯示的均勻分布的細小Pd顆粒.可以看出Pd-P/C催化劑由于P的作用,減少了Pd粒子的團聚,得到分布均勻且粒徑較小的Pd納米粒子.
以上分析可得,在Pd的形成生長過程中,P的摻入使Pd納米粒子分散良好,得到粒徑較小的Pd粒子,為該催化劑高催化活性的主要原因.
2.2 Pd-P/C中Pd負載量的優化
催化劑的活性不僅與活性物種的大小、形貌有關,同時也與催化劑表面活性物種的數量有關,為此,進一步考察了Pd負載量對催化劑活性的影響(見圖5).分別取含相同量Pd的100 mg 1%Pd-P/C,50 mg 2%Pd-P/C,33.3 mg 3%Pd-P/C,25 mg 4%Pd-P/C,20 mg 5%Pd-P/C 5組催化劑(1%,2%,3%,4%,5%均為Pd與催化劑的質量比,即Pd的負載量,制備時Pd和P原子比為1∶60保持不變),在10 mL反應液(c(FA)∶c(SF)=1∶9,總濃度為2 mol/L)中,30 ℃下進行反應.
圖5(a)顯示,隨著Pd-P/C中Pd負載量的增加,催化劑的TOF逐漸增大,當Pd負載量為3%時,TOF達到471 h-1.隨著Pd負載量進一步增加,TOF轉而下降,這是因為在有限的載體表面,過多的Pd使部分粒子發生團聚,從而導致催化劑整體活性下降.圖5(b)XRD表征顯示,3種催化劑的衍射峰基本一致,隨著Pd負載量增加,其衍射強度增加.
2.3 FA與SF濃度比的優化
為了探究SF對該反應的作用,本文考察了在Pd-P/C的催化作用下,保持FA與SF總濃度不變的前提下,FA與SF濃度比對反應速率的影響(見圖6).取20 mg 3%Pd-P/C催化劑,加入到10 mL反應液(純FA,c(FA)∶c(SF)=4∶1,1∶1,1∶4,1∶5,1∶9,純SF,總濃度為2 mol/L),30 ℃下反應.
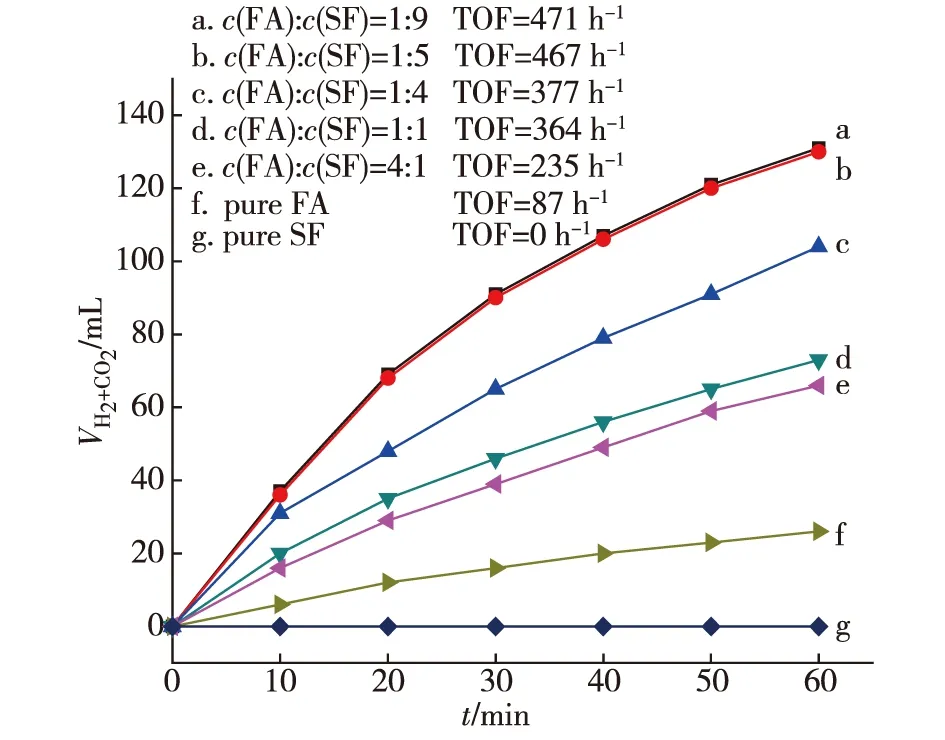
圖6 催化劑催化不同濃度比的FA和SF反應液所產生氣體的體積及對應TOF
從圖6可看出FA存在的前提下,所含SF濃度越高,反應產生的氣體量越多.然而當純SF作為反應液時,相同實驗條件基本無氣體產生,純FA反應有少量氣體逸出.FA與SF濃度比為1∶5和1∶9時產生氣體的量差別很小,出于FA量的考慮,取FA與SF濃度比為1∶5為最優比例.
為了考察SF的具體作用,在60 ℃下測定純FA、純SF及FA與SF濃度比1∶5時催化劑的反應活性.
由圖7可以看出,60 ℃下純FA、純SF在Pd-P/C催化作用下都能分解放出氣體.純FA條件下,初始反應速度較快,但30 min時反應停止.純SF反應速度最慢,卻能持續反應近5 h.當FA與SF濃度比1∶5時,反應速度明顯高于前兩者,1 h后停止反應.可以看出SF的存在不僅提高了FA的分解速率,而且延緩了催化劑的失活.

圖7 60 ℃下催化劑催化不同濃度比的FA與SF所產生氣體的體積
Pd-P/C催化劑可以催化分解FA和SF,溶液中FA分解存在2個競爭反應:
HCOOH→H2O+CO,
(1)
HCOOH→H2+CO2,
(2)
根據相關文獻[15]報道,推測FA與SF混合液分解的反應途徑為:
HCOO-+H2O→HCO3-+H2,
(3)
HCO3-+HCOOH→HCOO-+H2O+CO2,
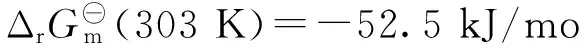
(4)
反應式(3)和(4)的總反應為式(2).
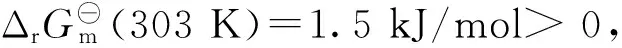
2.4 反應液總濃度的影響
此外,本實驗還考察了反應液總濃度對反應速率的影響.取20 mg 3%Pd-P/C催化劑,加入到10 mL反應液中(c(FA)∶c(SF)=1∶5,FA和SF的總濃度分別為2,4,6,8 mol/L),在30 ℃下其催化反應的TOF分別為467,565,560,498 h-1.實驗數據顯示FA與SA總濃度為4 mol/L時,催化劑的TOF最高,過高的總濃度反而會導致TOF下降.推測可能是由于溶液過于黏稠,水的相對含量減少[16],使催化劑活性降低.
2.5 動力學研究
在研究其動力學過程時,考察了Pd-P/C和Pd/C催化劑在不同反應溫度下對FA分解的催化活性.表1分別顯示出2種催化劑在不同溫度(303~333 K),c(FA)∶c(SF)=1∶5,總濃度為4 mol/L條件下催化FA分解的TOF.可以看出在303 K時,該Pd-P/C催化劑的催化活性是傳統的以NaBH4還原制得的Pd/C催化劑活性的3.5倍.圖8是各溫度下TOF的自然對數值對溫度倒數值的曲線圖(lnTOF vsT-1).根據Arrhenius公式計算出Pd-P/C和Pd/C催化反應活化能分別為18.63和26.69 kJ/mol,說明相比Pd/C催化劑,Pd-P/C使FA分解反應的活化能降低.
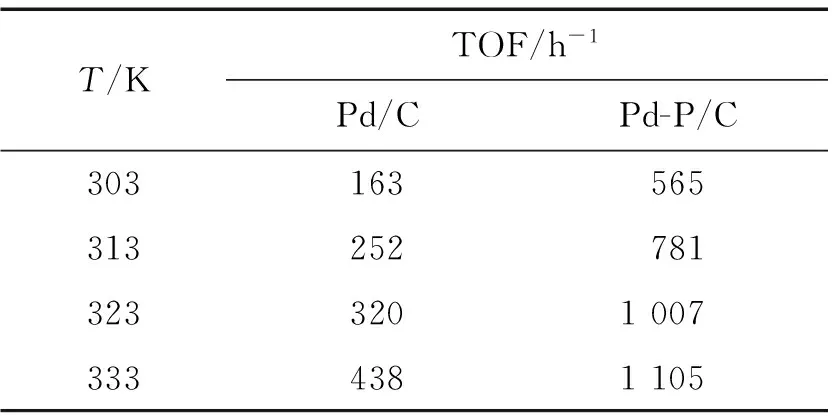
表1 不同溫度下Pd-P/C和Pd/C催化劑催化反應液分解制氫的TOF
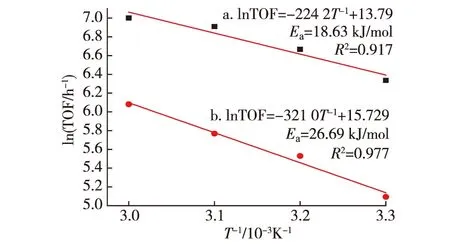
圖8 Pd-P/C(a)和Pd/C(b)催化下甲酸分解反應的ln TOF對T-1曲線
3 結 論
本文以NaH2PO2為還原劑,制備出一種用于高效催化FA分解制氫的Pd-P/C催化劑,經過優化,在30 ℃,c(FA)∶c(SF)=1∶5,FA和SF的總濃度為4 mol/L條件下,反應第1小時的TOF可達565 h-1.對比近期相關文獻報道的Pd基催化劑對FA分解的TOF值:Pd-NH2/MIL-125 (214 h-1,305 K)[17],Pd-Au-Dy/C[9](470 h-1,365 K),Pd9Ag1/rGO[18](526 h-1,298 K),顯然,Pd-P/C反應速率有優勢,且本催化劑為單金屬催化劑,制備方法簡單,NaH2PO2既為還原劑,又是添加劑P的來源.通過表征發現,相比于傳統NaBH4還原法制備的Pd/C催化劑,P的摻入,一定程度上阻止了Pd納米粒子的團聚,使Pd納米粒子更均勻地分散于AC表面,得到了粒徑較小的Pd納米粒子.動力學研究表明,相比于Pd/C催化劑,Pd-P/C催化劑使FA分解反應的活化能得以降低.雖然Pd-P/C催化劑催化活性較高,但其穩定性卻不理想,容易失活.查找催化劑失活的原因,提高Pd-P/C催化劑的實用性是本課題組今后需繼續努力的方向.
[1] Weisz P B.Basic choices and constraints on long-term energy supplies[J] Physics Today,2004,57(7):47-52.
[2] von Helmolt R,Eberle U.Fuel cell vehicles:status 2007[J].Journal of Power Sources,2007,165(2):833-843.
[3] Enthaler S,von Langermann J,Schmidt T.Carbon dioxide and formic acid—the couple for environmental-friendly hydrogen storage?[J].Energy & Environmental Science,2010,3(9):1207-1217.
[4] Zhou X,Huang Y,Xing W,et al.High-quality hydrogen from the catalyzed decomposition of formic acid by Pd-Au/C and Pd-Ag/C[J].Chemical Communications,2008 (30):3540-3542.
[5] Metin ?,Sun X,Sun S.Monodisperse gold-palladium alloy nanoparticles and their composition-controlled catalysis in formic acid dehydrogenation under mild conditions[J].Nanoscale,2013,5(3):910-912.
[6] Gan W,Snelders D J M,Dyson P J,et al.Ruthenium (II)-catalyzed hydrogen generation from formic acid using cationic,ammoniomethyl-substituted triarylphosphine ligands[J].ChemCatChem,2013,5(5):1126-1132.
[7] Chen A,Holt-Hindle P.Platinum-based nanostructured materials:synthesis,properties,and applications[J].Chem Rev,2010,110(6):3767-3804.
[8] Cuesta A,Cabello G,Osawa M,et al.Mechanism of the electrocatalytic oxidation of formic acid on metals[J].ACS Catalysis,2012,2(5):728-738.
[9] Zhou X,Huang Y,Liu C,et al.Available hydrogen from formic acid decomposed by rare earth elements promoted Pd-Au/C catalysts at low temperature[J].ChemSusChem,2010,3(12):1379-1382.
[10] Jia L,Bulushev D A,Podyacheva O Y,et al.Pt nanoclusters stabilized by N-doped carbon nanofibers for hydrogen production from formic acid[J].Journal of Catalysis,2013,307:94-102.
[11] Wang Z L,Yan J M,Wang H L,et al.Au@Pd core-shell nanoclusters growing on nitrogen-doped mildly reduced graphene oxide with enhanced catalytic performance for hydrogen generation from formic acid[J].Journal of Materials Chemistry A,2013,1(41):12721-12725.
[12] Wang Z L,Yan J M,Ping Y,et al.An efficient CoAuPd/C catalyst for hydrogen generation from formic acid at room temperature[J].Angewandte Chemie International Edition,2013,52(16):4406-4409.
[13] Mori K,Dojo M,Yamashita H.Pd and Pd-Ag nanoparticles within a macroreticular basic resin:an efficient catalyst for hydrogen production from formic acid decomposition[J].ACS Catalysis,2013,3(6):1114-1119.
[14] Huang Y,Zhou X,Yin M,et al.Novel PdAu@Au/C core-shell catalyst:superior activity and selectivity in formic acid decomposition for hydrogen generation[J].Chemistry of Materials,2010,22(18):5122-5128.
[15] Wang X,Qi G W,Tan C H,et al.Pd/C nanocatalyst with high turnover frequency for hydrogen generation from the formic acid-formate mixtures[J].International Journal of Hydrogen Energy,2014,39(2):837-843.
[16] Akiya N,Savage P E.Role of water in formic acid decomposition[J].AIChE Journal,1998,44(2):405-415.
[17] Martis M,Mori K,Fujiwara K,et al.Amine-functionalized MIL-125 with imbedded palladium nanoparticles as an efficient catalyst for dehydrogenation of formic acid at ambient temperature[J].The Journal of Physical Chemistry C,2013,117(44):22805-22810.
[18] Ping Y,Yan J M,Wang Z L,et al.Ag0.1-Pd0.9/rGO:an efficient catalyst for hydrogen generation from formic acid/sodium formate[J].Journal of Materials Chemistry A,2013,1(39):12188-12191.
Improved Highly Efficient Hydrogen Production from Formic Acid on a Pd/C Catalyst Doped by Phosphorus
JIAO Xiao-xin,ZHENG Xiao-xiao,ZHANG Hong-bin,LI Hai-yan*
(State Key Laboratory of Physical Chemistry of Solid Surfaces,National Engineering Laboratory for Green Chemical Productions of Alcohols-Ethers-Esters,College of Chemistry and Chemical Engineering,Xiamen University,Xiamen 361005,China)
A potent phosphorus-doped Pd nanocatalyst (Pd-P/C) for hydrogen generation from the formic acid (FA)-sodium formate (SF) mixtures has been successfully prepared via the reduction of NaH2PO2.Over this 3%Pd-P/C catalyst,the turn-over frequency (TOF) of 565 h-1was observed for a FA-SF mixture with a FA/SF concentration ratio of 1∶5 and the total concentration of 4 mol/L at 30 ℃.Compared with Pd/C synthesized with a NaBH4reduction method,the activity of Pd-P/C is 3.5 times as much.The results of the catalyst characterization demonstrated that the modification with P during the formation and growth of particles resulted in the well-dispersed fine Pd nanoparticles on carbon and enhanced the catalytic performance of the resulted catalyst.Kinetic studies showed that its reaction activation energy was 18.63 kJ/mol when utilizing Pd-P/C,much lower than utilizing Pd/C as a catalyst (reaction activation energy of 26.69 kJ/mol).
formic acid;hydrogen energy;NaH2PO2;Pd/C
2015-01-08 錄用日期:2015-03-20
國家重點基礎研究發展計劃(973計劃)(2011CBA00500);福建省自然科學基金 (E0510001)
焦曉新,鄭瀟瀟,張鴻斌,等.P促進Pd/C高效催化甲酸制氫的研究[J].廈門大學學報:自然科學版,2015,54(5):707-712.
:Jiao Xiaoxin,Zheng Xiaoxiao,Zhang Hongbin,et al.Improved highly efficient hydrogen production from formic acid on a Pd/C catalyst doped by phosphorus[J].Journal of Xiamen University:Natural Science,2015,54(5):707-712.(in Chinese)
10.6043/j.issn.0438-0479.2015.05.014
新能源材料專題
O 641
A
0438-0479(2015)05-0707-06
* 通信作者:hyli@xmu.edu.cn

