一株高抗氧化活性銀杏內生真菌SG0016的鑒定及其培養條件優化
葛 飛,石貝杰,高櫻萍,胡夢君,龔 倩,桂 琳
(1 安徽工程大學 生物與化學工程學院,安徽蕪湖241000;2 皖南醫學院微生物與免疫學教研室,安徽蕪湖241000)
植物內生真菌是生活在健康的植物組織內部,形成不明顯侵染的一類真菌[1]。因其能產生與宿主植物相似或相同的生理活性成分,從植物內生菌中尋找新型的天然產物和活性物質是目前一個重要的研究方向,受到了越來越廣泛的關注[2-4]。植物內生真菌分布非常廣泛,能產生多種不同化學結構的代謝產物,具有抗菌、抗氧化、抗腫瘤、抗病毒、殺蟲、植物生長調節和免疫調節等生物學活性[5],被認為是尋找新的生物活性物質的重要資源[6]。銀杏含有多種功效成分[7],是中國特有的珍稀植物。根據內共生的理論,銀杏內生真菌有可能產生與銀杏組織相同功效的活性成分,加強對其內生真菌的研究開發具有重要意義[8]。Xiao等[9]對80種分離自銀杏的內生真菌的抗菌活性進行了研究,其中15株內生菌能抑制至少一種測試菌,部分銀杏內生真菌的代謝產物具有較強的抑菌活性,是尋找和發現抗菌活性物質的潛在資源。鞠秀云等[10]采用氣-質聯用法對銀杏內生菌發酵液中揮發油成分進行了研究,分離出18個峰,被確認為17種化合物。申屠旭萍等[11]對銀杏內生真菌No.1028菌株代謝產物的抗真菌活性及其培養生物學特性進行了研究,發現其代謝產物對多種植物病原真菌具有較強的抑制作用。
銀杏葉是目前臨床使用較廣泛的中藥材之一,銀杏葉提取物制劑已成為全球植物藥制劑的重要品種[12]。本課題組前期研究結果發現,從銀杏葉中分離的一株內生真菌SG0016,其發酵液甲醇提取物具有較高的DPPH 自由基清除能力。本研究采用形態學和分子生物學相結合的方法對該菌株進行了鑒定,并對其抗氧化培養條件進行了優化,為該菌株的進一步應用和天然抗氧化劑的開發提供了理論依據和新途徑。
1 材料和方法
1.1 材 料
(1)菌株:內生真菌SG0016從銀杏健康葉片中分離、純化獲得。(2)斜面培養基:PDA 培養基(馬鈴薯200g,葡萄糖20g,瓊脂15g,水1 000mL)。(3)種子液和發酵基礎培養基:PDB 培養基(馬鈴薯200g,葡萄糖20g,水1000mL)。
1.2 儀器和試劑
1.2.1 主要儀器 QHZ-123B 型恒溫振蕩培養箱 (江蘇太倉市華美生化儀器廠);SW-CJ-2F 型超凈工作臺(蘇州安泰空氣技術有限公司);RE-25旋轉蒸發儀(上海亞榮生化儀器廠);Tecan SUNRISE酶標儀(瑞士Tecan公司);FD-83冷凍干燥機(美國SIM 公司);YXJ-2離心機(湘儀離心機儀器有限公司);TP600 型梯度PCR 儀(日本TaKaRa公司);DYCP-31DN 電泳儀(北京市六一儀器廠);JS-380C全自動數碼凝膠成像分析儀(上海培清科技有限公司)。
1.2.2 主要試劑 DPPH 試劑購自美國Sigma公司,葡萄糖等化學試劑均為分析純。
1.3 試驗方法
1.3.1 銀杏內生真菌的分離、純化方法 將采集的新鮮銀杏葉表面清洗干凈,在無菌操作臺中用95%乙醇漂洗2min,再用無菌水沖洗,然后用5.2%次氯酸鈉溶液漂洗10s,無菌水沖洗5次,使用無菌紗布將水分濾干。將銀杏葉切成0.5cm×0.5cm 小片,每個培養皿中植入3~4塊銀杏小葉片,置28℃恒溫培養箱中培養3~20d。當培養皿上從銀杏葉切片處向周圍長出菌絲時,采取尖端菌絲挑取法,將內生真菌轉移到新PDA 培養基上繼續培養、轉接、純化后,轉移到PDA 斜面試管中保存、備用。在整個分離過程中設置2個對照組,一是將最后一次沖洗的無菌水于平板中涂布均勻;二是將經表面消毒的銀杏葉片放入培養基中,靜置20 min 后取出葉片,將這2個對照組與放置銀杏葉片的培養皿一起培養,若這2個對照培養皿中未長出菌落則說明表面消毒徹底,進而確定分離出的真菌為銀杏內生真菌。
1.3.2 銀杏內生真菌發酵液提取物的制備 在250mL錐形瓶中加入100mL PDB培養基。滅菌后,將已培養好的內生真菌接種于PDB培養基。在25℃、170r/min條件下,搖床振蕩培養7d,濾去菌絲體備用,濾液用95%乙醇醇沉12h后,濃縮、凍干即為供試樣品。
1.3.3 形態學觀察 在無菌操作臺中挑取少許平板培養的菌絲置于載玻片上,壓好蓋玻片,確定無氣泡后,于光學顯微鏡下觀察、記錄、拍照。直接用導電膠粘少許菌絲,置于電子顯微鏡下觀察菌絲和孢子形態。
1.3.4 菌絲體DNA提取 采用苯酚氯仿法。將培養好的發酵液倒入1.5mL 離心管中,離心取菌絲體,凍干。加入200μL 苯酚、氯仿(比例為1∶1),振蕩1min,使有機相和水相充分混合。置于12 000 r/min離心機中,室溫離心5min。將上層水相轉移到一個新的離心管中,0℃下用2~3倍無水乙醇沉淀。在4℃、12 000r/min條件下,離心10min,收集沉淀。將收集到的沉淀用70%乙醇洗滌,室溫12 000r/min離心2min,吸去上清液,空氣干燥,將沉淀溶于30μL無菌水中。
1.3.5 PCR擴增 采用通用引物ITS1(5′-TCCGTAGGTGAACCTGCGG-3′)和ITS4(5′-TCCTCCGCTTATTGATATGC-3′),50μL PCR 擴增反應體系進行DNA 擴增。50μL PCR 擴增反應體系為模板DNA 1μL、dNTP(10mmol/L)1μL、引物各2 μL、10×Buffer 5μL、Taq酶1μL、去離子水40 μL。于94℃預變性5min后,反應程序為95℃變性30s、55℃退火40s、72℃延伸60s,共30個循環,最終于72℃延伸5min。PCR 產物用1%瓊脂糖凝膠電泳進行檢測,送交上海生工生物工程技術服務有限公司測序。
1.3.6 發酵液抗氧化活性的測定 用甲醇浸提SG0016菌株發酵液凍干物,將浸提液稀釋成5mg/mL。在96孔酶標板中分別加入不同樣品的溶液100μL和0.2mg/mL的DPPH 溶液100μL,每個樣品重復3次。樣品加入后,將酶標板置于酶標儀中,參數設置為(震蕩30s,溫度37℃、波長517 nm),在此條件下測定其吸光度(Ap)。以不加DPPH 的樣品空白吸光度(Ac)和加DPPH 但不加樣品(以甲醇100μL 代替樣品)的吸光度(Amax)為空白對照。自由基清除率(%)按下列公式計算:
自由基清除率(%)=[1-(Ap-Ac)/Amax]×100%
1.3.7 SG0016菌株產抗氧化活性成分培養條件優化 (1)較佳接種量的確定 以PDB培養基為發酵培養基,培養溫度為25℃,裝液量為100 mL(250 mL的三角瓶,下同),接種量分別為1%、3%、5%、10%和15%,培養時間為9d,按1.3.4所述方法測定發酵液抗氧化活性,每組處理3個平行。
(2)較佳培養溫度的確定 以PDB培養基為發酵培養基,裝液量為100 mL,接種量10%,培養溫度分別為20、23、25、28、30和33℃,培養時間為9 d,按1.3.4所述方法測定發酵液抗氧化活性,每組處理3個平行。
(3)較佳裝液量的確定 以PDB培養基為發酵培養基,培養溫度為25℃,裝液量分別為25、50、75、100和125mL,接種量10%,培養時間為9d,按1.3.4 所述方法測定發酵液抗氧化活性,每組處理3個平行。
(4)較佳培養時間的確定 將SG0016種子液按5%接種量接種于PDB培養基中,培養溫度為25℃,裝液量為100 mL,從發酵第3 天起,每隔24h取樣1次,按1.3.4所述方法測定發酵液抗氧化活性,直到第12天為止,每組處理3個平行。
(5)較佳碳源的確定 以蛋白胨(2%)為氮源,分別選用麥芽糖、蔗糖(分析純)、葡萄糖(分析純)、果糖、玉米淀粉、可溶性淀粉(分析純)、乳糖(分析純)、馬鈴薯作為供試碳源,含量均為3%。裝液量為100 mL,接種量10%,培養時間為8d,按1.3.4所述方法測定發酵液抗氧化活性,每組處理3個平行。
(6)較佳氮源的確定 以葡萄糖(3%)碳源,選擇蛋白胨、酵母浸出膏、豆渣粉、尿素、NH4Cl、硫酸銨、NH4NO3作為供試碳源,含量均為2%。裝液量為100mL,接種量10%,培養時間為8d,按1.3.4所述方法測定發酵液抗氧化活性,每組處理3個平行。
(7)正交試驗 在上述單因素試驗的基礎上,采用正交表L9(34),以菌株發酵液提取物DPPH 自由基清除率為指標,以接種量(A),培養溫度(B),裝液量(C)和培養時間(D)為試驗因素進行正交試驗。每個因素選取3個水平,每個水平進行3次重復試驗,篩選出各因素之間的最佳組合。
2 結果與分析
2.1 SG0016菌株鑒定結果
2.1.1 SG0016菌株形態學特征 菌株SG0016在PDA 平板上生長初期為白色絨毛狀,生長較為緩慢(圖1,A),培養5d左右,白色絨毛狀菌絲上生出暗綠色孢子并逐漸連成一片,在PDA 培養基上呈暗綠色,背面褐色,邊緣不整齊(圖1,B)。子囊殼散生或群生,卵形或近球形,表生(圖1,C)。子囊孢子亞球形或卵圓形(圖1,D)。

表1 正交試驗因素水平Table 1 Lists of factor and level indices for orthogonal analysis
2.1.2 SG0016 的分子生物學鑒定 利用引物ITS1和ITS4擴增得到大小為500~750bp的PCR產物(圖2),測序結果表明,目的片段長度為553 bp。將測定的堿基序列與GenBank中的已知序列進行比對分析,結果顯示,菌株SG0016 的rDNAITS擴增片段的堿基序列與Chaetomiumglobosumstrain OUCMBI101038序列相似性為99%,僅有6個堿基的差異。結合形態學和分子生物學鑒定結果,確定菌株SG0016為球毛殼菌,將其命名為ChaetomiumglobosumSG0016。
2.2 SG0016菌株液態培養條件優化
2.2.1 培養時間對發酵液DPPH 自由基清除率的影響 由圖3,A 可以看出,隨著培養時間的延長發酵液甲醇提取物對DPPH 自由基清除率逐漸升高。第8天時,清除率達到最高,為91.74%;培養時間繼續延長時,自由基清除率呈下降趨勢,在第12天時,自由基清除率降低到61.15%。因此,確定較佳培養時間為8d。
2.2.2 接種量對發酵液DPPH 自由基清除率的影響 微生物液態發酵過程中,接種量大小影響菌體生長速度和代謝產物的量。由圖3,B可見,接種量在1%~10%范圍內時,隨著接種量的增加,自由基清除率逐步升高;接種量為10%時,DPPH 自由基清除率最高,為90.16%。接種量進一步增大為15%時,發酵液的自由基清除能力反而降低到88.06%。原因能是由于接種量過大,菌體生長過快,反而抑制了具有抗氧化活性的代謝產物的積累。因此,確定較佳接種量為10%。
2.2.3 裝液量對發酵液DPPH 自由基清除率的影響 由圖3,C可以看出,隨著裝液量的增加,發酵液的自由基清除率呈現先增大后減小的趨勢。當裝液量為100mL時,發酵液DPPH 自由基清除率最高,為90.72%。當裝液量繼續增大時,自由基清除率又開始減小。因此,確定較佳的搖瓶裝液量為100mL。

圖1 菌株SG0016形態特征Fig.1 The colony and spore morphology of the SG0016strain
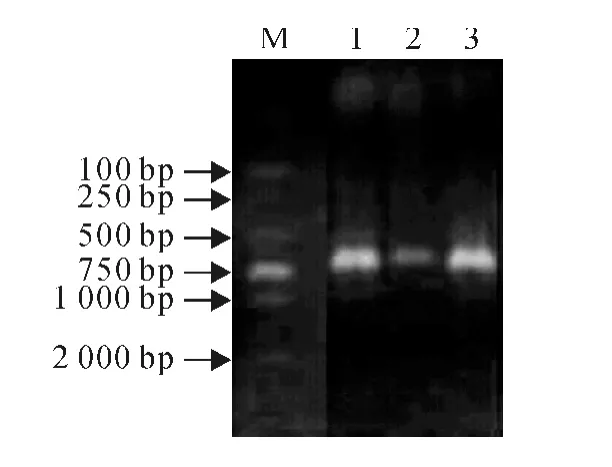
圖2 菌株SG0016PCR 產物凝膠電泳圖譜M.DL2000;1~3均為菌株SG0016Fig.2 The electrophoretogram of PCR products of the SG0016strain M.DL2000;1-3were PCR products of SG0016strain
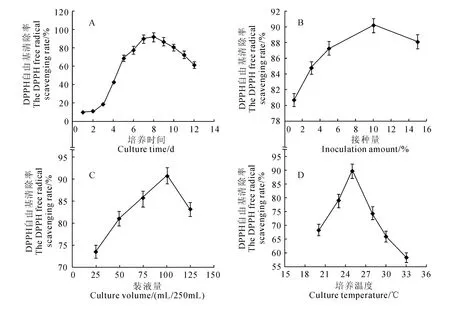
圖3 培養條件對發酵液DPPH 自由基清除率的影響Fig.3 Effect of culture conditions on the DPPH free radical scavenging rate of the broth
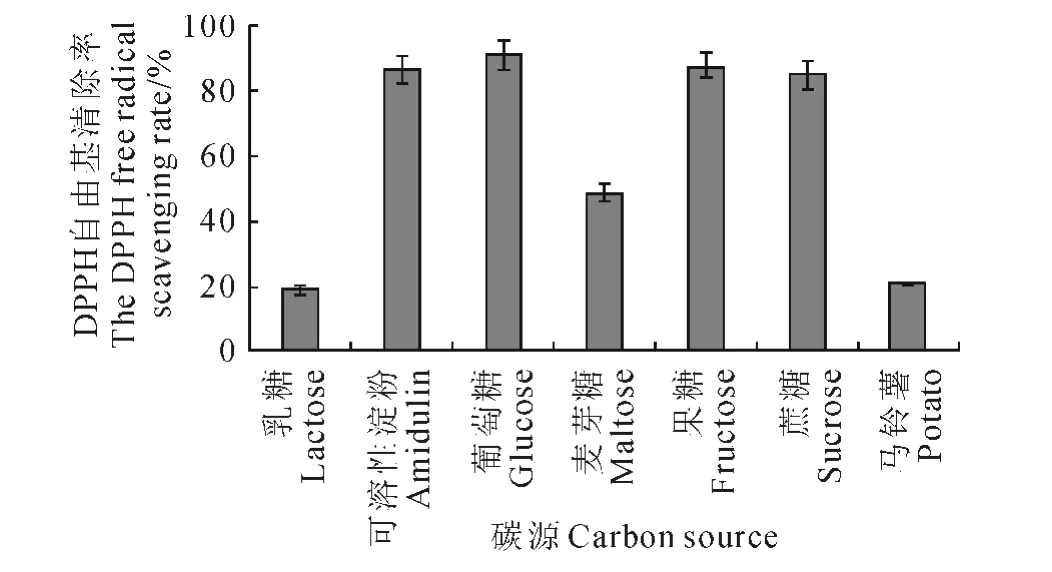
圖4 碳源對發酵液DPPH 自由基清除率的影響Fig.4 Effect of carbon sources on the DPPH free radical scavenging rate of the broth
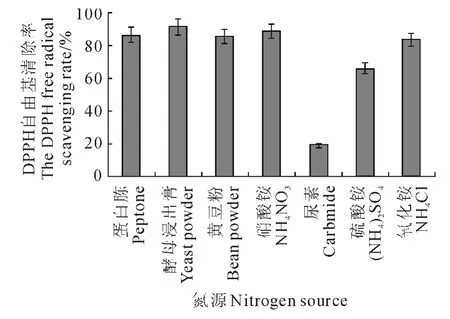
圖5 氮源對發酵液DPPH 自由基清除率的影響Fig.5 Effect of nitrogen sources on the DPPH free radical scavenging rate of the broth
2.2.4 培養溫度對發酵液DPPH自由基清除率的影響 由圖3,D可以看出,培養溫度在20~25℃范圍時,隨溫度的升高,SG0016菌株發酵液清除DPPH自由基能力隨之增大。培養溫度為25℃,自由基清除率達到最大,為89.60%。溫度繼續升高時,自由基清除率下降,說明培養溫度過高可能會抑制SG0016菌株具有抗氧化活性代謝產物積累。因此,確定較佳最佳培養溫度為25℃。
2.2.5 碳源對發酵液DPPH自由基清除率的影響 比較了7種不同碳源對球毛殼菌SG0016菌株發酵液DPPH 自由基清除能力的影響,結果(圖4)表明,SG0016菌株可利用試驗提供的7種碳源。當以葡萄糖為碳源時,發酵液的DPPH自由基清除率最高,為90.86%;其次為果糖和可溶性淀粉,自由基清除率分別為87.37%和86.75%;乳糖作為碳源時菌株自由基清除能力最差,僅為18.68%。因此,選擇葡萄糖為球毛殼菌SG0016菌株進行液態發酵的較佳碳源。
2.2.6 氮源對發酵液DPPH自由基清除率的影響 在碳源試驗的基礎上,比較了7種不同氮源對球毛殼菌SG0016菌株發酵液DPPH 自由基清除能力的影響。由圖5可以看出,以酵母浸出膏為氮源時,發酵液的DPPH 自由基清除率最高,為91.53%。以尿素為氮源時,效果最差,自由基清除率僅為18.97%。因此,選擇酵母膏作為較佳氮源。
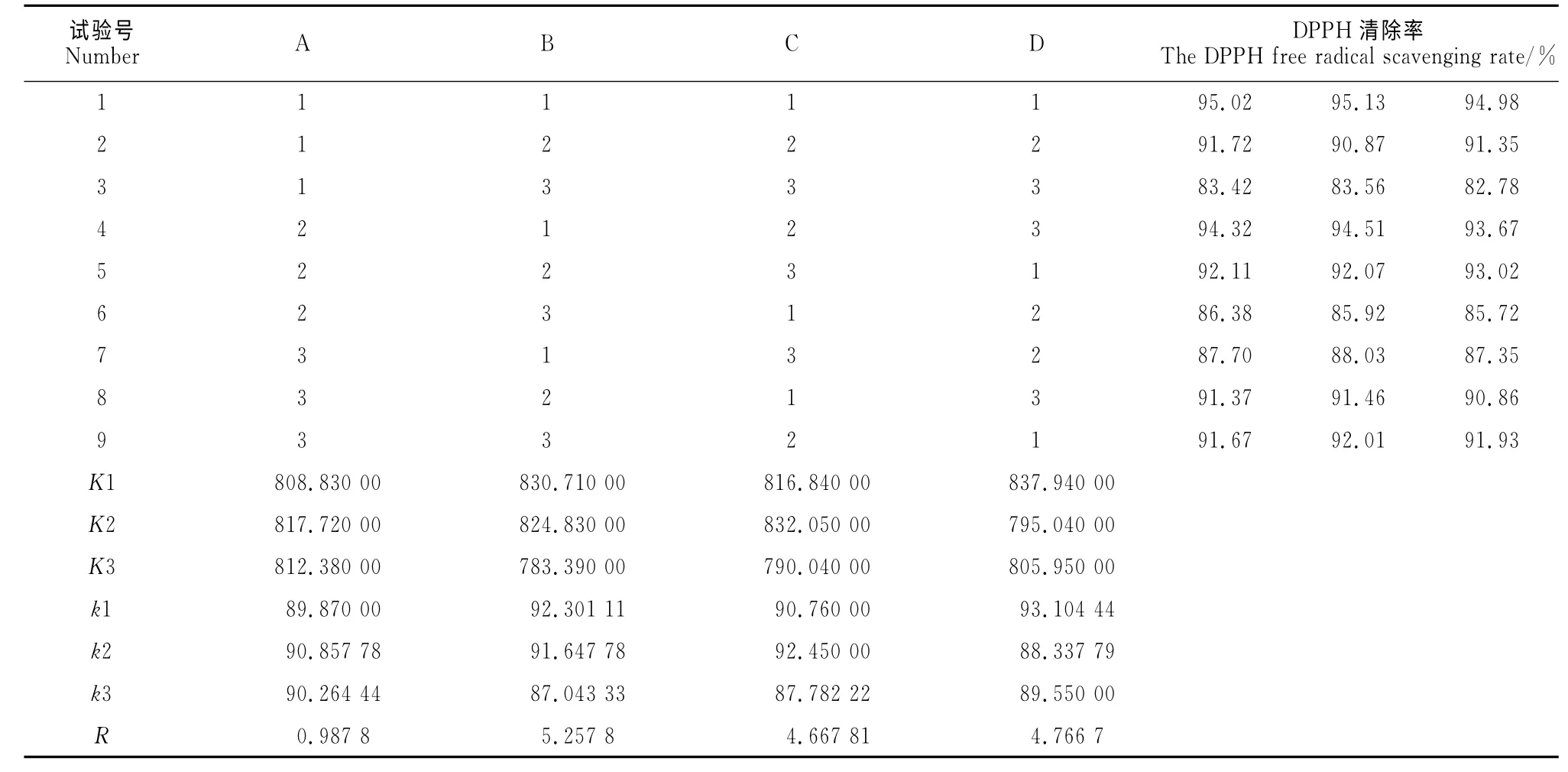
表2 培養條件正交試驗結果Table 2 Analysis of orthogonal experiments of culture conditions
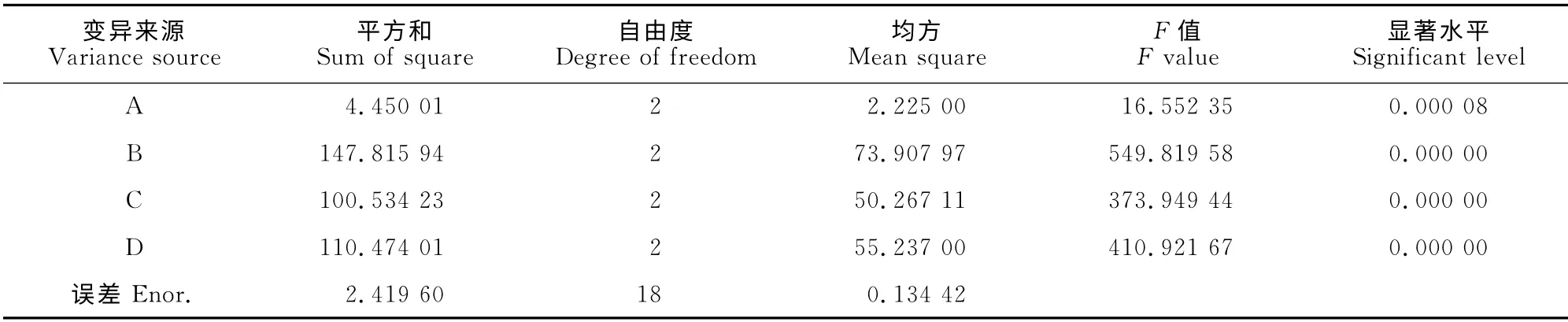
表3 正交設計方差分析表(完全隨機模型)Table 3 Variance analysis of orthogonal experiment(total random model)
2.2.7 正交試驗結果 以接種量、培養溫度、裝液量和培養時間為影響因素的四因素三水平的正交試驗結果及方差分析結果見表2和表3。由表2可以看出,B(培養溫度)的極差最大,即對菌株發酵液DPPH 自由基清除率影響較大,其次是培養時間(D)、裝液量(C)和接種量(A)。
利用DPS統計軟件進行正交設計方差分析(完全隨機模型),發現進行試驗的4個因子在99%置信度下對指標的影響均達到極顯著水平(P<0.01)。因此,對于該菌株發酵液中積累清除DPPH生物活性成分的最佳培養條件組合為B1D1C2A2,即培養溫度23℃、培養時間7d、裝液量100mL和接種量10%。
2.2.8 驗證試驗 采用正交試驗獲得的最佳發酵條件和單因素試驗獲得的較佳碳源、氮源進行球毛殼菌SG0016 菌株液體發酵試驗,測定發酵液的DPPH 自由基清除率(取3 次試驗的平均值)為96.17%,比優化前提高了23.6%,說明上述試驗獲得的最佳培養條件和碳、氮源有利于SG0016菌株發酵液中抗氧化活性成分的分泌和積累。
3 討 論
在有關植物內生真菌研究中,經常側重于活性菌株的篩選,而忽略真菌的進一步分類鑒定,進而導致大量的重復研究,因此,確定植物內生真菌的種屬地位顯得尤為必要。本試驗經形態學和分子生物學鑒定,確定SG0016 菌株為球毛殼菌,將其命名為ChaetomiumglobosumSG0016,杜少康等[13]也從不同地區的銀杏葉片中分離出多株毛殼菌屬內生真菌。球毛殼菌具有多種生物活性[14-15],國內外對球毛殼菌,特別是銀杏內生球毛殼菌的研究報道較少。李虎強等[16]從銀杏內生真菌球毛殼菌的次生代謝產物中分離得到了12種化合物,找到了抗菌活性較高的膠霉毒素,但并沒有獲得高抗氧化活性的代謝產物。劉小莉等[17]在對銀杏內生真菌抗氧化活性的研究中發現,銀杏內生炭角菌YX-28的提取物具有較強的抗氧化活性,在β-胡蘿卜素/亞油酸試驗中,其400μg/mL的甲醇粗提物具有72.9%的抑制活性。由于球毛殼菌SG0016菌株具有較高的抗氧化活性,因此對其進一步的開發利用具有重要的理論和實踐價值。
本研究在單因素試驗的基礎上,通過正交試驗,確定球毛殼菌SG0016菌株液體發酵的最佳培養條件為培養溫度23℃、培養時間7d、裝液量100mL和接種量10%。在最佳培養條件下,SG0016 菌株發酵液的DPPH 自由基的清除率可達96.17%,比優化前提高了23.6%。
[1]REN A ZH(任安芝),GAO Y B(高玉葆).Plants endophyte,a class of broad prospects for application of microbial resources[J].Microbiology(微生物學通報),2001,28(6):90-93(in Chinese).
[2]GARY S,BRYN D.Bioprospecting for microbial endophytes and their natural products[J].MicrobiologyandMolecularBiologyReview,2003,67(4):491-502.
[3]YANG Y H(楊銀河),YE Y(葉 燁),LI CH Y(李成云),etal.Chemical constituents of endophytePenicilliumsp.DCS82fromDaphniphyllumlongeracemosum[J].Guihaia(廣西植物),2013,33(4):571-574(in Chinese).
[4]DENG H H(鄧慧華),HONG W(洪 偉),WU CH ZH(吳承禎),etal.Separation,selection and identification on producing lipid strains of endophytic fungi fromPinusmassoniana[J].JournalofPlantResourcesandEnvioronment(植物資源與環境學報),2014,23(2):27-33(in Chinese).
[5]GUTIERREZ R M P,GONZALEZ A M N,RAMIREZ A M.Compounds derived from endophytes:A review of phytochemistry and pharmacology[J].CurrentMedicinalChemistry,2012,19(18):2 992-3 030.
[6]DEBBAB A,ALY AH,PROKSCH P,etal.Bioactive secondary metabolites from endophytes and associated marine derived fungi[J].FungalDiversity,2011,49(1):1-12.
[7]LIU X L(劉小莉),DENG M SH(董明盛).Study on endophytic fungus isolated from ChineseGinkgobilobaL.[J].FoodScience(食品科學),2007,28(6):205-208(in Chinese).
[8]DENG ZH SH(鄧振山),ZHAO L F(趙龍飛),ZHANG W W(張薇薇),etal.Isolation of endophytic fungi fromGinkgobilobaL.and their antagonism on theValsamalimiyabe et Yamada[J].ActaBot.Boreal.-Occident.Sin.(西北植物學報),2009,29(3):608-613(in Chinese).
[9]XIAO Y,LI H X,WANG J X,etal.Antifungal screening of endophytic fungi fromGinkgobilobafor discovery of potent anti-phytopathogenic fungicide[J].FEMSMicrobiologyLetters,2013,339(2):130-136.
[10]JU X Y(鞠秀云),FENG Y J(馮友建),CHEN F M(陳鳳美),etal.Volatile constituents and their fibrinolytic activity of endophytic fungusFusariumsp.GI024fromGinkgobiloba[J].Microbiology(微生物學通報),2006,33(6):8-11(in Chinese).
[11]SHENTU X P(申屠旭萍),CHEN L ZH(陳列忠),YU X P(俞曉平).Anti-fungi activities and cultural haracteristics of gingko endophytic fungus No.1028[J].ActaPhytophylacicaSinica(植物保護學報),2007,34(2):147-152(in Chinese).
[12]WANG S J(汪素娟),KANG A(康 安),DI L Q(狄留慶),etal.Progress in pharmacokinetic study on main active ingredients ofGinkgo bilobaleaf extract[J].ChineseTraditionalandHerbalDrugs(中草藥),2013,44(5):626-631.
[13]DU SH K(杜少康),CHEN SH L(陳雙林),LIN D(林 岱),etal.Diversity of endophytic fungi in leaves ofGinkgobiloba[J].Mycosystema(菌物學報),2009,28(4):504-511(in Chinese).
[14]XIE H(謝 輝),CHEN SH L(陳雙林).Antioxidant activity of endophyticChaetomiumglobosumfromEucommiaulmoides[J].Mycosystema(菌物學報),2009,28(4):591-596(in Chinese).
[15]QIN J C,ZHANG Y M,GAO J M,etal.Bioactive metabolites produced byChaetomiumglobosum,an endophytic fungus isolated fromGinkgobiloba[J].BioorganicandMedicinalChemistryLetters,2009,19(6):1 572-1 574.
[16]李虎強.銀杏內生真菌球毛殼菌次生代謝產物及抑菌活性的研究[D].陜西楊陵:西北農林科技大學,2011.
[17]LIU X L(劉小莉),CHEN X H(陳曉紅),DONG M SH(董明盛).Antioxidant activity of an endophyticXylariasp.fromGinkgobilob[J].JournalofNanjingAgriculturalUniversity(南京農業大學學報),2008,31(1):102-106(in Chinese).

