殼寡糖對Hela細胞的增殖抑制與誘導凋亡
韓紹芳,周艷芬,2,倪志華,2,武金霞,2,王振山,2
(1.河北大學 生命科學學院,河北 保定 071002;2.河北省生物工程技術研究中心,河北 保定 071002)
殼寡糖(chitooligosaccharide,COS)是由殼聚糖(chitosan)經水解處理后得到的一種低聚糖.因其分子質量較低,水溶性好,易被生物體吸收和降解,因此,在生物體內具有多種生物學活性.研究報道,COS能夠調節腸道微生態[1-6],增強機體免疫力[4,7-9],促進骨折愈合[10],抗疲勞并增加運動的耐受力[11-13],降血糖[14]及抗腫瘤作用[15]等.殼寡糖的制備方法包括物理降解法、化學降解法以及酶降解法等.這些制備方法通常得到的殼寡糖分子質量大小不一,因此很難確定殼寡糖的生物學功能并進一步被開發利用.本研究采用金屬配位氧化法降解殼聚糖對得到的產物進一步采用732型陽離子交換樹脂去除金屬離子并對產物進行純化,得到的COS聚合度為4,經檢測其能夠有效誘導人肺腺癌細胞A549凋亡[16],且對人腎上皮細胞293T無明顯抑制作用.為了進一步明確自制的COS對細胞凋亡的誘導作用及作用機制,本研究以Hela細胞為材料,經COS處理后,對細胞形態及細胞凋亡相關蛋白進行檢測,明確COS對細胞的增殖抑制作用和對細胞凋亡的誘導作用,為COS的抗腫瘤作用及其開發利用提供實驗支持.
1 材料與方法
1.1 材料與儀器
殼寡糖,本室自制[16];二甲基亞砜(DMSO),Solarbio公司;Hela細胞,河北省腫瘤醫院科研中心;3-(4,5-二甲基噻唑-2)-2,5-二苯基四氮唑溴鹽(MTT)、Wright's-Giemsa染液,Gibco公司;吖啶橙-溴乙錠(AOEB)試劑盒,北京索萊寶科技有限公司;HRP-羊抗兔、HRP-兔抗鼠補體C3(C3)抗體、二氨基聯苯胺(DAB)顯色劑,Invitrogen公司;兔抗人Bcl-2、鼠單抗Bax、兔抗人Survivin,Santa Cruz公司;異硫氰酸熒光素標記的膜聯蛋白V(AnnexinV-FITC)凋亡檢測試劑盒,武漢博士德生物工程公司.
CSANVAC冷凍干燥機,Gene公司;M 680 酶標儀,Bio-Rad 公司;倒置顯微鏡CKX41、熒光顯微鏡BX53,Olympus公司;流式細胞儀FC500,Beckman Coulter公司.
1.2 實驗方法
1.2.1 細胞培養
Hela細胞培養于含體積分數10%的新生胎牛血清、100 U/mL 青霉素、100 U/mL 鏈霉素的DMEM(dulbecco's modified eagle medium)高糖培養基中,置于37 ℃、飽和濕度、體積分數為5%的CO2培養箱中培養,每2~3d換液傳代培養.
1.2.2 MTT 法檢測細胞的增值抑制率
取處于對數生長期且臺盼藍拒染率大于95%的Hela細胞,2 000r/min離心10 min,用含體積分數10%胎牛血清的DMEM 高糖培養液將沉淀細胞濃度調為1×105/mL 細胞懸液,每孔加細胞懸液100μL(1×104個細胞)接種于96孔培養板,于37 ℃、飽和濕度、體積分數為5% CO2培養箱中培養,貼壁后吸出培養液,分別加入質量濃度為1.0,2.0,3.0,4.0,5.0,6.0,7.0,10.0mg/mL的COS和不含COS的培養液各200μL,每組設5個復孔,調零孔不加含有Hela細胞的培養液200μL.混勻后分別繼續培養12h和24h,向各孔中加入20μL MTT(質量濃度為5.0 mg/mL),相同條件下繼續培養4h,每孔加入DMSO 150μL,震蕩10min,使形成的甲臜顆粒充分溶解后,于酶標儀490nm 波長測定吸光度值(A 值),按以下公式計算細胞增殖抑制率:
細胞增殖抑制率=(1-A實驗組/A對照組)×100%.
1.2.3 Wright's-Giemsa染色觀察細胞形態
細胞培養至對數生長期時,用質量分數為0.25%的胰酶(含質量分數為0.01%的EDTA)消化并計數后,調整細胞密度為5×104/mL,加入到盛有蓋玻片的6 孔板中,補足2 mL 的完全培養液,每孔加入約1×105個細胞,置于37 ℃、飽和濕度、體積分數為5% CO2培養箱中過夜培養后,吸去培養液,用PBS 洗3次,每次2min,實驗組更換含有5.0mg/mL COS的培養液,陰性對照組加入不含COS的培養液,每組設5個復孔,相同條件下繼續培養24h 后,再次用PBS 洗滌3 次,每次2 min,體積分數95%的乙醇固定10min,Wright's-Giemsa染色20min,顯微鏡下觀察.
1.2.4 AO-EB染色法觀察細胞凋亡形態
按1.2.3方法處理細胞并爬片,分別用PBS洗3次,加入AO/EB 染色液2mL(1mL PBS含有20μL的AO/EB),染色5min,吸出染液,PBS洗3次,立即將各組Hela細胞爬片置于熒光顯微鏡下觀察細胞的形態變化,并拍照.
1.2.5 Annexin V-FITC/PI雙染法定量分析細胞的凋亡率
將處于對數生長期的細胞以5×105/mL 的密度接種于25mL培養瓶中,細胞過夜貼壁后,實驗組加入含有質量濃度為5.0mg/mL的COS培養液3mL,對照組加入不含COS的等量完全培養液,培養24h后.按照AnnexinV-FITC及PI試劑盒操作步驟,用不含EDTA 的胰酶消化收集,2 000r/min,離心5min.用冷PBS 洗滌細胞2次(2 000r/min,5min).超純水1:4稀釋結合緩沖液,以稀釋的結合緩沖液重懸細胞,調整細胞濃度為1×106/mL.取195μL 細胞懸液,加入5μL AnnexinV-FITC 混勻,4 ℃避光條件下孵育15min,PBS洗細胞1次,再以190μL稀釋的結合緩沖液重懸,加入10μL PI輕輕混勻于4 ℃避光條件下孵育5min,立即上流式細胞儀進行檢測,光源為488nm 氬離子激光器,FITC受激發后發綠色熒光,PI發紅色熒光.實驗重復3次,計算細胞凋亡率.
1.2.6 免疫組織化學法檢測凋亡相關蛋白的表達情況
按1.2.3方法處理細胞并爬片,加入體積分數4%的多聚甲醛(PFA)室溫固定30 min.用體積分數0.5% Triton X-100孵育20min,勿洗,直接用5mg/mL 的牛血清白蛋白(BSA)37 ℃封閉30min,分別加入稀釋倍數為1:400的Bax,Bcl-2,Survivin-抗1mL,4 ℃孵育過夜,PBS洗3次,每次2min.然后分別加入稀釋倍數為1:400的HRP-羊抗鼠抗體和HRP-兔抗鼠補體C3(C3)抗體1mL,37 ℃避光孵育1h,PBS洗3次,每次2min.DAB顯色8min,10μg/mL蘇木素復染5min,顯微鏡下觀察.
1.2.7 免疫組化染色陽性結果評估
陽性細胞產物染色呈黃色至棕黃色,主要定位于細胞胞質內.采用雙盲法隨機選擇5個典型視野,每個視野內隨機計數50個細胞,根據陽性細胞百分率(A)及陽性細胞著色強度(B)進行免疫組化評分[13,17].陽性細胞百分率A 分為5個等級:0~1%為0分,2%~10%為1分,11%~50%為2分,51%~80%為3分,81%~100%為4分;陽性細胞顯色強度B 分為4個等級:0分為陰性,1分為弱陽性,2分為陽性,3分為強陽性,免疫組化最后得分(IHS):每個視野內陽性細胞著色細胞百分率與著色程度相乘得分即為該視野的最后得分(IHS=A×B).每張片子5個視野的平均分值為該標本的最后染色分值,將最后平均染色分值小于1者記為染色陰性標本,大于1者記為染色陽性標本.
1.2.8 統計學分析
采用SPSS19.0軟件進行統計學分析,實驗數據用均數±標準差(x±s)表示,組間比較采用單因素方差檢驗,以P<0.05為差異有統計學意義.
2 結果
2.1 殼寡糖對Hela細胞的增殖抑制作用
與陰性對照組相比較,COS處理組細胞12h和24h后,在1.0 ~5.0 mg/mL 內,隨著作用時間的延長、質量濃度的升高,COS對Hela細胞增殖的抑制率逐漸增強,且呈量效和時效的依賴關系,當質量濃度為5.0mg/mL并作用24h時,COS對Hela細胞的增殖抑制率達到52.15%(P<0.01),且差異顯著(表1),COS質量濃度在6.0,7.0,10.0mg/mL時,處理12h 和24h后,Hela細胞增殖抑制率均有所下降,且抑制水平相當.因此,本研究選用COS質量濃度為5.0mg/mL處理24h進行后續實驗.
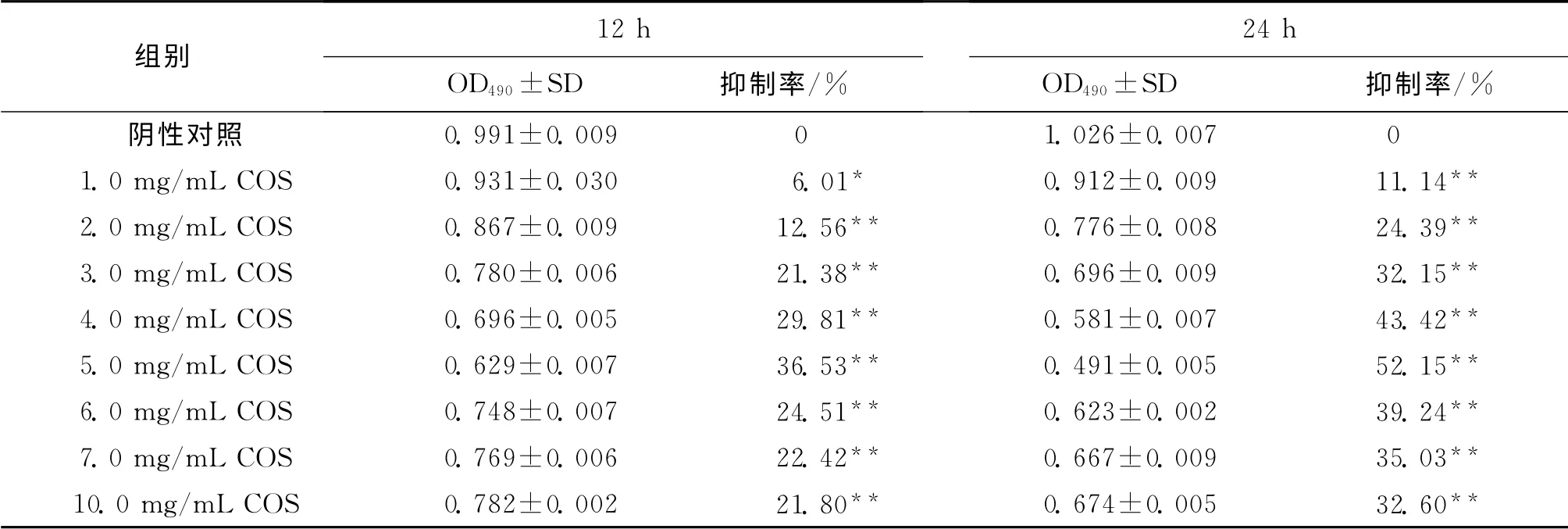
表1 COS對Hela細胞增殖的抑制作用Tab.1 Effect of inhibiting proliferation by COS on Hela cell
2.2 殼寡糖對Hela細胞凋亡形態學的影響
COS處理細胞24h后,經Wright's-Giemsa染色觀察,對照組細胞膜完整,核仁及染色質分布在細胞核中,實驗組細胞數量明顯減少,細胞形態發生變化,主要表現為細胞貼壁能力減弱、細胞質萎縮、體積變小、部分呈現圓形、出現凋亡小體(圖1).
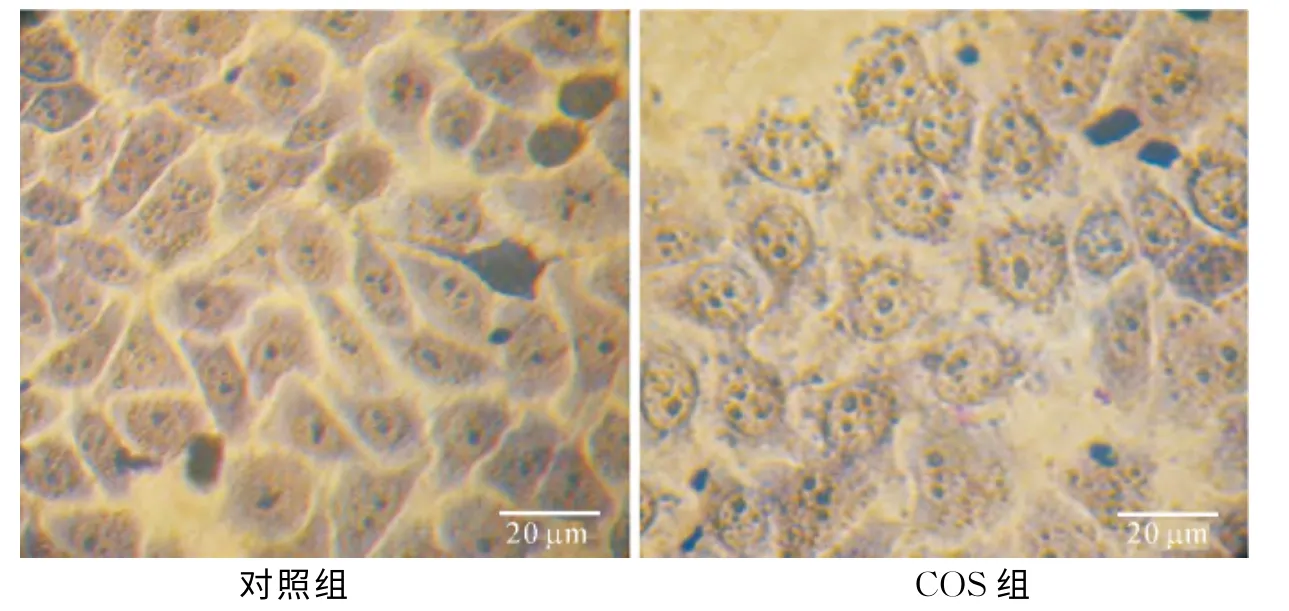
圖1 Wright's-Giemsa染色結果Fig.1 Results of Wright's-Giemsa staining
經AO-EB染色,熒光顯微鏡下觀察(圖2),對照組細胞形態正常,核著色均勻,為綠色熒光,實驗組觀察到部分核染色質固縮狀和圓珠狀,為早期凋亡細胞,部分核染色質出現橘紅色,為晚期凋亡細胞.這些結果表明,經COS處理的Hela細胞在形態上出現了細胞凋亡,說明COS能夠誘導Hela細胞凋亡.
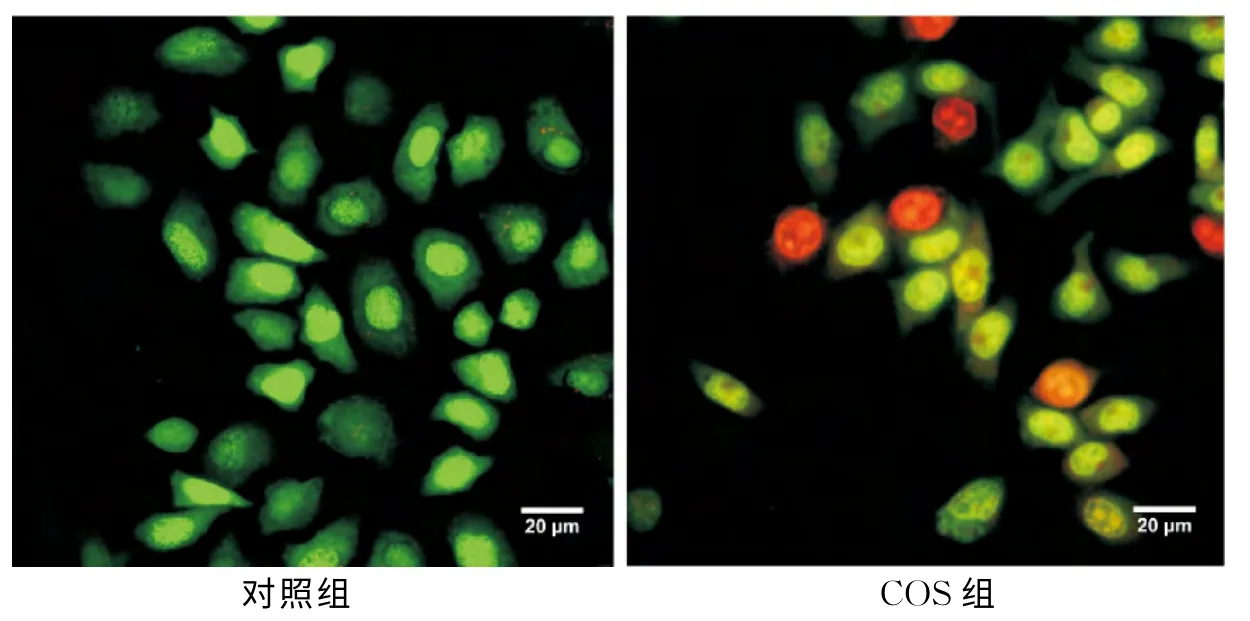
圖2 AO-EB染色結果Fig.2 Results of AO-EB staining
2.3 殼寡糖誘導Hela細胞凋亡率的定量分析
COS處理細胞經AnnexinV-FITC/PI染色,流式細胞儀檢測其凋亡率及壞死率(圖3).圖中左下象限(LL)代表活細胞量(FITC-/PI-),左上象限(UL)代表細胞處理過程中出現的損傷細胞(FITC-/PI+),右下象限(LR)代表早期凋亡細胞(FITC+/PI-),右上象限(UR)代表晚期凋亡細胞(FITC+/PI+).對照組與COS組相應的各象限細胞存活狀態見表2.經COS 處理后的實驗組細胞凋亡率為31.75%,壞死率為18.79%,P<0.05,差異具有統計學意義.
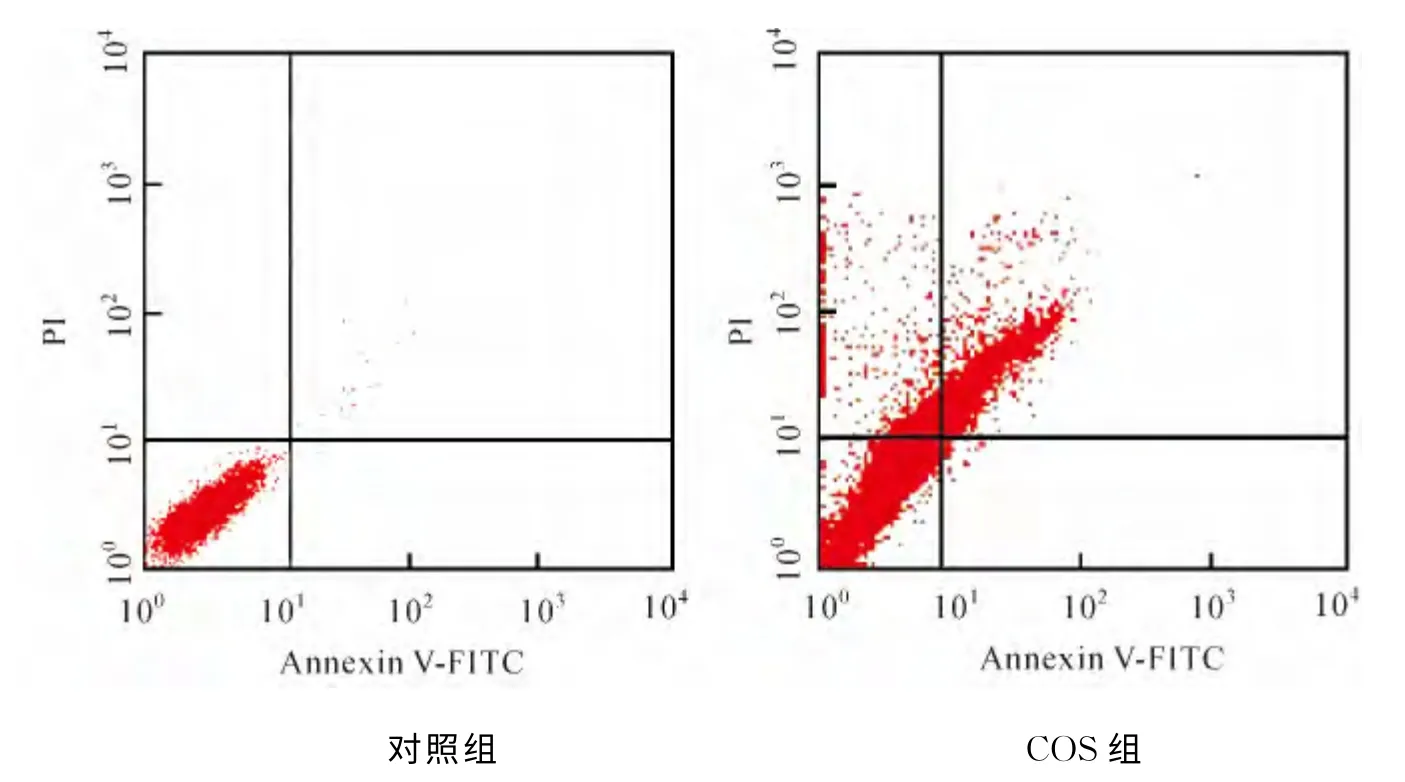
圖3 AnnexinV-FITC/PI雙染結果Fig.3 Results of AnnexinV-FITC/PI duble staining

表2 AnnexinV-FITC/PI雙染細胞存活狀態統計Tab.2 Statistics of AnnexinV-FITC/PI double staining of cell survival state
2.4 殼寡糖對Hela細胞中Bax,Bcl-2,Survivin表達量的影響
細胞爬片經COS處理后,分別檢測Bax,Bcl-2,Survivin蛋白表達量(圖4),與對照組相比,COS組的Bax蛋白細胞質著色增強,表明Hela經COS處理后細胞質中Bax表達量增加;Bcl-2蛋白與Survivin蛋白COS組細胞質著色程度較對照組明顯減輕,表明Hela細胞經COS處理后細胞質中Bcl-2,Survivin表達量均降低.按1.2.7方法對免疫組化得分進行評估(表3),COS組的Bax IHS值明顯高于對照組,Bcl-2,Survivin IHS值明顯低于對照組,說明經COS處理后Hela細胞內Bax表達量明顯上調,而Bcl-2和Survivin表達量明顯下調.

表3 陽性細胞記數及免疫組織化學評分(5個視野)Tab.3 Positive cell count and immunohistochemistry score(five horizons)
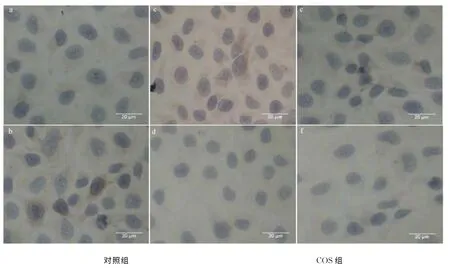
圖4 COS處理Hela細胞后對Bax,Bcl-2,Survivin表達量的影響Fig.4 Impact on Bax,Bcl-2,Survivin expression of Hela cells after COS treatment
3 討論
COS是由2~10個氨基葡萄糖或N-乙酰氨基葡萄糖經β-1,4糖苷鍵連接而成的線性寡糖,基于其優良的生物學特征,近年來被人們廣泛關注.已有研究證實,COS能夠誘導白血病HL-60細胞[18]、結腸癌LoVo細胞[15]凋亡,能夠抑制腎腫瘤細胞OS-RC-2[19]、肝癌SMMC-7721細胞[20-21],S180肉瘤細胞[22]、膀胱癌細胞[23]的增殖并且促進其凋亡等.本實驗采用金屬配位氧化法制備的平均聚合度為4的COS作用于Hela細胞,通過MTT 法,確定5.0mg/mL的COS作用24h,對Hela細胞的增殖抑制率達到52.15%.作者進一步采用Wright's-Giemsa染色、AO-EB染色觀察COS處理后細胞形態學上的變化,結果表明,COS組細胞產生了凋亡現象,如細胞體積變小,細胞核固縮,變圓,出現凋亡小體,AO-EB 染色出現早期和晚期凋亡細胞.采用流式細胞技術定量分析COS誘導Hela細胞凋亡情況,結果表明,細胞凋亡率為31.75%,且具有統計學意義.以上實驗結果表明,自制的COS可抑制Hela細胞增殖并且能夠誘導細胞凋亡.
細胞凋亡是一種主動的程序性死亡,涉及一系列基因的激活、表達以及調控等.在細胞凋亡相關蛋白的研究中,Bcl-2蛋白家族備受關注.按其對凋亡正、負調控作用,可將Bcl-2家族成員分為兩類:一類為凋亡促進蛋白,如Bax,Bcl-xs,Bad等;另一類為凋亡抑制蛋白,如Bcl-2和Bcl-x2,Bcl-xl等[22].Bcl-2為重要的抗凋亡蛋白,對細胞凋亡擔負著重要的作用[24-25].Bax可以與Bcl-2形成異源二聚體,從而阻止Bcl-2的抗凋亡作用[26].Survivin是近來發現的IAP家族新成員[27].研究表明,Survivin是迄今發現最強的凋亡抑制因子[28],其可直接作用于效應蛋白caspase-3和caspase-7,也可通過P21間接抑制caspase[29],從而阻斷細胞的凋亡過程.誘導腫瘤細胞凋亡是治療腫瘤的一種手段.本研究采用免疫組織化學法,發現自制的COS處理Hela細胞后Bax表達量上調,Bcl-2和Survivin表達量下調,表明COS對Hela細胞作用是通過抑制抗凋亡蛋白Bcl-2的表達,抑制caspase家族的抑制劑Survivin蛋白的表達,上調促凋亡蛋白Bax的表達從而促進腫瘤細胞的凋亡,為COS抗腫瘤作用機制及其開發利用提供實驗支持.
[1] 嚴欽,沈月新,王造.殼寡糖的制備及其抑菌性能研究[J].食品研究與開發,2003,24(2):26-29.YAN Qin,SHEN Yuexin,WANG Zao.Preparation of chitooligosaccharide and its antimicrobial activity[J].Food Research and Developent,2003,24(2):26-29.
[2] 劉碧源,高仕瑛,李邦良,等.殼寡糖抗菌活性的實驗研究[J].中國生化藥物雜志,2003,24(2):73-75.LIU Biyuan,GAO Shiying,LI Bangliang,et al.Study on antimicrobial activity of chitooligosaccharide[J].Chinese Journal of Biochemical Pharmaceutics,2003,24(2):73-75.
[3] 竺國芳,趙魯杭.幾丁寡糖和殼寡糖的研究進展[J].中國海洋藥物,2000,19(3):43-46.ZHU Guofang,ZHAO Luhang.The progress about study of N-acetyl-chitooligosaccharides and chitooligosaccharides[J].Chinese Journal of Marine Drugs,2000,19(3):43-46.
[4] 王秀武,杜昱光,白雪芳,等.殼寡糖對肉仔雞腸道主要菌群、小腸微絨毛密度、免疫功能及生產性能的影響[J].動物營養學報,2003,15(4):32-35.WANG Xiuwu,DU Yuguang,BAI Xuefang,et al.The effect of oligochitosan on broiler gut flora,microvilli density,immune function and growth performance[J].Acta Zoonutrimenta Sinica,2003,15(4):32-35.
[5] HUANG R L,YIN Y L,WU G Y,et al.Effect of dietary oligochitosan supplementation on ileal digestibility of nutrients and performance in broilers[J].Poult Sci,2005,84(9):1383-1388.
[6] 何亞男,佘銳萍,吳襟,等.半乳甘露寡糖和殼寡糖對大鼠腸黏膜結構、堿性磷酸酶活性影響的動態觀察[J].科學技術與工程,2006,6(2):131-135.HE Yanan,SHE Ruiping,WU Jin,et al.Effects of galacto-manno-oligosaccharides and oligochitosan on the structure of gut mucosa and the activity of AKP in rats[J].Science Technology and Engineering,2006,6(2):131-135.
[7] 陳虹,侯偉革,臧素敏.殼寡糖對鵪鶉生產性能和免疫功能的影響[J].經濟動物學報,2006,10(1):18-21.CHEN Hong,HOU Weige,ZANG Sumin.Affect of oligochitosan on production performance and immune function of quail[J].Journal of Economic Animal,2006,10(1):18-21.
[8] 紀瑩,趙軼,周翔,等.殼寡糖的制備及組分分析[J].中國現代應用藥學,2003,20(3):195-196.JI Ying,ZHAO Yi,ZHOU Xiang,et al.The preparation of chitosan oligomer and the components analysis[J].Chinese Journal of Modern Applied Pharmacy,2003,20(3):195-196.
[9] 吳海明,華曉陽,何登全.殼寡糖抗腫瘤作用及免疫調節機理的研究[J].中華醫學研究雜志,2005,5(8):729-732.WU Haiming,HUA Xiaoyang,HE Dengquan.Mechanism of anti-tumor and immune regulation of oligochitosan[J]Journal of Chinese Medicine Research,2005,5(8):729-732.
[10] 張偉,沈若武,王守彪.殼寡糖對骨折成骨細胞內骨形態發生蛋白的影響[J].齊魯醫學雜志,2005,20(3):247-248.ZHANG Wei,SHEN Ruowu,WANG Shoubiao.Effect of chitooligosaccharide on intraosteoblast bone morphogenetic protein in fractures[J].Medical Jurnal of Qilu,2005,20(3):247-248.
[11] 陳筱春,文質均,熊靜宇.甲殼寡糖抗小鼠運動性疲勞的實驗研究[J].湛江師范學院學報,2005,26(3):53-55.CHEN Xiaochun,WEN Zhijun,XIONG Jingyu.The effect of chitooligosaccharide on the delay of fatiguein trained mice[J].Journal of Zhanjiang Normal College,2005,26(3):53-55.
[12] JEONG H W,CHO S Y,KIM S,et al.Chitooligosaccharide induces mitochondrial biogenesis and increases exercise endurance through the activation of Sirt1and AMPK in rats[J].PLoS ONE,2012,7(7):e40073.
[13] CHO S Y,LEE J H,SONG M J,et al.Effects of chitooligosaccharide lactate salt on sleep deprivation-induced fatigue in mice[J].Biol Pharm Bull,2010,33(7):1128-1132.
[14] JU C,YUE W,YANG Z,et al.Antidiabetic effect and mechanism of chitooligosaccharides[J].Biol Pharm Bull,2010,33(9):1511-1516.
[15] 柳紅,崔濤,劉瑩.殼寡糖作用后人結腸癌LoVo細胞株bcl-2、bax表達改變[J].徐州醫學院學報,2005,25(1):1-3.LIU Hong,CUI Tao,LIU Ying.Effect of chitooligosaccharide on the growth of human carcinoma of colon LoVo cell line[J].Acta Academic Medicine Xuzhou,2005,25(1):1-3.
[16] 楊歡歡,周艷芬,武金霞,等.殼寡糖誘導肺癌細胞A549凋亡及其機制初探[J].時珍國醫國藥,2013,2(24):268-270.YANG Huanhuan,ZHOU Yanfen,WU Jinxia,et al.The exploration of oligochitosan induces apoptosis in lung cancer cell line A549and its mechanism[J].Lishizhen Medicine and Materia Medica Research,2013,2(24):268-270.
[17] SOSLOW R A,DANNENBERG A J,RUSH D,et al.COX-2is expressed in human pulmonary,colonic,and mammary tumors[J].Cancer,2000,89(12):2637-2645.
[18] 徐廣飛,李春建,仲齊慶,等.水溶性殼寡糖對人白血病細胞誘導分化的影響[J].南通大學學報,2006,26(4):247-248. XU Guangfei,LI Chunjian,ZHONG Qiqing,et al.The effect of differentiation on induction in human leukem ia cells by chitooligosaccharide[J].Journal of Nantong University,2006,26(4):247-248.
[19] 徐文華,韓寶芹,孔曉穎,等.殼寡糖的抑瘤作用及其作用機制研究[J].中國海洋大學學報,2013,9(43):54-59.XU Wenhua,HAN Baoqin,KONG Xiaoying,et al.Study on anti-tumor effect of chitooligosaccharides and its mechanism[J].Periodical of Ocean University of China,2013,9(43):54-59.
[20] 許青松,魏鵬,竇江麗,等.殼寡糖抑制肝癌細胞SMMC27721的增殖及其機制探討[J].天然產物研究與開發,2009,21:152-154.XU Qingsong,WEI Peng,DOU Jiangli,et al.Studies on the inhibitory effects of oligochitosan on SMMC27721cells of hepatocarcinoma[J].Nat Prod Res Dev,2009,21:152-154.
[21] 羅福文,萬瑩,張翠麗,等.殼寡糖對肝癌細胞SMMC27721中Bcl-2和Caspase-3表達的影響[J].中國微生態學雜志,2009,10(21):906-909.LUO Fuwen,WAN Ying,ZHANG Cuili,et al.Effect of oligochitosan on the expression of Bcl-2and Caspase-3in SMMC27721cells of hepatocarcinoma[J].Chinese Journal of Microecolog,2009,10(21):906-909.
[22] 劉清華,孔慶兗,柳紅.殼寡糖對S180肉瘤細胞凋亡、細胞周期以及凋亡相關蛋白Bcl-2、Bax的影響[J].徐州醫學院學報,2006,26(4):290-293.LIU Qinghua,KONG Qingyan,LIU Hong.Effects of chitooligosaccharide on tumor apoptosis,cell cycle and changes of apoptosis-related proteins Bcl-2and Bax in sarcoma 180cells[J].Acta Academic Medicine Xuzhou,2006,26(4):290-293.
[23] HASEGAWA M,YAGI K,IWAKAWA S,et al.Chitosan induces apoptosis via caspase-3activation in bladder tumor cells[J].Jpn J Cancer Res,2001,92(4):459-466.
[24] KROEMER G,GALLUZZI L,BRENNER C.Mitochondrial Membrane Permeabilization in Cell Death[J].Physiol Rev,2007,87(1):99-163.
[25] TESTA U,RICCIONI R.Deregulation of apoptosis in acute myeloid leukemia[J].Haematologica,2007,92(1):81-94.
[26] BEERHEIDE W,TAN Y J,TENG E,et al.Downregulationof proapoptotic proteins Bax and Bcl-X(S)in p53overexpressing hepatocellular carcinomas[J].Biochem Biophys Res Commun,2000,273(1):54-61.
[27] AMBROSINI G,ADIDA C,ALTIERI D C.A novel anti-apoptosis gene,survivin,expressed in cancer and lymphoma[J].Nat Med,1997,3(8):917-921.
[28] IKEHARA M,OSHITA F,KAMEDA Y,et al.Expression of survivin correlated with vessel invasion is a marker of poor prognosis in small adenocarcinoma of the lung[J].Oncol Rep,2002,9(4):835-838.
[29] SUZUKI A,ITO T,KAWANO H,et al.Survivin initiates procaspase 3/p21complex formation as a result of interaction with Cdk4to resist Fas-mediated cell death[J].Oncogene,2000,19(10):1346-1353.

