60Coγ射線復合硫酸二乙酯誘變選育高產新型細菌素Plantaricin 163-1菌株的研究
黨麗娟,高鈺淇,別小妹,呂鳳霞,趙海珍,陸兆新
(南京農業大學食品科學技術學院,江蘇南京 210095)
60Coγ射線復合硫酸二乙酯誘變選育高產新型細菌素Plantaricin 163-1菌株的研究
黨麗娟,高鈺淇,別小妹,呂鳳霞,趙海珍,陸兆新*
(南京農業大學食品科學技術學院,江蘇南京 210095)
為提高Lactobacillusplantarum163產的新型細菌素Plantaricin 163-1的抑菌相對效價,以Lb. plantarum 163為出發菌株,通過60Coγ射線復合硫酸二乙酯(DES)誘變,以期得到具有穩定遺傳性且細菌素高產的菌株。 結果表明:60Coγ射線誘變的最佳輻照劑量為0.6 kGy,獲得了抑菌活性提高23.68%的突變株。然后,在35 ℃下用0.7%硫酸二乙酯復合處理突變菌體25 min,最終得到一株高產突變菌株L150,其相對抑菌效價是原始菌株2.11倍。通過5代傳代培養,遺傳穩定性良好。
植物乳桿菌,細菌素,誘變,硫酸二乙酯
目前,食品工業中大多在使用化學防腐劑,但隨著人們生活水平的提高,消費者對食用化學防腐劑在一定程度上懷疑其安全性和潛在的副作用,而且越來越多的細菌表現出對化學防腐劑的耐受性[1],因此開發出廣譜、高效、穩定和安全的天然食品防腐劑是食品工業發展的必然趨勢[2]。乳酸菌(Lactobacillussp.)是一類可發酵糖并產生大量乳酸的細菌統稱。自古以來,乳酸菌廣泛應用于乳制品、蔬菜及肉制品的發酵和防腐中[3]。細菌素是乳酸菌在代謝過程中合成并分泌到環境中的一類具有抑菌活性的多肽或蛋白類物質,一般只對親緣關系較近的細菌有抑制作用,產生菌對其產生的細菌素具自身免疫性[4]。少部分細菌素具廣譜抑菌活性,在人體內可被降解,具有安全、易降解、對酸和高溫穩定等特點,因此,近年來成為天然防腐劑研究與開發的熱點。乳酸菌細菌素以乳酸鏈球菌素(Nisin)為代表,已被食品添加劑聯合專家委員會確認可作為食品防腐劑[5]。
植物乳桿菌163(Lb. plantarum163)為本實驗室分離純化鑒定的一株優良的乳酸菌菌株,能產生兩種新型的細菌素Plantaricin 163及Plantaricin 163-1,其中Plantaricin 163為32個氨基酸殘基的多肽(分子量3553 u)[6],Plantaricin 163-1為7個氨基酸殘基的多肽(分子量825 u)[7]。本實驗室前期研究發現,Lb. plantarum163產生的2種細菌素,Plantaricin 163-1的抑菌效果更好。故本實驗以Plantaricin 163-1相對效價為指標,采用物理復合化學誘變的方法來提高Plantaricin 163-1的相對效價,以期獲得具有工業應用價值的高產菌株。
1 材料與方法
1.1 材料與試劑
Lb. plantarum163(Lactobacillusplantarum163),來源于實驗室分離菌株[7],現由中國微生物保藏中心保藏(No.8224)。
指示菌菌株及來源:短小芽孢桿菌(CMCC 63202)。
MRS液體培養基(g/L):蛋白胨10、牛肉膏10、酵母粉5、葡萄糖20、無水乙酸鈉5、吐溫-80 1、檸檬酸二胺 2、磷酸氫二鉀 2、硫酸鎂 0.58、硫酸錳 0.25、蒸餾水 1 L,pH6.2~6.4。115 ℃,30 min,滅菌備用。
指示菌培養基為營養瓊脂培養基(g/L):牛肉膏 3,蛋白胨 10,氯化鈉 5,蒸餾水1 L,pH7.2~7.4,121 ℃,20 min,滅菌備用。
主要試劑:
pH6.0磷酸緩沖液(1 L):K2HPO42 g,KH2PO48 g,121 ℃,20 min,滅菌備用;pH7.0磷酸緩沖液(1 L):K2HPO49.39 g,KH2PO43.5 g,蒸餾水1 L,121 ℃,20 min,滅菌備用。
0.85%生理鹽水(1 L):NaCl 8.5 g,121 ℃,20 min,滅菌備用。
10%(v/v)硫酸二乙酯(DES):2 mL硫酸二乙酯(Sigma公司)加入9.8 mL無水乙醇Nisin標準品(Sigma公司):抑菌效價(1000000 U/g)。
1.2 儀器與設備
SW-CJ-1FD型單人單面凈化工作臺 蘇州凈化設備有限公司;LDZX-50KBS立式壓力蒸汽滅菌器 上海申安醫療器械廠;隔水式電熱恒溫培養箱 上海躍進醫療器械廠;EUTECH pH510酸度計 EUTECH 優特;冷凍離心機 Centrifuge 5840R,Eppendorf公司;DK-8D型電熱恒溫水槽 上海森信實驗儀器有限公司;數顯游標卡尺 杭州工量具制造有限公司。
1.3 實驗方法
1.3.1 原始菌株生長曲線的測定 從-70 ℃保藏的甘油管中取出保藏菌種,將菌種活化12 h后,按1%的接種量,接種于 MRS液體培養基中混合均勻,37 ℃靜置連續培養46 h,每隔2 h取樣,并做三個平行實驗。用分光光度計測定不同時間段發酵液的 OD600值,發酵液的pH,未接種的 MRS 液體培養基作為空白對照。以培養時間為橫坐標,OD600值為縱坐標,繪制生長曲線[8-9]。
1.3.260Coγ射線誘變 取對數生長期菌液5 mL,5000 r/min離心15 min,用無菌的生理鹽水振蕩混勻(不加玻璃珠)洗滌菌體,再次離心,重復兩次后,去除上清液,再用生理鹽水重懸,使菌體濃度為107cfu/mL。根據劑量要求置盛有菌體懸液的玻璃管于一定劑量的輻照臺面上,照射劑量分別為0、0.1、0.2、0.3、0.4、0.5、0.6、0.7 kGy,劑量率為9 Gy/min。處理相應時間后取出馬上進行10倍梯度稀釋,稀釋至10-4,涂布于MRS固體培養基上。實驗于江蘇省農科院原子能研究所進行。
1.3.3 硫酸二乙酯(DES)誘變 取γ射線誘變所得的高產菌株作為出發菌株,進行硫酸二乙酯誘變。取對數生長期菌液5 mL,5000 r/min離心15 min,再以pH為7.0的磷酸緩沖液洗滌2次,用磷酸緩沖液稀釋到107cfu/mL,轉入10 mL離心管中。配制DES母液濃度為10%,加入不同體積的DES母液和菌懸液,使終濃度為0.3%~0.8%的DES反應體系,處理10~30 min,處理溫度為30~50 ℃。按照2.5倍 DES溶液體積加入質量分數為25%硫代硫酸鈉溶液終止反應。取0.1 mL的誘變后菌懸液涂布于MRS固體培養基中。將培養好的平板取出進行菌落計數,根據平板上菌落計數結果,以未經DES處理的菌液涂平板作為對照,計算致死率。
致死率(%)=(未處理平板菌落數-處理平板菌落數)/未處理平板菌落數×100
分別進行不同的單因素實驗:分別取DES濃度、處理時間、誘變溫度3個因素。選取單因素實驗中最優的實驗結果。
1.3.4 篩選方法
1.3.4.1 初篩 誘變涂板后培養36 h,待菌落長出。用滅過菌的牙簽挑取菌落,挑入液體MRS培養基中,置于37 ℃恒溫培養箱培養36 h。8000 r/min離心2 min,得到的上清液采用瓊脂擴散法[10-11]做抑菌實驗。以出發菌株為對照,用數顯游標卡尺量取抑菌圈直徑,每次測量重復三次。選擇抑菌圈直徑比出發菌株大的菌株保藏。
1.3.4.2 抑菌相對效價的定義 采用牛津杯雙層瓊脂平板法測定發酵上清液的抑菌活性[12],采用Nisin標準曲線法測定細菌素的相對抑菌效價[13-14]。具體為:以短小芽孢桿菌為指示菌,以乳酸鏈球菌素Nisin為對照。首先將Nisin配制成16000 U/mL的母液,再用0.02 mol/L的稀鹽酸分別稀釋至8000、4000、2000、1000、500 U/mL,采用牛津杯法做抑菌實驗,繪制Nisin效價的對數值和抑菌圈直徑之間關系的標準曲線,得到Nisin的標準曲線,然后將待測發酵上清液稀釋到標準曲線范圍內,將抑菌圈直徑代入效價回歸方程,計算發酵液中細菌素的相對抑菌效價。
1.3.5 遺傳穩定性測試[15]選取復篩所得到抑菌效價較高的突變株進行連續傳代,每次傳代后發酵培養,測定相對效價的變化。
2 結果與分析
2.1 菌株Lactobacillusplantarum163生長曲線的測定
面向5G通信的高速PAM4信號時鐘與數據恢復技術…………………廖啟文,Patrick Yin CHIANG,祁楠 24-4-21
在Lactobacillusplantarum163發酵過程中,會產生乳酸,除了OD600值可以反映菌體的生長情況外,pH的變化也會反映出菌體的生長情況。接種后,0~4 h內處于延滯期,生長較緩慢,OD值變化較小,發酵液pH變化比較平緩;4 h后,OD值迅速升高,發酵液的pH同時迅速下降,菌體生長進入對數期;當培養14 h后,菌體生長速度減慢,OD值變化趨于平緩,pH變化也較小,菌體進入對數末期。根據不同時期菌體生長情況,培養12 h菌體進入生長的對數中后期。此時,OD值為2.0左右,pH控制在4.1左右。誘變處理的菌株一般要求處于對數生長期,此時菌體生長狀態比較同步,對于誘變劑較敏感,容易變異,且重復性較好。同時,為了保證處理時具有一定的細胞濃度,增加可能變異的細胞總數,常選用對數生長中后期的細胞供處理[16]。所以實驗選取培養12 h的菌體進行誘變處理。Lactobacillusplantarum163生長曲線的測定,不僅可以為該菌株進行各種誘變處理提供合適的菌體狀態,還可以為進一步原生質體制備、融合作為實驗參考。

圖1 Lactobacillus plantarum 163生長曲線的測定Fig.1 Growth curve of Lactobacillus plantarum 163
2.260Coγ射線誘變對致死率的影響
2.2.160Coγ射線誘變劑量的選擇 從圖中可以看出,出發菌株Lactobacillusplantarum163在劑量率為9 Gy/min條件下,不同注入劑量對存活率的影響見圖2。研究表明,致死率在80%~90%時正向突變的概率較高[17]。所以,選取致死率在80%~90%的誘變劑量和誘變時間長出的菌落作為篩選的對象。以致死率為參考標準[18],致死率越高,菌株突變的概率越大,但是,在高劑量高強度的致死率下,往往負突變占較大比例。而致死率較低時,菌落數量龐大,不利于篩選工作。從致死曲線可以推斷,γ射線誘變菌株,是一個能量沉積的過程,隨著能量的增大,致死率升高。而對于誘變菌株的篩選,初篩的菌株數量越多,優良菌株被遺漏的概率越小,擴大篩選量,是育種成功與否的一個關鍵因素[19]。γ射線誘變的劑量為0.6 kGy時,即致死率為84.36%,在最易產生突變的致死率范圍。因此,在0.6 kGy劑量作用后,隨機大量挑選菌株,利用瓊脂擴散法進行初篩。
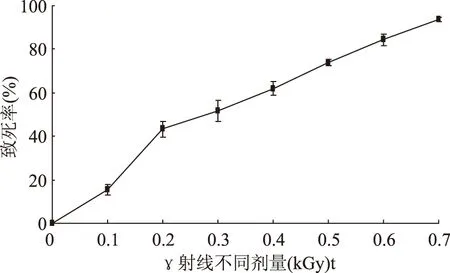
圖2 60Coγ射線致死率曲線Fig.2 Lethality curve of Lactobacillus plantarum 163by irradiating 60Coγ
2.2.260Coγ射線誘變后菌株的篩選 將原出發菌株經過多次γ射線誘變后,在0.6 kGy條件下,篩選出18株突變菌株,其所產細菌素的相對效價比原始菌株所產的有小幅度提高。經過初篩、復篩,挑選出菌株γ120,所產細菌素的相對抑菌效價較其他菌株提高的最多,約提高了23.68%。接種到斜面試管保藏,以備下一步進行化學誘變,以達到提高突變菌株生產Plantaricin163-1相對效價的目的。
2.3 硫酸二乙酯誘變
2.3.1 硫酸二乙酯誘變劑量的確定 致死率與DES作用的濃度有密切關系。因此選定作用時間30 min,分別選取體積分數為0.3%~0.8%的DES反應,做單因素實驗。當體積分數為0.7%,作用30 min時,致死率達到了94%。結果見圖3。
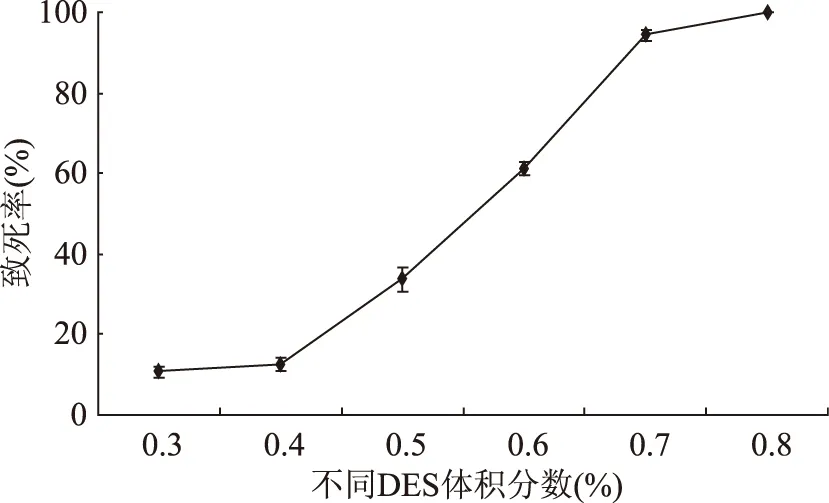
圖3 DES濃度對Lactobacillus plantarum 163致死率的影響Fig.3 Effect of DES concentration on lethal rateof Lactobacillus plantarum 163
從圖3可以看出,DES濃度在低于0.7%時,致死率迅速增長,但達到0.7%以后,致死率增加緩慢。DES體積分數較低時,相同時間內不能夠作用于所有的菌株,因此,致死率隨著體積分數的增加而迅速增加。當誘變劑量為0.6%時,致死率為61%,達不到誘變作用的致死率;當增加到0.8%時,致死率達到100%,絕大多數菌株都不耐受誘變劑的作用。綜合考慮,選用DES的體積分數為0.7%,致死率在理想的范圍內。
2.3.2 硫酸二乙酯誘變時間對致死率的影響 確定了0.7% DES為作用的體積分數,分別選取10、15、20、25、30 min進行單因素實驗,實驗結果如圖4。
從圖4可知,隨著作用時間的延長,致死率的提高速度較快,會提高DNA突變的概率。DES處理10 min,菌體的致死率為34.24%,隨著誘變時間的增加,菌體致死率顯著提高。誘變時間為25 min時,致死率達到89.67%,在目標致死范圍之內。而誘變時間為30 min時,菌體致死率為98%。因此在DES誘變中處理時間選擇25 min。
2.3.3 硫酸二乙酯誘變溫度對致死率的影響 當DES濃度為0.7%,處理時間為25 min時,誘變溫度對Lactobacillusplantarum163致死率的影響見圖5。當溫度是30 ℃時,致死率分別為74.45%;當溫度是35 ℃時,致死率分別為85.23%。當溫度為40 ℃時,致死率為91.78%。40 ℃以上絕大部分菌體死亡。對綜合考慮突變率與致死率,選擇35 ℃為誘變溫度。

表1 誘變后菌株對指示菌的抑菌圈直徑比較
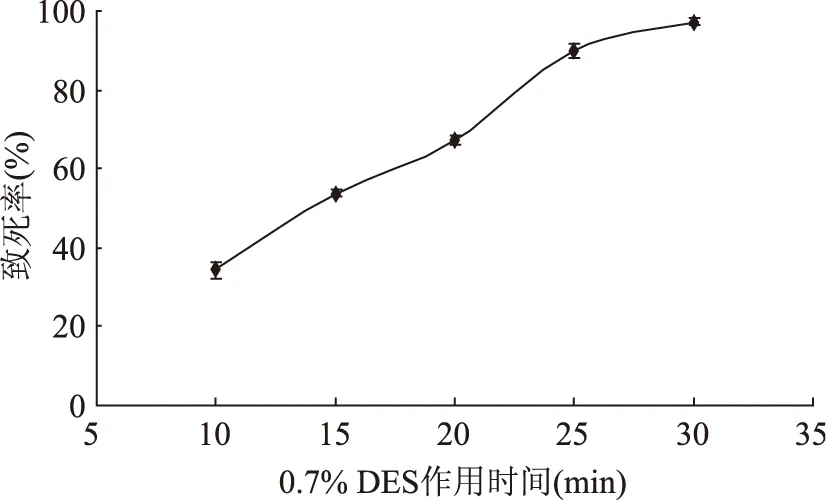
圖4 DES誘變時間對Lactobacillus plantarum 163致死率的影響Fig.4 Effect of treated time by DES on lethal rateof Lactobacillus plantarum 163
注:
注:同行比較不同字母表示在0.05水平差異顯著,下同。
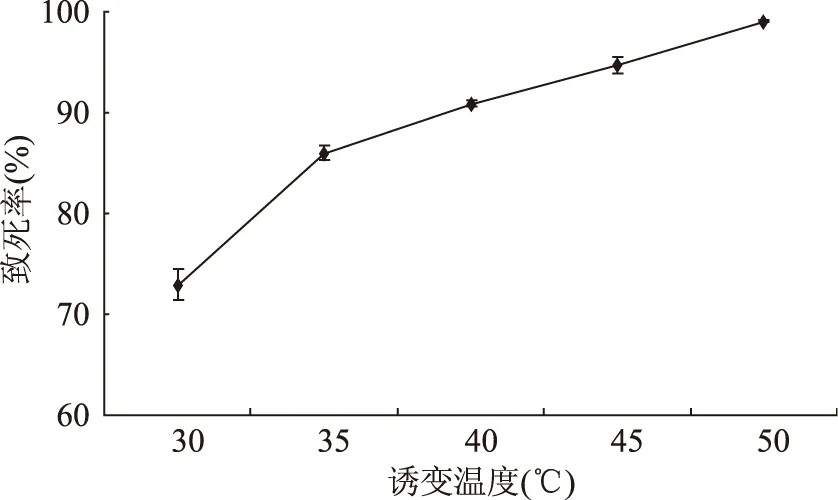
圖5 DES誘變溫度對Lactobacillus plantarum 163致死率的影響Fig.5 Effect of treated temperature by DESon lethal rate of Lactobacillus plantarum 163
根據以上實驗結果可以得出最佳DES誘變條件:DES濃度為0.7%、處理時間25 min、誘變溫度35 ℃為最佳條件。
2.4 DES誘變結果
先將原始菌株進行60Coγ射線誘變,得到的抑菌圈較大的菌株進行DES誘變,從初篩中挑取活性較高的菌進行復篩,然后將復篩得到活性較高的菌株中大約6株進行多次復篩,通過抑菌圈直徑比較,發現編號L150菌株發酵上清液的抑菌效果較好。
2.5 抑菌相對效價的定義
通過不同濃度的Nisin的抑菌圈的測定,本實驗測得回歸方程為:Y=0.2549x+0.03,R2=0.9954。式中:Y表示效價的對數值;x表示抑菌圈直徑,mm。利用Nisin標準曲線法來測定各突變菌株所產Plantaricin 163-1的相對效價的變化。以Nisin效價作為參照指標,Nisin效價的對數作為縱坐標,抑菌圈直徑為橫坐標,做抑菌效價的曲線。由圖6可見,標準效價的對數與抑菌圈直徑之間呈線性關系,相關系數為0.99,符合進一步實驗的要求。
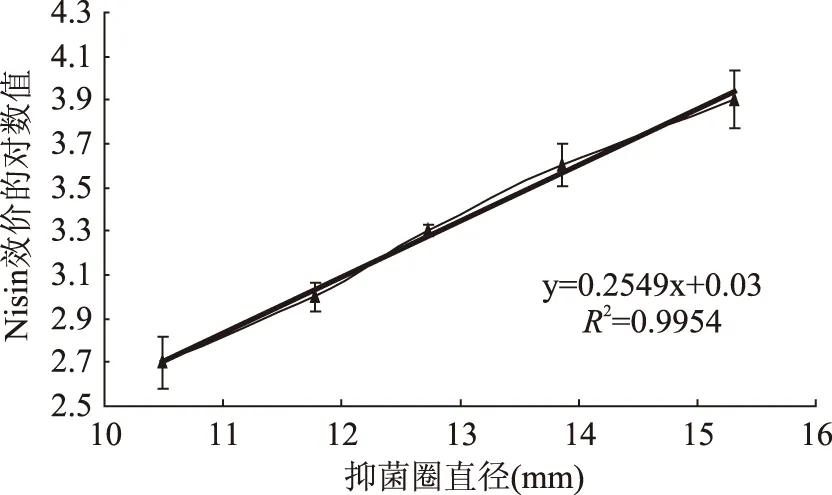
圖6 Nisin 標準效價曲線Fig.6 The standard titer curve of Nisin
2.6 復合誘變后各菌株的相對效價
將抑菌圈直徑代入回歸方程,得到圖6中突變菌株細菌素的相對效價值。其中,相對效價最高的是L150,為1591.02 U/mL,次之為L113,為1553.45 U/mL。原始菌株的所產細菌素的相對效價為753.87 U/mL。L150產Plantaricin 163-1的相對效價是原始菌株的2.11倍。
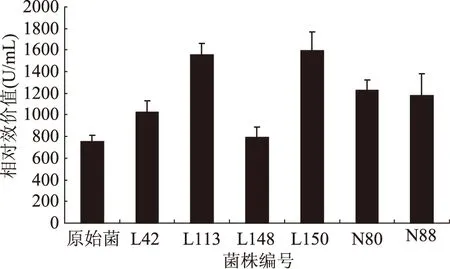
圖7 復合誘變各菌株的相對效價Fig.7 Relative potency of different strainsafter compound mutation
2.7 遺傳穩定性實驗
為觀察篩選得到的較高正突變菌株L150的遺傳穩定性,進行遺傳穩定性實驗,傳5代培養,抑菌實驗短小芽孢桿菌為指示菌,結果如表2所示。
誘變后的菌株做完抑菌實驗后,其傳代過程中波動很小,處于穩定狀態。利用Nisin標準曲線法,所計算出的相對效價也相對穩定,由此可以得出所篩得的菌株具有較好的遺傳穩定性。因此,挑選L150誘變菌株作為今后進一步研究的實驗菌株。如圖8所示。

表2 誘變菌株L150遺傳穩定性
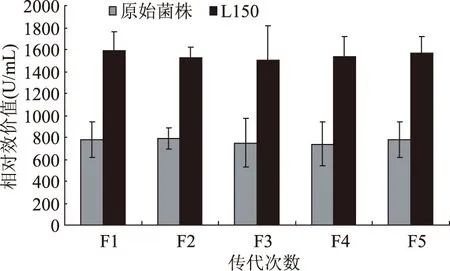
圖8 L150的遺傳穩定性Fig.8 Genetic stability of L150 after five generation
3 討論
Lb. Plantarum163是一種能產生新型細菌素Plantaricin 163-1的Lb. plantarum,該菌株所產的細菌素具有廣譜抑菌、安全可食用等諸多優點,因而在食品工業上有良好的應用前景。由實驗的結果可以看出,利用γ射線復合DES誘變對Lb. plantarum 163進行誘變是一種可行有效的手段。
野生型乳酸菌經長期自然選擇,能夠適應周圍環境與其他物種的競爭。但是,卻不能按照人們的需要生產所需的物質。通過誘變和篩選的隨機選擇,可以提高現有發酵物質的相對效價。隨著人們對基因工程越來越多的應用,諸多利用基因組改組技術成功的例子,該方法可以將不同方法獲得的優良突變菌株進行基因重組。因此,下一步的實驗工作可以考慮基因組改組,利用原生質體融合等手段進一步提高菌株產細菌素的相對效價。另外,可以將基因組改組技術與代謝工程相結合[20],分析其表型的改善與代謝途徑的分子機制。通過比較蛋白質組學分析其出發菌株與突變菌株,探究高產的機理性問題。
4 結論
本實驗采用60Coγ誘變結合DES誘變手段,通過合理的致死率得到最佳誘變條件,即誘變劑的濃度、誘變時間和作用溫度。60Coγ射線的輻照劑量為0.6 kGy處理后,再結合硫酸二乙酯誘變。DES誘變劑的體積分數為0.7%、作用時間為25 min、反應溫度為35 ℃。在此條件下獲得突變菌株。從大量誘變菌株中篩選抑菌圈較大的6株進行復篩,最后由瓊脂擴散法和Nisin標準曲線法測定相對效價,確定突變菌株L150為實驗所獲得的Plantaricin 163-1相對效價提高的菌株。在相同培養條件下,突變株L150產生Plantaricin 163-1的相對效價是原始菌株的相對效價的2.11倍。經過5次連續傳代,該菌株產生的細菌素抑菌圈直徑和相對效價較穩定,證明其具有良好的遺傳穩定性。
[1]Dalié D K D,Deschamps A M,Richard-Forget F. Lactic acid bacteria-Potential for control of mould growth and mycotoxins:A review[J]. Food control,2010,21(4):370-380.
[2]Schnurer J,Magnusson J. Antifungal lactic acid bacteria as biopreservatives[J]. Trends in Food Science & Technology,2005,16(1-3):70-78.
[3]Perlak F J,Dwaton R W,Armstrong T A.Insect resistant cotton plants[J]. Biotechnol,1990,8(10):939-943.
[4]Perdigon G,Fuller R,Raya R. Lactic Acid Bacteria and Their Effect on the Immune System[J]. Curr Issues Intest Microbio1,2001,2(1):27-42.
[5]潘天太,還連棟,何松.一種天然的食品防腐劑-Nisin[J].肉類工業,1992(3):20.
[6]Hu M,Zhao H,Zhang C,et al.Purification and characterization of plantaricin 163,a novel bacteriocin produced byLactobacillusPlantaricin163 isolated from traditional Chinese fermented vegetable[J]. Journal of agricultural and food chemistry,2013,61(47):11676-11682.
[7]胡美忠.Lactobacillusplantarum163分離鑒定及其細菌素研究[D].南京:南京農業大學,2014.
[8]徐晶雪,鄒積宏,袁杰利. 降膽固醇乳酸菌的篩選及應用的研究進展[J]. 中國微生態學雜志,2009,21(6):570-571.
[9]張紅丹,杜茜,張正坤,等.放線菌769抑菌譜及液體培養生長曲線的測定[J]. 中國植保導刊,2010,3(7):5-9.
[10]Gong H S,Meng X,Wang H. Plantaricin MG active against Gram-negative bacteria produced byLactobacillusplantarumKLDS1.0391 isolated from “Jiaoke”,a traditional fermented creamfrom China[J].Food control,2010,21(1):89-96.
[11]Jagadeeswari S,Vidya P D J,Mukesh Kumar D J,et al.Isolation and characterization of bacteriocin producingLactobacillussp. from traditional fermented food[J]. Electronic journal of environment,agricultural&food chemistry,2010,9(3):575-581.
[12]呂燕妮.戊糖乳桿菌31-1菌株產細菌素研究[D].北京:中國農業大學,2004.
[13]Delgado A,Brito D,Fevereiro P,et al. Bioactivity quantification of crude bacteriocin solutions[J]. Microbiological Methods,2005,(2):121-124.
[14]劉國榮,周康,李平蘭,等.傳統干酪中一株產Ⅱa類細菌素乳酸菌的分離與鑒定[J].食品科學,2007,28(5):185-190.
[15]陳洪衛,陳林海,張國只. 低能氮離子注入誘變選育乳鏈菌肽產生菌的研究[J].食品科學,2009,30(7):177-180.
[16]陳志剛,巴吐爾,羅紅霞.硫酸二乙酯誘變保加利亞乳桿菌最佳條件的研究[J].農產品加工(上),2008,12:65-67.
[17]諸葛建. 工業微生物實驗技術手冊[M].北京:中國輕工出版,1994:145-147.
[18]施巧琴,吳松剛.工業微生物育種學[M].第三版.北京:科學出版社,2009:121-122.
[19]張玉梅,李軍,國石磊,等.復合誘變選育酸性蛋白酶缺陷菌株[J].食品科技,2014,39(5):15-19.
[20]Santos C N,Stephanopoulos G. Combinatorial engineering of microbes for optimizing cellular phenotype[J]. Curr Opin Chem Biol,2008,12(2):168-176.
Screening of High-yeilding Plantaricin 163-1 Strains induced by60Coγ-ray and Diethyl sulfate
DANG Li-juan,GAO Yu-qi,BIE Xiao-mei,LV Feng-xia,ZHAO Hai-zhen,LU Zhao-xin*
(College of Food Science and Technology,Nanjing Agricultural University,Nanjing 210095,China)
To obtain high yield and stable strain for the production of plantaricin 163-1,60Coγ-ray and Diethyl sulfate were employed to induceLactobacillusplantarum163 to enhance the production of a novel bacteriocin Plantaricin 163-1.Through the method60Coγ-ray and diethyl sulfate(DES)mutagenesis,the optimum parameters of60Coγ-ray and diethyl sulfate was determined by observing the lethal rate of each methods,which irradiation dose of60Coγ-ray was 0.6 kGy and DES treatment was 0.7%,treated for 25 min,at 35 ℃. At last,the high-yielding mutant strain L150 was obtained and had stable inheritance. The antibacterial activity of the mutant L150 was 2.11 times comparison with original strain.
Lactobacillusplantarum;bacteriocin;mutant;diethyl sulfate
2014-11-24
黨麗娟(1989-),女,在讀碩士研究生,研究方向:食品科學,E-mail:2011108026@njau.edu.cn。
*通訊作者:陸兆新 (1957-),男,博士,研究方向:酶工程、食品微生物、農產品加工,E-mail:fmb@njau.edu.cn。
國家科技部支撐計劃(2011BAD23B05)。
TS201.3
A
1002-0306(2015)15-0174-06
10.13386/j.issn1002-0306.2015.15.029

