毒毛旋花子阿洛糖苷誘導胃腺癌細胞SGC-7901凋亡作用及機制研究
張雪嬌,梅文莉,蔡彩虹,董文化,姜 北,黃風迎,戴好富
?
·論著·
毒毛旋花子阿洛糖苷誘導胃腺癌細胞SGC-7901凋亡作用及機制研究
張雪嬌,梅文莉,蔡彩虹,董文化,姜 北,黃風迎,戴好富
目的 探討毒毛旋花子阿洛糖苷誘導胃腺癌細胞SGC-7901凋亡作用及其機制。方法 將人胃腺癌細胞SGC-7901分為對照組、0.125 μg/ml組、0.250 μg/ml組、0.500 μg/ml組、1.000 μg/ml組,四甲基偶氮唑鹽微量酶反應比色法(MTT)檢測毒毛旋花子阿洛糖苷對胃腺癌細胞SGC-7901的生長抑制作用,Hoechst染色和Annexin V-FITC/碘化丙啶(PI)流式細胞術檢測細胞凋亡情況,JC-1法檢測線粒體膜電位變化,Western blotting法檢測線粒體途徑相關蛋白細胞色素C、Caspase-3和Caspase-9的表達。結果 MTT結果顯示,24 h和48 h時不同組胃腺癌細胞SGC-7901吸光度(A)、生長抑制率比較,差異均有統計學意義(P<0.05);組間兩兩比較胃腺癌細胞SGC-7901 A值依次降低、生長抑制率依次升高(P<0.05)。熒光顯微鏡下觀察發現,對照組細胞核顯示為藍熒光且較均勻,0.500 μg/ml組處理12 h后細胞核呈緊密較亮熒光體,顏色較白。不同組胃腺癌細胞SGC-7901總相對死亡率比較,差異有統計學意義(P<0.05);組間兩兩比較胃腺癌細胞SGC-7901總相對死亡率依次升高(P<0.05)。JC-1染色結果顯示,毒毛旋花子阿洛糖苷處理胃腺癌細胞SGC-7901 12 h后,0.125 μg/ml組、0.250 μg/ml組、0.500 μg/ml組顯示綠色熒光,隨毒毛旋花子阿洛糖苷濃度的增加綠色熒光增強。Western blotting法顯示,隨著細胞凋亡的發生,細胞色素C從線粒體中釋放到細胞質中,同時,Caspase-3和Caspase-9也被激活并發生剪切活化,活化片段表達增加。結論 毒毛旋花子阿洛糖苷通過線粒體凋亡途徑誘導體外培養的人胃腺癌細胞SGC-7901凋亡。
胃腫瘤;毒毛旋花子甙類;線粒體;細胞凋亡
張雪嬌,梅文莉,蔡彩虹,等.毒毛旋花子阿洛糖苷誘導胃腺癌細胞SGC-7901凋亡作用及機制研究[J].中國全科醫學,2015,18(15):1743-1747.[www.chinagp.net]
Zhang XJ,Mei WL,Cai CH,et al.Apoptosis of gastric adenocarcinoma cells type SGC-7901 induced by Strophalloside and its mechanism[J].Chinese General Practice,2015,18(15):1743-1747.
見血封喉為桑科見血封喉屬(Antiracism)植物,別名箭毒木,主要分布于東南亞,我國僅產1種,分布于海南、云南等地,其鮮樹汁乳白色,有劇毒,民間入藥用于強心、催吐、瀉下、麻醉等。研究表明,見血封喉乳汁和種子的主要成分為強心苷類化合物,具有強心作用[1-3]。為開發熱帶藥用植物資源,在活性篩選指導下,本實驗室從海南產見血封喉的乙醇提取物中分離出一系列強心苷,其中毒毛旋花子阿洛糖苷對胃腺癌細胞SGC-7901具有顯著的細胞毒活性[4-5]。長期以來,強心苷在臨床上廣泛應用于充血性心力衰竭以及其他心源性疾病的治療,研究也表明,強心苷對惡性腫瘤細胞具有優先選擇性殺傷作用,其機制包括誘導腫瘤細胞分化或促進腫瘤細胞凋亡等[6-8]。本研究探討毒毛旋花子阿洛糖苷對人胃腺癌細胞SGC-7901是否具有誘導凋亡的作用及其機制。
1 材料與方法
1.1 材料 人胃腺癌細胞SGC-7901購自中國科學院上海生命科學研究院細胞庫,RPMI Medium 1640培養基購于Solarbio公司,胎牛血清(PBS)購于四季青生物工程材料有限公司,Annexin V-FITC細胞凋亡檢測試劑盒、Hoechst染色試劑盒(Hoechst Staining Kit)、線粒體分離試劑盒、線粒體膜電位檢測試劑盒、細胞色素C抗體、Caspase-3抗體、Caspase-9抗體、環氧酶(COX)Ⅳ抗體、肌動蛋白(Actin)抗體、辣根過氧化物酶標記山羊抗兔IgG(H+L)和辣根過氧化物酶標記山羊抗鼠IgG(H+L)購于碧云天生物技術研究所。
1.2 細胞培養 人胃腺癌細胞SGC-7901培養于含10%磷酸鹽緩沖液(PBS)的RPMI Medium 1640培養基中,置于37 ℃ 5%二氧化碳(CO2)細胞培養箱中培養,0.25%胰酶消化常規傳代。
1.3 四甲基偶氮唑鹽微量酶反應比色法(MTT)檢測毒毛旋花子阿洛糖苷對細胞的生長抑制作用 將人胃腺癌細胞SGC-7901分為對照組、0.125 μg/ml組、0.250 μg/ml組、0.500 μg/ml組、1.000 μg/ml組,取對數生長期的人胃腺癌細胞SGC-7901接種于96孔板中,培養24 h后,向每孔加10 μl的藥液,每組設定6個平行孔,毒毛旋花子阿洛糖苷濃度分別為0、0.125、0.250、0.500、1.000 μg/ml,置于37 ℃ 5%CO2細胞培養箱中培養,分別在24 h和48 h后,棄上清液,向每孔加100 μl二甲基亞砜(DMSO),搖床震蕩10 min后,酶標儀(Bio-Tek,ELX808IU)檢測波長490 nm處吸光度(A),按公式計算生長抑制率,生長抑制率(%)=〔1-(實驗組均值/對照組均值)〕×100%。
1.4 Hoechst染色檢測細胞凋亡 將潔凈蓋玻片置于6孔板內,種入細胞培養過夜,孔中細胞50%~80%時,加入毒毛旋花子阿洛糖苷,濃度為0.500 μg/ml,24 h后,棄培養基,加0.5 ml固定液固定10 min,去固定液,用PBS洗滌2次,棄上清液,加入0.5 ml Hoechst 33258染色液染色5 min,去染色液,用PBS洗滌2次,將蓋玻片蓋到滴有抗熒光淬滅封片液的載玻片上,于熒光顯微鏡下觀察。對比觀察對照組、0.500 μg/ml組的染色結果。
1.5 Annexin V-FITC/碘化丙啶(PI)流式細胞術檢測細胞凋亡 對照組、0.125 μg/ml組、0.250 μg/ml組、0.500 μg/ml組,取對數生長期的胃腺癌細胞SGC-7901接種于6孔板中,培養24 h,加藥處理24 h后,收集細胞,用預冷PBS洗滌2次,用195 μl的Annexin V-FITC結合液重懸細胞后,加5 μl的Annexin V-FITC,室溫避光孵育10 min,1 000×g離心5 min,棄上清液,用190 μl的Annexin V-FITC結合液重懸細胞后,加10 μl PI染色液,輕輕混勻,避光4 ℃孵育5 min。然后用流式細胞儀檢測總相對死亡率。
1.6 JC-1法檢測線粒體膜電位 對照組、0.125 μg/ml組、0.250 μg/ml組、0.500 μg/ml組,取對數生長期的胃腺癌細胞SGC-7901接種于6孔板中,培養24 h,加藥處理12 h后,棄培養基,用預冷PBS洗滌1次,棄PBS,每孔加1 ml的細胞培養液和1 ml的JC-1染色工作液,混勻于37 ℃ 5%CO2細胞培養箱中培養20 min。然后棄上清液,用JC-1染色緩沖液洗滌2次,棄上清液,加2 ml細胞培養液于熒光顯微鏡下觀察。
1.7 Western blotting 法檢測線粒體蛋白表達 線粒體蛋白的提取使用細胞線粒體分離試劑盒,收集0.500 μg/ml組的細胞,用PBS洗滌2次,棄PBS,向細胞沉淀里添加已加入苯甲基磺酰氟(PMSF)的線粒體分離試劑,重懸后把細胞懸浮液轉移到適當大小的玻璃勻漿器中,勻漿30下,600×g,4 ℃離心10 min,把上清液轉移到另一離心管,11 000×g,4 ℃離心10 min,沉淀即為細胞線粒體,加線粒體裂解液得線粒體蛋白,同時上清液12 000×g,4 ℃離心10 min,取上清液為細胞質蛋白。用考馬斯亮藍法(Bradford法)測定蛋白表達,以60 μg的上樣量對蛋白進行變性,用12%聚丙烯酰胺凝膠電泳(SDS-PAGE)在1×Tris-甘氨酸電泳緩沖液下進行蛋白分離,細胞色素C抗體按1∶200一抗稀釋液稀釋,一抗Caspase-3抗體按1∶250一抗稀釋液稀釋,Caspase-9、COX Ⅳ、Actin抗體均按1∶1 000一抗稀釋液稀釋,用辣根過氧化物酶標記二抗(1∶1 000)封閉,用增強型化學免疫印跡檢測系統(ECL)檢測免疫反應蛋白。
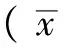
2 結果
2.1 不同組胃腺癌細胞SGC-7901 A值、生長抑制率比較 MTT法結果顯示,24 h和48 h時不同組胃腺癌細胞SGC-7901 A值、生長抑制率比較,差異均有統計學意義(P<0.05);其中24 h和48 h時,0.125 μg/ml組、0.250 μg/ml組、0.500 μg/ml組、1.000 μg/ml組較對照組胃腺癌細胞SGC-7901 A值降低、生長抑制率升高,差異均有統計學意義(P<0.05);0.250 μg/ml組、0.500 μg/ml組、1.000 μg/ml組較0.125 μg/ml組胃腺癌細胞SGC-7901 A值降低、生長抑制率升高,差異均有統計學意義(P<0.05);0.500 μg/ml組、1.000 μg/ml組較0.250 μg/ml組胃腺癌細胞SGC-7901 A值降低、生長抑制率升高,差異均有統計學意義(P<0.05);1.000 μg/ml組較0.500 μg/ml組胃腺癌細胞SGC-7901 A值降低、生長抑制率升高,差異均有統計學意義(P<0.05,見表1)。
2.2 細胞凋亡情況 細胞發生凋亡時,因為染色質固縮,Hoechst 染色表現為細胞核呈緊密較亮熒光體并且顏色變白。在熒光顯微鏡下觀察發現,對照組細胞核顯示為藍熒光且較均勻,0.500 μg/ml組處理12 h后細胞核呈緊密較亮熒光體,顏色較白(見圖1)。處理24 h后流式細胞術檢測細胞凋亡情況,采用Annexin V-FITC和PI染色后,正常的活細胞不被Annexin V-FITC和PI染色(左下角);凋亡早期的細胞僅被Annexin V-FITC染色,PI染色呈陰性(右下角);壞死細胞和凋亡晚期的細胞可以同時被Annexin V-FITC和PI染色(右上角)。左上角出現的是許可范圍內的檢測誤差(見圖2)。不同組胃腺癌細胞SGC-7901總相對死亡率比較,差異有統計學意義(P<0.05);其中,0.125 μg/ml組、0.250 μg/ml組、0.500 μg/ml組較對照組胃腺癌細胞SGC-7901 總相對死亡率升高,差異均有統計學意義(P<0.05);0.250 μg/ml組、0.500 μg/ml組較0.125 μg/ml組胃腺癌細胞SGC-7901總相對死亡率升高,差異均有統計學意義(P<0.05);0.500 μg/ml組較0.250 μg/ml組胃腺癌細胞SGC-7901總相對死亡率升高,差異有統計學意義(P<0.05,見表2)。
圖1 熒光顯微鏡下觀察細胞凋亡情況(Hoechst染色,×200)
Figure 1 The cell apoptosis under the fluorescence microscope
Table 1 Comparison of value A and rate of growth inhibition of human gastric cancer cells type SGC-7901 among different groups at 24 h and 48 h after treatment

組別 24hA值 生長抑制率(%) 48hA值 生長抑制率(%)對照組0920±0027000±0000975±0034000±0000125μg/ml組0855±0029?706±315?0890±0056?871±580?0250μg/ml組0782±0015?△1500±160?△0747±0040?△2338±423?△0500μg/ml組0675±0009?△▲2663±102?△▲0356±0012?△▲6256±131?△▲1000μg/ml組0465±0005?△▲☆4946±050?△▲☆0104±0005?△▲☆8933±057?△▲☆F值791886091016710475P值<0001<0001<0001<0001
注:A=吸光度;與對照組比較,*P<0.05;與0.125 μg/ml組比較,△P<0.05;與0.250 μg/ml組比較,▲P<0.05;與0.500 μg/ml組比較,☆P<0.05

Table 2 Comparison of total relative mortality of gastric adenocarcinoma cells type SGC-7901 among different groups

組別總相對死亡率(%)對照組0000±0000125μg/ml組812±154?0250μg/ml組1125±243?△0500μg/ml組6024±1079?△▲F值11102P值<0001
注:與對照組比較,*P<0.05;與0.125 μg/ml組比較,△P<0.05;與0.250 μg/ml組比較,▲P<0.05

注:PI=碘化丙啶
圖2 不同組Annexin V-FITC/PI流式細胞術檢測細胞凋亡情況
Figure 2 Detection of cell apoptosis in different groups using Annexin V-FITC/PI flow cytometry
2.3 線粒體膜電位改變 JC-1染色結果顯示,毒毛旋花子阿洛糖苷處理胃腺癌細胞SGC-7901 12 h后,0.125 μg/ml組、0.250 μg/ml組、0.500 μg/ml組顯示綠色熒光,隨毒毛旋花子阿洛糖苷濃度的增加綠色熒光增強(見圖3)。
2.4 Western blotting法檢測線粒體蛋白表達 分別提取毒毛旋花子阿洛糖苷(0.500 μg/ml)處理不同時間點的線粒體蛋白和細胞質蛋白,檢測細胞色素C、Caspase-3和Caspase-9的表達,結果顯示,隨著細胞凋亡的發生,細胞色素C從線粒體中釋放到細胞質中,同時,Caspase-3和Caspase-9也被激活并發生剪切活化,活化片段表達增加(見圖4)。
3 討論
胃癌是嚴重危害人們健康和生命的惡性腫瘤之一,在我國其發病率居各類腫瘤的首位[9]。腫瘤的發生、發展與細胞凋亡密切相關。目前許多抗腫瘤的化療藥物主要通過誘導其凋亡來殺傷腫瘤細胞。
細胞凋亡是十分復雜的過程,是由基因精確調控的程序性死亡方式,盡管促進凋亡的具體信號途徑尚未完全清楚,但是一些誘導分子最終均通過活化一系列被稱為半胱氨酸蛋白酶的信號分子參與的共同通路來誘導凋亡過程,從而最終導致DNA斷裂以及與凋亡相關的形態學改變[10-11]。目前,已知兩種信號途徑可以誘導細胞凋亡發生[12-15]:第一途徑即外部信號途徑亦稱死亡受體途徑,主要由Fas(CD95)死亡受體或其他腫瘤壞死因子α(TNF-α)受體超家族成員活化并募集細胞膜旁的Caspase (主要為Caspase-8),然后活化Caspase-3,后者促進細胞凋亡;第二種途徑指內部途徑或稱線粒體途徑,其特點是線粒體級聯反應導致細胞色素C釋放,活化Caspase-9,并形成凋亡小體及多蛋白復合物,進而活化下游Caspase-3,放大死亡信號,誘導細胞凋亡。可見兩種途徑分別特異性活化Caspase-8或Caspase-9,兩種途徑最后均活化Caspase-3,導致細胞凋亡。近年來人們對凋亡的認識已經從細胞核的改變決定凋亡發展為重視線粒體,因為其構成了細胞存亡的控制中心。凋亡過程中線粒體呼吸鏈電子傳遞中斷,自由基產生,能量供應受阻。在檢測到經典的細胞凋亡特征以前,線粒體膜完整性就已發生了重大變化,這些變化涉及線粒體內膜和外膜的改變,包括內膜跨膜電位的喪失和蛋白質通過外膜的釋放[16]。

圖3 JC-1法檢測線粒體膜電位變化(JC-1染色,×200)

注:Cyto-C=細胞色素C,COX Ⅳ=環氧酶Ⅳ,Actin=肌動蛋白
圖4 Western blotting法檢測細胞色素C、Caspase-3 和Caspase-9的表達
Figure 4 Detection of expressions of cytochrome C,Caspase-3 and Caspase-9 by Western blotting analysis
強心苷類化合物已經越來越多地應用于各種腫瘤的防治研究中,能通過多種途徑在體內、外發揮抗腫瘤作用。毒毛旋花子阿洛糖苷是強心苷的一種。本實驗結果發現,毒毛旋花子阿洛糖苷處理胃腺癌細胞SGC-7901能夠明顯抑制其生長和增殖,并能有效誘導細胞凋亡,這種抑制作用具有時間和劑量依賴性,隨著時間及藥物濃度的增加,細胞生長抑制率呈遞增趨勢。用JC-1染色檢測發現毒毛旋花子阿洛糖苷處理胃腺癌細胞SGC-7901線粒體膜電位明顯下降的同時,線粒體細胞色素C也逐漸下降,但細胞質細胞色素C的表達則明顯增加,說明細胞色素C從線粒體釋放到細胞質中。另外,實驗結果還發現,毒毛旋花子阿洛糖苷處理胃腺癌細胞SGC-7901后,Caspase-9和Caspase-3也活化,從而激活Caspase凋亡途徑,最終誘導細胞凋亡。這些結果說明,毒毛旋花子阿洛糖苷可以通過線粒體途徑誘導人胃腺癌SGC-7901細胞凋亡,是一種潛在的腫瘤治療的有效藥物。由于強心苷在大劑量應用時具有心臟毒性,故安全性問題成為其投入抗癌臨床應用的最大障礙。近期有報道通過對化合物結構的優化,可以降低其毒性,同時保留抗腫瘤活性[8],因此通過結構優化把毒毛旋花子阿洛糖苷的抗腫瘤活性控制在非毒性范圍內是一個亟待解決的問題。
[1]Gheorghiade M.Digoxin therapy in chronic heart failure [J].Cardiovasc Drugs Ther,1997,11(Suppl 1):279-283.
[2]Dai HF,Gan YJ,Que DM,et al.Two new cytotoxic cardenolides from the latex of Antiaris toxicaria [J].J Asian Nat Prod Res,2009,11(9):832-837.
[3]Mei WL,Gan YJ,Que DM,et al.Study on the chemical constituents from the latex of antiaris toxicaria[J].Chinese Journal of Organic Chemistry,2011,31(4):533-537.(in Chinese) 梅文莉,干玉娟,闕東枚,等.見血封喉乳汁中的化學成分研究 [J].有機化學,2011,31(4):533-537.
[4]Que DM,Mei WL,Dai HF.Cytotoxic cardenolides from the latex of antiaris toxicaria[J].Journal of Tropical and Subtropcal Botany,2010,18(4):440-444.(in Chinese) 闕東枚,梅文莉,戴好富.見血封喉乳汁中具有細胞毒活性的強心苷[J].熱帶亞熱帶植物學報,2010,18(4):440-444.
[5]Dong WH,Mei WL,Zeng YB,et al.Cardenolides from the seeds of antiaris toxicaria and their cytotoxicity[J].Journal of Tropical and Subtropcal Botany,2011,19(2):171-176.(in Chinese) 董文化,梅文莉,曾艷波,等.見血封喉種子強心苷類化合物及其細胞毒活性[J].熱帶亞熱帶植物學報,2011,19(2):171-176.
[6]Packer M,Cohn JN.Consensus recommendations for the management of chronic heart failure.On behalf of the membership of the advisory council to improve outcomes nationwide in heart failure [J].Am J Cardiol,1999,83(2A):1A-38.
[7]Guo JL,Zheng SJ,Li YN,et al.Toxicarioside A inhibits SGC-7901 proliferation,migration and invasion via NF-κB/bFGF signaling [J].World J Gastroenterol,2012,18(14):1602-1609.
[8]Juncker T,Cerella C,Teiten MH,et al.UNBS1450,a steroid cardiac glycoside inducing apoptotic cell death in human leukemia cell [J].Biochem Pharmacol,2011,81(1):13-23.
[9]Sun XD,Mu R,Zhou YS,et al.Analysis of mortality rate of stomach cancer and its trend in twenty years in China [J].Chinese Journal of Oncology,2004,26 (1):4-9.(in Chinese) 孫秀娣,牧人,周有尚,等.中國胃癌死亡率20年變化情況分析及其發展趨勢預測[J].中華腫瘤雜志,2004,26 (1):4-9.[10]Yaguchi T,Fujikawa H,Nishizaki T.Linoleic acide derivative DCP-LA protects neurons from oxidative stress-induced apoptosis by inhbiting activation of caspase-3/-9 [J].Neurochemi Res,2010,35(5):712-717.
[11]Peter ME,Heufelder AE,Hengartner MO,et al.Advances in apoptosis research [J].Proc Natl Acad Sci U S A,1997,94(24):12736-12737.
[12]Ashkenazi A,Dixit VM.Death receptor:signaling and modulation [J].Science,1998,281(5381):1305-1308.
[13]Crow MT,Mani K,Nam YJ,et al.The mitochondrial death pathway and cardiac myocyte apoptosis [J].Circ Res,2004,95(10):957-970.
[14]Ma X,Zhang LH,Wang LR,et al.Single-walled carbon nanotubes alter cytochrome c electron transfer and modulate mitochondrial function [J].ACS Nano,2012,6(12):10486-10496.
[15]Jiang X,Wang X.Cytochrome C-mediated apoptosis [J].Annu Rev Biochem,2004,73:87-106.
[16]Norberg E,Orrenius S,Zhivotovsky B,et al.Mitochondrial regulation of cell death:processing of apoptosis-inducing factor (AIF) [J].Biochem Biophys Res Commun,2010,396(1):95-100.
(本文編輯:陳素芳)
Apoptosis of Gastric Adenocarcinoma Cells Type SGC-7901 Induced by Strophalloside and Its Mechanism
ZHANGXue-jiao,MEIWen-li,CAICai-hong,etal.
DaliUniversity,Dali671099,China
Objective To explore the apoptosis-inducing effect of Strophalloside on gastric adenocarcinoma cells type SGC-7901 and its mechanism.Methods The human gastric adenocarcinoma cells type SGC-7901 were divided into control group,0.125 μg/ml group,0.250 μg/ml group,0.500 μg/ml group,and 1.000 μg/ml group.The growth inhibition effect of Strophalloside on gastric adenocarcinoma cells type SGC-7901 was detected by MTT assay,and the apoptosis was measured by Annexin V-FITC/PI flow cytometry and Hoechst staining.The changes of mitochondrial membrane potential were examined by JC-1 kit.The expressions of mitochondrial pathway-related protein cytochrome C,Caspase-3 and Caspase-9 were detected by Western blotting analysis.Results According to MTT assay results,there were significant differences in value A and rate of growth inhibition of gastric adenocarcinoma cells type SGC-7901 among different groups at 24 h and 48 h after treatment,respectively (P<0.05);comparison of the above two indicators between groups showed that value A of gastric adenocarcinoma cells type SGC-7901 decreased sequentially,and rate of growth inhibition increased sequentially (P<0.05).By fluorescence microscope,the cell nucleus of control group showed homogeneous blue fluorescence,the cell nucleus of 0.500 μg/ml group showed compact bright fluorescence with white color.There was significant difference in total relative mortality of gastric adenocarcinoma cells type SGC-7901 among different groups (P<0.05);comparison of the above indicator between groups showed that total relative mortality of gastric adenocarcinoma cells type SGC-7901 increased sequentially (P<0.05).According to results of JC-1 staining,gastric adenocarcinoma cells type SGC-7901 showed green fluorescence 12 h after Strophalloside treatment,and fluorescence intensity increased as concentration of Strophalloside rised.According to Western blotting results,cytochrome C was released from mitochondria into cytoplasm C,and Caspase-3 and Caspase-9 were activated,shear and activation occurred,the expression level of activated fragments increased.Conclusion Strophalloside can induce apoptosis of gastric adenocarcinoma cells type SGC-7901 through the mitochondria-mediated pathway.
Stomach neoplasms;Strophanthins;Mitochondria;Apoptosis
國家自然科學基金資助項目(30860345);國家科技支撐計劃課題資助項目(2013BAI11B04);公益性行業(農業)科研專項(201303117)
671099云南省大理市,大理學院(張雪嬌);中國熱帶農業科學院熱帶生物技術研究所(梅文莉,蔡彩虹,董文化,戴好富);大理學院藥物研究所(姜北);海南醫學院海南省熱帶病重點實驗室(黃風迎)
黃風迎,571101海南省海口市,海南醫學院海南省熱帶病重點實驗室;E-mail:fyhuang16@126.com
戴好富,570100海南省海口市,中國熱帶農業科學院熱帶生物技術研究所;E-mail:daihaofu@itbb.org.cn
R 735.2
A
10.3969/j.issn.1007-9572.2015.15.003
2014-06-28;
2015-01-06)

