黃芩苷對人結腸癌SW480細胞凋亡的誘導作用及其機制
賴明廣,青海濤,王立生 ,劉圣活
(1.廣東省深圳市龍崗區中醫院腔鏡中心,廣東 深圳518100;2.南方醫科大學南方醫院消化內科,廣東 廣州 510515;3.暨南大學第二臨床醫學院消化內科,廣東 深圳518020)
黃芩苷對人結腸癌SW480細胞凋亡的誘導作用及其機制
賴明廣1,青海濤2,王立生3,劉圣活1
(1.廣東省深圳市龍崗區中醫院腔鏡中心,廣東 深圳518100;2.南方醫科大學南方醫院消化內科,廣東 廣州 510515;3.暨南大學第二臨床醫學院消化內科,廣東 深圳518020)
目的:探討黃芩苷對人結腸癌SW480細胞凋亡的影響,并闡明其作用機制。 方法:SW480細胞分為空白對照組,25、50和100 μmol·L-1黃芩苷組,采用CCK-8法檢測SW480細胞增殖活性,Annexin Ⅴ-FITC和DAPI染色觀察SW480細胞凋亡的形態學表現,Western blotting法檢測凋亡蛋白Bcl-2、caspase 3和caspase 9表達水平。 結果:與空白對照組比較,50和100 μmol·L-1黃芩苷組SW480細胞增殖活性在24、48和72 h均明顯降低(P<0.01),25 μmol·L-1黃芩苷組SW480細胞增殖活性在48和72 h明顯降低(P<0.01)。50 μmol·L-1黃芩苷作用48 h時SW480細胞處于早期或晚期凋亡狀態,細胞核呈濃縮和破碎狀態。與空白對照組比較,25、50和100 μmol·L-1黃芩苷組caspase 3和caspase 9蛋白表達水平明顯升高 (P<0.05或P<0.01),Bcl 2蛋白表達水平明顯降低 (P<0.05或P<0.01)。結論:黃芩苷可以誘導SW480細胞凋亡,其機制可能與線粒體途經有關。
黃芩苷;SW480細胞;細胞凋亡; Bcl 2;caspase 3;caspase 9
黃芩在我國藥用歷史悠久,迄今已有2千多年的應用歷史。黃芩苷(baicalin)是黃芩的干燥根中提取的有效成分之一,又稱黃芩黃素,其單體的化學名為6,7-三羥基黃酮。研究[1-3]表明:黃芩苷具有抑菌、清熱、利尿、降壓、利膽、鎮靜、抗炎和抗變態反應等活性,還可抑制多種腫瘤細胞的增殖,具有明顯的抗腫瘤活性,但具體的信號轉導途徑和機制尚不清楚[4-7]。結腸癌是胃腸道最常見的惡性腫瘤之一,近年來其發病率和死亡率都有逐漸上升的趨勢。2014年世界衛生組織分析表明:中國新增癌癥病例和死亡人數為世界首位,其中大腸癌位列第3位[8]。美國的統計結果[9]顯示:惡性腫瘤中大腸癌的發病率及致死率均居第3位。因此,針對結腸癌進行預防與治療的新藥物研發是國內外的研究熱點之一。國內外的研究[10-11]提示:黃芩苷能夠抑制腸癌的增生和誘導腸癌細胞的凋亡,但具體作用機制不明。本研究對黃芩苷誘導人結腸癌SW480細胞凋亡作用及可能的作用機制進行了初步研究,以期為臨床應用提供理論依據。
1 材料與方法
1.1細胞、主要試劑和儀器 人結腸腺癌細胞SW480由深圳市人民醫院中心實驗室傳代保存。黃芩苷購自美國Sigma公司,CCK-8購自日本Dojindo公司,Annexin V-FITC細胞凋亡檢測試劑盒和DAPI購自南京凱基生物公司, caspase 3和caspase 9抗體購自美國Santa Cruz公司。酶標儀為美國BIO-TEK公司產品,型號ELx800;顯微鏡為日本奧林巴斯,型號IX71。
1.2實驗分組實驗分為空白對照組和黃芩苷組,根據藥物濃度設25、50和100 μmol·L-13個濃度組, 觀察各組細胞的增殖、凋亡及相關凋亡蛋白的變化情況。
1.3CCK-8法檢測細胞增殖活性用胰蛋白酶消化狀態良好的SW480細胞,用完全培養液重懸后調整細胞密度為1×105mL-1,在96孔板中每孔加入50 μL細胞懸液,則每孔含5 000個細胞。將培養板置于5% CO2、37℃培養箱中培養過夜,棄上清,加入終濃度為25、50和100 μmol·L-1黃芩苷細胞培養液,空白對照組用不含黃芩苷的細胞培養液,每組設3個復孔。分別于培養 24、48和72 h,加入CCK-8溶液10 μL,混勻后置培養箱內孵育4 h,用酶標儀測定在450 nm處的吸光度(A)值。以A值大小表示細胞增殖活性,A值越大細胞增殖活性越高;反之亦然。
1.4Annexin V-FITC染色檢測細胞凋亡取對數生長期的SW480細胞,按每孔16 000~28 000個細胞將細胞接種于24孔培養板中培養12 h,設置空白對照組和50 μmol·L-1黃芩苷組,再培養48 h。將樣品用PBS洗滌2次,在500 μL的Binding Buffer中加入5 μL Annexin Ⅴ-FITC,5 μL Propidium Iodide,混勻;將上述溶液滴于蓋玻片表面均勻覆蓋;室溫、避光5 min,于熒光顯微鏡下觀察和拍照。
1.5DAPI染色觀察細胞核特征形態取對數生長期的SW480細胞,按每孔16 000~28 000個細胞將細胞接種于24孔培養板中培養12 h,設立空白對照組和50 μmol·L-1黃芩苷組,再培養48 h。用4%多聚甲醛固定10 min以上,蒸餾水洗滌2 次,加入200 μL DAPI染色液,室溫放置5 min,吸除DAPI染色液, PBS洗滌3次,熒光顯微鏡下觀察和拍照。
1.6Western blotting法檢測凋亡蛋白Bcl-2、caspase 3和caspase 9表達水平收集空白對照組和25、50、100 μmol·L-1黃芩苷組處理48 h的細胞,用細胞裂解液裂解SW480細胞,提取總蛋白,后用 10%分離膠 SDS-PAGE電泳。濕轉參數:恒流 110 mA,轉膜180 min;5%脫脂奶粉室溫封閉1 h,4℃孵育一抗封閉過夜,再室溫孵育二抗1 h。一抗分別為兔抗人β-actin(1∶2 000),鼠抗人Bcl-2(1∶2 000),兔抗人caspase 3(1∶2 000),鼠抗人caspase 9(1∶2 000)。TBST洗滌,ECL 顯色,化學發光拍照,對圖像進行灰度值數據分析。

2 結 果
2.1CCK-8實驗檢測各組 SW480增殖活性CCK-8法檢測結果:與對照組比較,50和100 μmol·L-1黃芩苷組SW480細胞增殖活性在24、48和72 h均明顯下降(P<0.01)。與對照組比較,25 μmol·L-1黃芩苷組SW480細胞增殖活性在48和72 h明顯下降(P<0.01)。見表1。
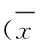
表1 CCK-8實驗檢測各組 SW480細胞增殖活性
*P<0.01 compared with blank control group.
2.2SW480細胞凋亡的特征性形態學表現①Annexin V-FITC染色:Annexin V通過與凋亡早期細胞外側暴露的磷脂酰絲氨酸結合,故Annexin V被認為是檢測細胞早期凋亡的指標,其在藍光熒光照射下呈綠色,易于鑒定。化丙啶(Propidium Iodide,PI)是一種核酸染料,其不易穿過完整的細胞膜,但對于凋亡中晚期的細胞或者死亡細胞,PI能夠透過受損的細胞膜而使細胞核染紅。熒光顯微鏡觀察結果:50 μmol·L-1黃芩苷組的SW480細胞有凋亡的形態,雙色合成圖中只顯綠色的細胞屬于早期凋亡,既顯綠色又顯紅色的細胞則屬于晚期凋亡。見圖1(插頁三)。 ②DAPI染色:DAPI可穿透細胞膜與細胞核中的雙鏈DNA結合,凋亡晚期或死亡的細胞在顯微鏡下可以看到藍色熒光的細胞核。熒光顯微鏡觀察顯示:實驗組(50 μmol·L-1黃芩苷)細胞核的染色質高度凝聚、細胞核裂解為碎塊。見圖2(插頁三)。
2.3SW480細胞中caspase 3和caspas 9蛋白表達水平Western blotting法檢測結果:與空白對照組比較,25、50和100 μmol·L-1黃芩苷組caspase 3和caspase 9蛋白表達水平明顯升高 (P<0.05或P<0.01),Bcl 2蛋白表達水平明顯降低 (P<0.05或P<0.01)。見圖3和表2。

Lane 1:Blank control group;Lane 2-4: 25,50,and 100 μmol·L-1baicalin groups.
圖3Western blotting法檢測凋亡相關蛋白Bcl-2,caspase 3和caspase 9表達
Fig.3Expressions of apoptosis-related proteins Bcl-2,caspase 3 and caspase 9 detected by Western blotting method
表2 各組SW480細胞中Bcl-2、 caspase 3和caspase 9蛋白相對表達水平
*P<0.05,**P<0.01 compared with blank control group.
3 討 論
黃芩苷是從中藥黃芩干燥的根中提取的一種天然化合物,是黃芩的主要生物活性成分,對大腸癌和宮頸癌等腫瘤均有一定的治療作用[12-13],但目前黃芩苷抗腫瘤的作用機制仍不十分清楚,黃芩苷使用的劑量范圍和適宜的給藥方法尚不明確,阻礙了其在臨床的應用[14-15]。本研究結果顯示:黃芩苷對人結腸癌SW480細胞增殖有抑制作用,其抑制作用呈濃度和時間依賴性,同時黃芩苷能誘導SW480細胞凋亡。本研究結果顯示:黃芩苷組的細胞核部分染色質出現濃縮狀態,并有高度凝聚、邊緣化,細胞核裂解為碎塊,產生破碎小體,細胞形態呈凋亡狀態,初步判斷黃芩苷具有誘導SW480細胞凋亡的作用。細胞凋亡的發生和發展受到精確調控,各種胞外凋亡信號通過特定的信號通路傳至胞內,激活靶分子而引發細胞凋亡。細胞凋亡分為caspase依賴型和caspase非依賴型。caspase依賴型通過線粒體途徑和死亡受體途徑2種方式啟動凋亡;線粒體凋亡通路由含BH3結構域的Bcl-2家族構成,包含Bid、Bad、Bim、Harikari和Noxa等,在接受到胞內的死亡信號后該信號通路激活[16-17]。細胞色素C (Cyt C)的釋放是線粒體凋亡路徑的關鍵步驟,在ATP/dATP協助下,Cyt C與凋亡蛋白酶活化因子(Apaf-1) 結合后形成多聚體,通過Apaf-1氨基端的caspase募集結構域募集胞質中的caspase 9前體,啟動caspase級聯反應,激活下游的caspase 3,完成相應底物的剪切,引起細胞凋亡[18]。目前,研究較多的與細胞凋亡相關的分子包括Bcl-2、caspase 3和caspase 9等[19-21]。本研究結果表明:黃芩苷作用SW480細胞48 h,Bcl-2表達水平隨著藥物濃度的升高而下降,caspase 3和caspase 9蛋白表達則相反,提示黃芩苷誘導SW480細胞凋亡可能與線粒體途徑有關。
綜上所述,黃芩苷可以抑制SW480細胞增殖,誘導細胞凋亡,其作用機制可能與線粒體途徑有關。
[1]Chow JM,Huang GC,Shen SC,et al.Differential apoptotic effect of Wogonin and nor-Wogonin via stimulation of ROS production in human leukemia cells[J]. J Cell Biochem,2008,103 (5):1394-1404.
[2]Lin YT,Yang JS,Lin HJ,et al. Baicalein induces apoptosis in SCC-4 human tongue cancer cells via a Ca2+- dependent mitochondrial path way [J].InVivo,2007,21(6): 1053-1058.
[3]毛捷,徐善水,盛莉莉,等.黃芩素的抗腫瘤作用及機制的研究進展[J].中國臨床藥理學與治療學,2009,14(10) :1178-1182.
[4]Ma GZ,Liu CH,Wei B,et al.Baicalein inhibits DMBA/TPA-induced skin tumorigenesis in mice by modulating proliferation,apoptosis,and inflammation[J].Inflammation,2013,36(2): 457-467.
[5]Miocinovicr R,Mccabe N,Keck R,et al.Invivoandinvitroeffect of baicalein on human prostate cancer cells[J]. Int J Oncol,2005,26 (1): 241-246.
[6]Taniguchi H,Yoshida T,Horinaka M,et al. Baicalein over comes tumor necrosis factor-related apoptosis-inducing ligand resistance via two different cell-specific pathways in cancer cellsbut not innormal cells[J]. Cancer Res,2008,68 (21):8918-8927.
[7]姚蕾,鐘淑霞,蘭珊珊,等.黃芩苷聯合NB-UVB對黑素細胞黑素合成及酪氨酸酶活性的影響[J].吉林大學學報:醫學版,2014,40(5):1024-1027.
[8]Bernard WS,Christopher PW.World cancer report 2014[M].Lyon:International Agency for Research on Cancer,2014.
[9]Siegel R,DeSantis C,Jemal A.Colorectal cancer statistics,2014[J].CA Cancer J Clin,2014,64(2): 104-117.
[10]Chen WC,Kuo TH,Tzeng YS,et al.Baicalin induces apoptosis in SW620 human colorectal carcinoma cells in vitro and suppresses tumor growth in vivo[J].Molecules,2012,17(4): 3844-3857.
[11]陳紅錦.黃芩苷干預錯配修復基因功能缺失的裸鼠結腸原位移植瘤的作用及分子機制研究[D].南京:南京中醫藥大學,2013.
[12]Fu Z,Di Y,Gao L,et al.The Drug Metabolism and Pharmacokinetics Investigation about Baicalin Effect and Baicalein on Mice U14 Cervical Cancer [J].J Spectrosc,2015.doi:10.1155/2015/632062.
[13]Feng J,Guo C,Zhu Y,et al.Baicalin down regulates the expression of TLR4 and NFkB-p65 in colon tissue in mice with colitis induced by dextran sulfate sodium [J].Int J Clin Exp Med,2014,7(11): 4063-4072.
[14]Wang W,Guo QL,You QD,et al.The anticancer activities of Wogonin in murine sarcoma S180 bothinvitroandinvivo[J].Biol Pharm Bull,2006,29(6):1132-1137.
[15]楊明,鐘銳生,陳桂紅.黃芩苷對人鼻咽癌CNE-2Z細胞生長的抑制作用[J].廣東藥學院學報,2011,27(4):400-403.
[16]Eskes R,Desagher S,Antonsson B,et al.Bid induces the oligomerization and insertion of Bax into the outermitochondrial membrane [J].Mol Cell Biol,2000,20 (3): 929-935.
[17]Miramar MD,Costantini P,Ravagnan L,et al.NADH oxidase activity of mitochondrial apoptosis - inducing factor [J].J Biol Chem,2001,276 (19): 16391-16398.
[18]Chandrashekar N,Selvamani A,SubramanianR,et al.Baicaleinin hibits pulmonary carcinogenesis-associated inflammation and interferes with COX-2,MMP-2 and MMP-9 expressions in-vivo[J]. Toxicol Appl Pahrmacol,2012,261 (1):10-21.
[19]Jarskog LF,Selinger ES,Lieberman JA,et al.Apoptotic proteins in the temporal cortex in schizophrenia: high Bax/Bcl-2 ratio without caspase-3 activation[J].Am J Psychiatry,2004,161(1):109-115.
[20]Floyd DH,Zhang Y,Dey BK,et al.Novel anti-apoptotic microRNAs 582-5p and 363 promote human glioblastoma stem cell survival via direct inhibition of caspase 3,caspase 9,and Bim[J].PLoS One,2014,9(5): e96239.
[21]沈藝南,黃晟宇,胡賢榮,等.腹腔鏡肝切除術治療結腸癌肝轉移的系統評價[J].臨床肝膽病雜志,2014,30(12):1287-1291.
Induction effect of baicalin on apoptosis of human colon cancer SW480 cells and its mechanism
LAI Mingguang1,QING Haitao2,WANG Lisheng3LIU Shenghuo1
(1.Laparoscope Center,Shenzhen Longgang Hospital of TCM,Guangdong Province,Shenzhen 518100,China;2. Department of Gastroenterology,Nanfang Hospital,Nanfang Medical University,Guangzhou 510515,China;3.Department of Gastroenterology,Jinan University of Medical Sciences,Shenzhen Municipal People’s Hospital,Shenzhen 518020,China)
Objective To investigate the influence of baicalin in human colon cancer SW480 cells,and to clarify its mechanism.Methods The SW480 cells were cultured and divided into blank control and 25,50 and 100 μmol·L-1baicalin groups.The proliferation activity was detected with CCK-8 assay.The morphological changes of SW480 cells were detected by Annexin Ⅴ-FITC and DAPI coloration.The protein expression levels of Bcl-2,caspase 3 and caspase 9 were detected by Western blotting method.Results The CCK-8 assay results showed that the proliferation activities of SW480 cells in 25,50 and 100 μmol·L-1baicalin groups were decreased significantly compared with blank control group at the time points of 24 h,48 h and 72 h (P<0.01),the proliferation activities of SW480 cells in 25 μmol·L-1baicalin groups were decreased significantly compared with blank control group at the time points of 48 and 72 h (P<0.01).Cell shrinkage and nucleus fragmentation were observed in the SW480 cells after treated with 50 μmol·L-1baicalin for 48 h.The Western blotting assay results showed that compared with blank control group,the protein expression levels of caspase 3 and caspase 9 in 25,50 and 100 μmol·L-1baicalin groups were increased significantly (P<0.05 orP<0.01),and the protein expression levels of Bcl 2 in 25,50 and 100 μmol·L-1baicalin groups were decreased significantly (P<0.05 orP<0.01).Conclusion Baicalin can induce the apoptosis in SW480 cells,and the effect might be involved with the mitochondrial apoptotic pathway.
baicalin;SW480 cells;apoptosis;Bcl-2;caspase 3;caspase 9
1671-587Ⅹ(2015)06-1158-05
10.13481/j.1671-587x.20150612
2015-05-06
國家自然科學基金資助課題(81201662)
賴明廣(1980-),男,廣東省深圳市人,主治醫師,醫學博士,主要從事大腸癌的基礎與臨床方面的研究。
賴明廣,主治醫師(Tel: 0755-89911830,E-mail: lmg198002@163.com)
R363.2
A

