吡格列酮對尿毒癥ApoE-/-小鼠調節性和效應T細胞平衡的影響*
申燕,肖嫣,王麗君,趙艷,田雨靈,梁瀟,尹愛萍(西安交通大學醫學院第一附屬醫院腎病中心腎內科,心內科,西安交通大學環境與疾病相關基因教育部重點實驗室,陜西西安7006)
吡格列酮對尿毒癥ApoE-/-小鼠調節性和效應T細胞平衡的影響*
申燕1△,肖嫣2,王麗君3,趙艷2,田雨靈2,梁瀟2,尹愛萍1
(西安交通大學醫學院第一附屬醫院1腎病中心腎內科,2心內科,
3西安交通大學環境與疾病相關基因教育部重點實驗室,陜西西安710061)
目的:觀察吡格列酮對體外培養的有或無斑塊特異性抗原氧化低密度脂蛋白(oxLDL)刺激的尿毒癥ApoE-/-小鼠調節性和效應T細胞(Treg/Teff)水平和功能相關因子的影響及可能機制。方法:通過兩步外科手術法建立尿毒癥ApoE-/-小鼠的動物模型,以不同濃度吡格列酮(2μmol/L和20μmol/L)及PPARγ拮抗劑GW9662(5μmol/L)對有或無oxLDL(2 mg/L)刺激的尿毒癥模型鼠脾細胞作用12 h后,流式細胞術檢測CD4+CD25+Foxp3+Treg及IFN-γ+CD4+Teff細胞水平,實時熒光定量PCR檢測Foxp3及IFNγ的mRNA表達。結果: oxLDL體外誘導尿毒癥ApoE-/-小鼠脾細胞Treg/Teff失衡。吡格列酮上調oxLDL抑制下的Treg及Foxp3的表達,此作用不能被GW9662拮抗;下調有或無oxLDL刺激下Teff及IFNγ的表達,此作用可被GW9662拮抗。結論:ox-LDL體外誘導尿毒癥模型鼠Treg/Teff失衡,吡格列酮通過PPARγ非依賴/依賴機制調整Treg/Teff失衡。
吡格列酮;過氧化物酶體增殖物激活受體γ;尿毒癥;調節性T細胞;效應T細胞
[ABSTRACT]AIM:To investigate the effects of pioglitazone on the quantity and function-related factors of regulatory and effector T cells(Treg and Teff)of uremic apolipoprotein E knockoutmice in vitro with orwithout the stimulation of atherosclerotic plaque-specific antigen oxidized low-density lipoprotein(oxLDL).METHODS:Uremic apolipoprotein E knockoutmouse model was established by 2-step surgical procedure.After intervention with different concentrations(2 μmol/L and 20μmol/L)of pioglitazone and PPARγantagonistGW9662(5μmol/L)on splenocytes ofuremicmice for12 h in the presence or absence of oxLDL(2mg/L),the levels of CD4+CD25+Foxp3+Treg and IFNγ+CD4+Teffwere determined by flow cytometry.ThemRNA expressions of Foxp3 and IFNγwas detected by real-time fluorescent quantitative PCR.RESULTS:In vitro,oxLDL induced a Treg/Teff imbalance in splenocytes from the uremic mice.Pioglitazone upregulated the level of Treg and mRNA expression of Foxp3 in the presence of oxLDL,which was not antagonized by GW9662.Meanwhile,pioglitazone downregulated the level of Teff and mRNA expression of IFNγin the presence or absence of oxLDL,which was reversed by GW9662.CONCLUSION:oxLDL induces a Treg/Teff imbalance in uremic apolipoprotein E knockoutmice.Pioglitazone modulates the Treg/Teff imbalance probably through PPARγ-independent and -dependentmechanisms.
[KEY WORDS]Pioglitazone;Peroxisome proliferator-activated receptorγ;Uremia;Regulatory T cells;Effector T cells
動脈粥樣硬化(atherosclerosis,AS)是終末期腎病患者最常見的心血管并發癥之一,且其病變進展快、范圍廣,已成為影響終末期腎病患者預后的重要因素[1]。但迄今為止,其發病機制仍不十分清楚,傳統的抗AS治療藥物效果不佳。多數學者認為AS是血管壁的慢性炎癥反應,T細胞亞群的活化和狀態是其中的關鍵環節[2]。最近的研究表明效應T細胞(effector T cells,Teff)促進AS發展,而調節性T細胞(regulatory T cells,Treg)則可抑制Teff而減緩AS進程[3]。有研究發現Treg/Teff平衡失調是終末期腎病患者AS發生發展的可能機制[4]。改善Treg/Teff失衡有可能成為延緩終末期腎病患者AS進展的新的治療靶點。我們最近的研究表明過氧化物酶體增殖物激活受體γ(peroxisome proliferator-activated receptorγ,PPARγ)的配體吡格列酮(pioglitazone,PIO)可減輕尿毒癥載脂蛋白E基因敲除(apolipoprotein E knockout,ApoE-/-)小鼠AS的進展并使斑塊的穩定性增加[5]。因此本研究通過建立尿毒癥ApoE-/-小鼠模型,觀察氧化低密度脂蛋白(oxidized low-density lipoprotein,oxLDL)對模型鼠脾細胞Treg/Teff平衡的影響及PIO可否調控Treg/Teff平衡及可能機制,為PIO延緩終末期腎病、加速AS進展的機制提供理論依據。
材料和方法
1實驗動物、主要試劑和儀器
C57BL/6J遺傳背景的ApoE-/-種鼠(B6.129P2-ApoEtm1Unc)購自中國南京大學模式動物遺傳研究中心,飼養于西安交通大學醫學院動物實驗中心層流室,出生后4周離乳,喂以標準飼料:5%脂肪、18.9%蛋白質、72.3%碳水化合物、1.01%鈣及0.65%磷。
鹽酸吡格列酮原藥由江蘇恒瑞醫藥有限公司饋贈;GW9662購自ALEXIS;oxLDL購自中山醫科大學生物化學實驗室;佛波酯、monensin、ionomycin和伴刀豆球蛋白A(concanavalin A,ConA)購自Sigma; RNAfast200總RNA極速抽取試劑盒購自上海飛捷生物技術有限公司;逆轉錄試劑盒RevertAidTMFirst Strand cDNA Synthesis Kit購自Fermentas;SYBR?Premix Ex TaqTMRT-PCR Kit購自TaKaRa;PE標記抗小鼠干擾素γ(interferonγ,IFNγ)單克隆抗體和小鼠調節性T細胞流式細胞儀檢測試劑盒購自eBioscience。
FACScan流式細胞儀(BD)由西安交通大學醫學
院中心實驗室提供;IQ5實時定量PCR儀(Bio-Rad)由西安交通大學環境與疾病相關基因教育部重點實驗室提供;Hitachi706全自動生化分析儀由西安交通大學醫學院第一附屬醫院檢驗科提供;932型電燒灼器由西安交通大學醫學院機能中心提供。
2方法
2.1尿毒癥ApoE-/-小鼠動物模型的建立取8周齡雄性ApoE-/-小鼠,參照Nikolov等[6]的方法,采用2步外科手術法建立尿毒癥模型:10%水合氯醛腹腔內麻醉后行2 cm側腹切口,暴露右腎,仔細處理輸尿管及避免損傷腎上腺,電凝整個皮質除了腎門周圍2 mm完整組織,縫合肌層和皮膚;2周后,通過相似切口暴露左腎,在雙結扎腎血管及輸尿管后左腎被摘除,縫合肌層和皮膚。對照組行假手術:雙腎被膜剝離(8周暴露右腎,10周暴露左腎)。第2次手術后2周,尿毒癥和對照組ApoE-/-小鼠各8只采集血標本檢測血尿素氮(blood urea nitrogen,BUN)、肌酐(creatinine,Cr)、總膽固醇(total cholesterol,TC)和甘油三酯(triglyceride,TG)。
2.2分離尿毒癥ApoE-/-小鼠脾細胞16周齡尿毒癥模型鼠脫頸處死,75%乙醇浸泡5~10 min;左腹部朝上,剪開皮膚并分離筋膜,剪開肌肉層,暴露并分離脾臟;RPMI-1640培養液沖洗脾臟,剔除筋膜組織,轉移至200目鋼濾網,用玻璃針芯充分研磨; RPMI-1640培養液沖洗脾細胞至無菌培養皿中,收集脾細胞懸液,用紅細胞裂解液混勻靜置5 min,1 500 r/min離心7 min,棄上清;RPMI-1640培養液洗滌,1 500 r/min離心7 min,棄上清;重懸并調整細胞密度為2.2×109/L。
2.3實驗分組及干預脾細胞懸液接種于6孔板,每孔1~1.5 mL,以含有PIO(或DMSO)的RPMI-1640培養液稀釋1倍,分別加入ConA(5 mg/L)、10%胎牛血清,按分組加或不加oxLDL和GW9662 (5μmol/L)。oxLDL干預濃度依據參考文獻[7],以0、1、2、3及5 mg/L進行預實驗,結果與文獻一致,CD4+CD25+T細胞呈劑量依賴性下降,故以濃度2 mg/L作為本次實驗干預濃度。
2.4流式細胞儀檢測CD4+IFNγ+Teff數目細胞孵育8 h后分別加入ionomycin(1 mg/L)、monensin (1.7 mg/L)和佛波酯(25μg/L),繼續孵育4 h;收集細胞于EP管后1 500 r/min,4℃離心7 min,棄上清;流式緩沖液洗滌后重懸,加入含FITC-CD4或FITC-IgG2b的流式緩沖液100μL,4℃避光孵育30 min;洗滌后加入固定/破膜工作液0.8 mL,4℃避光孵育45 min;1 500 r/min離心7 min,棄上清;緩沖液洗滌后加入PE-IFNγ抗體1μL,對照管加入PE-IgG1抗體1μL,4℃避光孵育30 min;洗滌后重懸至500 μL,流式細胞儀檢測。
2.5流式細胞術檢測CD4+CD25+Foxp3+Treg數目收集細胞于EP管后1 500 r/min,4℃離心7 min后洗滌;重懸后加入含FITC-CD4抗體、PE-CD25抗體的流式緩沖液100μL,4℃避光孵育30 min;洗滌后加入固定/破膜工作液0.8 mL,4℃避光孵育90 min;1 500 r/min,離心7 min后洗滌;細胞重懸后加入APC-Foxp3抗體或APC-IgG2b 2μL,4℃避光孵育30 min;洗滌后重懸至500μL,流式細胞儀檢測。
2.6實時熒光定量PCR檢測尿毒癥ApoE-/-小鼠脾細胞IFNγ和Foxp3 mRNA的表達依據RNA fast 200試劑盒說明書提取總RNA;參照Fermentas逆轉錄試劑盒說明書合成cDNA;TaKaRa PCR試劑盒進行實時熒光定量PCR,擴增反應條件如下:95℃10 s;95℃5 s,58.5℃10 s,72℃10 s,40個循環。每個樣本均做3孔,GAPDH作為內參照。引物由北京三博遠志生物技術有限責任公司合成。IFNγ的上游引物為5’-ATTACTACCTTCTTCAGCAACAG-3’,下游引物為5’-CGAATCAGCAGCGACTCC-3’;Foxp3的上游引物為5’-CCCAGGAAAGACAGCAACCTT-3’,下游引物為5’-TTCTCACAACCAGGCCATTTG-3’;GAPDH的上游引物為5’-TCAACGGCACAGTCAAGG-3’,下游引物為5’-ACTCCACGACATACTCAGC-3’。分析mRNA的相對表達量用2-ΔΔCt方法[8]。
3統計學處理
使用SPSS 16.0統計軟件對數據進行分析,計量資料以均數±標準差(mean±SD)表示。兩樣本參數檢驗用t檢驗。多個樣本參數檢驗采用單因素方差分析(one-way ANOVA)方法,方差齊性用LSD檢驗,方差不齊用Dunnett’s C檢驗。以P<0.05為差異有統計學意義。
結果
1成功建立尿毒癥ApoE-/-小鼠模型
造模后2周,尿毒癥ApoE-/-小鼠的尿素氮、肌酐較對照組明顯升高(P<0.05),提示造模成功。尿毒癥ApoE-/-小鼠與對照ApoE-/-小鼠相比,血清總膽固醇升高(P<0.05),甘油三酯的差異無統計學意義(P>0.05),見表1。

表1 對照與尿毒癥ApoE-/-小鼠腎功能和血脂的比較Table 1.Comparison of renal functional parameters and serum lipids between control and uremic ApoE-/-mice(Mean±SD.n=8)
2PIO對尿毒癥模型鼠Teff水平的影響
以CD4+T細胞設門,將IFNγ+CD4+細胞在CD4+T細胞中的百分比視為Teff的水平。與溶劑對照組比較,2μmol/L和20μmol/L PIO均降低模型鼠脾細胞中Teff水平(P<0.05)。在oxLDL作用下,模型鼠脾細胞中Teff水平明顯升高(P<0.05),2 μmol/L和20μmol/L PIO降低oxLDL刺激下Teff水平(P<0.05),PPARγ拮抗劑GW9662可逆轉PIO的作用(P<0.05),見圖1。
3PIO對尿毒癥模型鼠脾細胞IFNγm RNA表達的影響
oxLDL上調尿毒癥模型鼠脾細胞IFNγ的mRNA表達(P<0.05)。2μmol/L和20μmol/L PIO降低模型鼠及oxLDL刺激的模型鼠脾細胞IFNγ的mRNA表達(P<0.01),GW9662可逆轉PIO的效應(P<0.01),見圖2。
4PIO對尿毒癥模型鼠Treg水平的影響
以CD4+T細胞設門,將CD4+CD25+Foxp3+細胞在CD4+T細胞中的百分比作為Treg的水平。PIO對模型鼠脾細胞Treg水平影響不顯著(P>0.05)。在oxLDL作用下,Treg水平降低(P<0.05),2μmol/ L和20μmol/L PIO分別增加oxLDL抑制下的Treg水平(P<0.01),GW9662不能拮抗PIO的作用(P>0.05),見圖3。
5PIO對尿毒癥模型鼠脾細胞Foxp3 m RNA表達的影響
oxLDL下調尿毒癥模型鼠脾細胞Foxp3 mRNA的表達(P<0.05)。PIO對模型鼠脾細胞Foxp3的mRNA表達無明顯影響(P>0.05),但可上調oxLDL作用下的模型鼠脾細胞Foxp3 mRNA的表達(P<0.05),且這一作用不被GW9662所拮抗(P>0.05),見圖4。

Figure 1.The effect of PIO on Teff level in the splenocytes of uremic ApoE-/-mice and the antagonism of GW9662 in vitro.Mean± SD.n=3.*P<0.05,**P<0.01 vs controlgroup;△P<0.05,△△P<0.01 vs oxLDL group;#P<0.05 vs PIO 2μmol/L group;▽P<0.05 vs PIO 20μmol/L group;$P<0.05 vs PIO 2μmol/L+oxLDL group;▲▲P<0.01 vs PIO 20μmol/L+ oxLDL group.圖1 PIO對尿毒癥ApoE-/-小鼠脾細胞Teff水平的影響及GW 9662的拮抗作用
討論
心血管疾病是慢性腎功能不全特別是尿毒癥患者最常見的死亡原因,AS是引起心血管并發癥的主要原因,并且進展更加迅速和嚴重。針對慢性腎衰患者高發的AS疾病,Lindner等[9]提出了“加速的AS”這一概念。我們前期的研究發現噻唑烷二酮(thiazolidinediones,TZD)類PPARγ配體PIO能延緩尿毒癥ApoE-/-小鼠主動脈加速發展的AS并使斑塊的穩定性增加,與上調尿毒癥模型鼠體內Treg數量和功能有關[5]。為了進一步探索PIO對尿毒癥狀態下Treg/Teff平衡的影響及可能機制,我們進行了此項體外實驗。
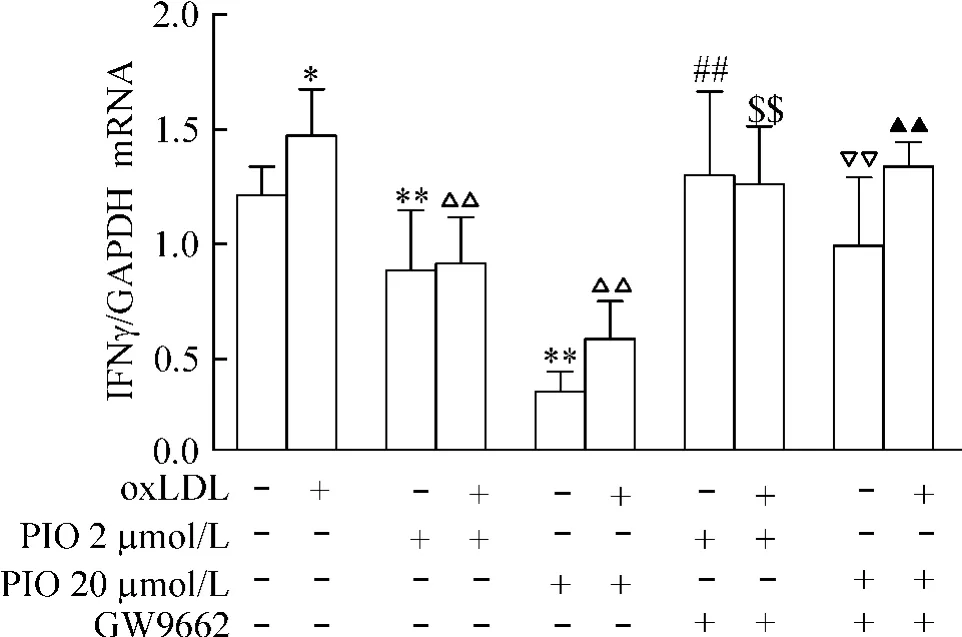
Figure 2.The effect of PIO on themRNA expression of IFNγin the splenocytes of uremic ApoE-/-mice and the antagonism of GW9662 in vitro.Mean±SD.n=3.*P<0.05,**P<0.01 vs control group;△△P<0.01 vs oxLDL group;##P<0.01 vs PIO 2μmol/L group;▽▽P<0.01 vs PIO 20μmol/L group;$$P<0.01 vs PIO 2μmol/L+oxLDL group;▲▲P<0.01 vs PIO 20 μmol/L+oxLDL.圖2 PIO對尿毒癥ApoE-/-小鼠脾細胞IFNγmRNA表達的影響及GW 9662的拮抗作用

Figure 3.The effectof PIO on the Treg level in the splenocytes of uremic ApoE-/-mice and the antagonism of GW9662 in vitro.Mean ±SD.n=3.*P<0.05 vs control group;△△P<0.01 vs oxLDL group.圖3 PIO對尿毒癥ApoE-/-小鼠脾細胞Treg水平的影響及GW 9662的拮抗作用
目前已經公認AS病變實質上是一種慢性炎癥反應或自身免疫性疾病,T淋巴細胞在其中發揮關鍵性作用[2]。CD4+CD25+Foxp3+調節性T細胞,具有抗炎和維持對自身抗原免疫耐受的作用,阻斷不同的免疫炎癥性疾病和抑制AS的進展[10]。Foxp3是Treg特異性的標志和發揮功能的關鍵因子[11]。效應性T細胞主要包括Th1、Th2和新近發現的Th17,通過促進免疫激活的不同方面而促進AS的進展[2]。病理性效應性T細胞主要通過分泌功能性細胞因子IFNγ加重AS局部的免疫炎癥反應。Treg可抑制Teff的致病免疫反應,抑制AS的形成發展。最近的證據表明Treg與致病性Teff的失衡促進免疫介導的AS進展和斑塊的不穩定[12-13]。在急性冠脈綜合癥患者中Treg數目減少、功能受損[14]。在動物模型中,獲得性轉移天然或抗原特異性的Treg緩解AS病變[7]。本研究發現oxLDL體外誘導尿毒癥ApoE-/-小鼠脾細胞Teff水平及其功能因子IFNγ表達上調,致Treg水平及其核轉錄因子Foxp3表達下降,即Treg/Teff平衡失調。有報道在終末期腎病患者中oxLDL誘導的氧化應激使Treg對Fas介導凋亡的敏感性提高,線粒體依賴凋亡途徑發生[15]。慢性腎衰體內存在氧化應激反應的增強[16]。因此結合我們的研究結果可以得出結論:尿毒癥狀態下提高的氧化應激使oxLDL產生增加,促進Treg凋亡,阻斷Treg信號傳導,導致外周Treg池的耗竭和Treg/Teff失衡。Treg數量功能的受損引起Teff功能增強,導致細胞免疫功能異常,促進尿毒癥模型鼠AS的進展。

Figure 4.The effectof PIO on themRNA expression of Foxp3 in the splenocytes of uremic ApoE-/-mice and the antagonism of GW9662 in vitro.Mean±SD.n=3.*P<0.05 vs control group;△P<0.05 vs oxLDL group.圖4 PIO對尿毒癥ApoE-/-小鼠脾細胞Foxp3 m RNA表達的影響及GW 9662的拮抗作用
如何調正Treg/Teff失衡成為預防和治療尿毒癥“加速AS”的關鍵所在。人AS斑塊處有PPARγ表達,提示PPARγ參與AS的病理過程。PPARγPIO屬于TZD類藥物,是PPARγ的藥理性配基。臨床試驗證實PIO治療可減輕2型糖尿病患者頸動脈AS病變[17]。本研究發現PIO抑制尿毒癥模型鼠脾細胞Teff水平及其功能性細胞因子IFNγ的表達,此作用可被PPARγ拮抗劑GW9662所逆轉,提示PIO通過PPARγ依賴途徑下調Teff水平和功能。本研究還發現PIO上調oxLDL抑制的尿毒癥模型鼠脾細胞Treg水平及其核轉錄因子Foxp3的表達,此作用不能被GW9662所逆轉,提示PIO通過非PPARγ依賴途徑上調Treg水平和功能。因此結合前期的研究,我們認為PIO通過PPARγ非依賴機制促進Treg的極化、PPARγ依賴機制抑制Teff的偏倚,調正Treg/Teff的失衡。PIO誘導尿毒癥模型鼠T細胞譜向抗AS方向轉化(更多的Treg及更少的Teff),提高的Treg數量活性導致減少的Teff細胞介導的致病反應,從而發揮延緩AS斑塊的進展和穩定斑塊的作用。
[1]Gansevoort RT,Correa-Rotter R,Hemmelgarn BR,et al.Chronic kidney disease and cardiovascular risk:epidemiology,mechanisms,and prevention[J].Lancet,2013,382(9889):339-352.
[2]Fredman G,Spite M.Recent advances in the role of immunity in atherosclerosis[J].Circ Res,2013,113(12): e111-e114.
[3]Tse K,Tse H,Sidney J,et al.T cells in atherosclerosis[J].Int Immunol,2013,25(11):615-622.
[4]Zhang J,Hua G,Zhang X,et al.Regulatory T cells/T-helper cell17 functional imbalance in uraemic patients on maintenance haemodialysis:a pivotal link between microinflammation and adverse cardiovascular events[J].Nephrology(Carlton),2010,15(1):33-41.
[5]申燕,袁祖貽,肖嫣,等.吡格列酮對尿毒癥ApoE-/-小鼠調節性T細胞和動脈粥樣硬化的影響[J].中國病理生理雜志,2010,26(5):833-838.
[6]Nikolov IG,Joki N,Nguyen-Khoa T,et al.Lanthanum carbonate,like sevelamer-HCl,retards the progression of vascular calcification and atherosclerosis in uremic apolipoprotein E-deficientmice[J].Nephrol Dial Transplant,2012,27(2):505-513.
[7]Mor A,Planer D,Luboshits G,et al.Role of naturally occurring CD4+CD25+regulatory T cells in experimental atherosclerosis[J].Arterioscler Thromb Vasc Biol,2007,27(4):893-900.
[8]Livak KJ,Schmittgen TD.Analysis of relative gene expression data using real-time quantitative PCR and the 2-ΔΔCTmethod[J].Methods,2001,25(4):402-408.
[9]Lindner A,Charra B,Sherrard DJ,et al.Accelerated atherosclerosis in prolonged maintenance hemodialysis[J].N Engl JMed,1974,290(13):697-701.
[10]Grant CR,Liberal R,Mieli-Vergani G,et al.Regulatory T-cells in autoimmune diseases:challenges,controversies and-yet-unanswered questions[J].Autoimmun Rev,2015,14(2):105-116.
[11]Rao DN,Naqvi RA.FoxP3:a key player in T regulatory biology[J].Indian JClin Biochem,2011,26(1):1-2.
[12]陳玉林,菅穎,劉民杰,等.動脈粥樣硬化小鼠輔助性T細胞17和調節性T細胞功能失衡的機制研究[J].中華心血管病雜志,2013,41(5):416-421.
[13]Klingenberg R,Gerdes N,Badeau RM,et al.Depletion of FOXP3+regulatory T cells promotes hypercholesterolemia and atherosclerosis[J].J Clin Invest,2013,123 (3):1323-1334.
[14]LiQ,Wang Y,Wang Y,et al.Treg/Th17 ratio acts as a novel indicator for acute coronary syndrome[J].Cell Biochem Biophys,2014,70(2):1489-1498.
[15]Meier P,Golshayan D,Blanc E,et al.Oxidized LDL modulates apoptosis of regulatory T cells in patients with ESRD[J].JAm Soc Nephrol,2009,20(6):1368-1384.
[16]Putri AY,Thaha M.Role of oxidative stress on chronic kidney disease progression[J].Acta Med Indones,2014,46(3):244-252.
[17]Yamasaki Y,Katakami N,Furukado S,et al.Long-term effects of pioglitazone on carotid atherosclerosis in Japanese patientswith type 2 diabetes without a recent history of macrovascular morbidity[J].J Atheroscler Thromb,2010,17(11):1132-1140.
Effect of pioglitazone on balance of regulatory and effector T cells of urem ic apolipoprotein E knockoutm ice in vitro
SHEN Yan1,XIAO Yan2,WANG Li-jun3,ZHAO Yan2,TIAN Yu-ling2,LIANG Xiao2,YIN Ai-ping1
(1Department of Nephrology,Center of Nephrology,2Department of Cardiovascular Medicine,The First Affiliated Hospital,Medical School of Xi,an Jiaotong University,Xi’an 710061,China;3 Key Laboratory of Ministry of Education for Environment and Genes Related to Diseases,Xi’an Jiaotong University,Xi’an 710061,China.E-mail:shenyan66@126.com)
R363;R692
A
10.3969/j.issn.1000-4718.2015.05.006
1000-4718(2015)05-0802-06
2015-01-26[修回日期]2015-03-17
國家自然科學基金資助項目(No.81200541);中央高校基本科研業務費專項資金(No.xjj2012065)
Tel:029-85323952;E-mail:shenyan66@126.com

