鹽度對生物陰極微生物燃料電池脫氮除碳及產電性能的影響
劉 明 金春姬,2 孫若晨
(1.中國海洋大學環境科學與工程學院,山東 青島 266100;2.中國海洋大學 海洋環境與生態教育部重點實驗室,山東 青島 266100)
水資源的短缺是全世界面臨的主要問題,沿海城市的海水代用是解決問題的一個重要途徑[1]。但是海水的利用勢必會產生含鹽廢水,會對微生物的物理和生化性能造成影響,導致微生物滲透壓改變,從而影響生物處理的性能[2]。
微生物燃料電池(MFC)是將微生物充當為催化劑,將化學能轉化成電能的系統[3]。其去除污染物同時產電的性能得到國內外學者的關注[4-8]。生物陰極MFC[9](BCMFC)使用微生物代替化學物質作為催化劑,解決了二次污染、催化劑中毒以及投資過高等問題。目前BCMFC已被證明能夠處理多種類型的廢水[10-12]。近幾年,研究者的目光集中在BCMFC脫氮除碳同時產電的研究上,使用陽極微生物降解有機物,陰極微生物實現同時硝化反硝化[10-13]。使用 BCMFC 處理含鹽廢水時,適當鹽度的增加會提高MFC的產電性能[14],但是鹽度過高會影響陽極和陰極微生物的新陳代謝[15],從而影響BCMFC去除污染物能力和產電性能。
本實驗配制不同濃度模擬海水,陰極采用間歇曝氣模式,研究了在鹽度影響下,BCMFC脫氮除碳及產電性能,進行了COD和氨氮去除的動力學和硝化反硝化酶活性的分析,以期為BCMFC處理含鹽廢水提供參考。
1 實驗部分
1.1 實驗裝置
實驗采用雙室 MFC構型[16],如圖1所示。由兩個長方形有機玻璃構成,兩個極室凈容積為0.5 L。陽極材料為碳布,表面積為35 cm2,陰極材料是表面積為35 cm2的光譜純石墨板,陰極室中填充1 cm×1 cm×1 cm的碳氈,有效陰極體積約為0.2 L。中間采用有效表面積為48 cm2的質子交換膜(PEM)將陽極室與陰極室分開。使用鈦絲將電極相連接,外接22~22 000 Ω電阻箱。
1.2 實驗設計
啟動5個不同鹽度的BCMFC,鹽度分別為0%、10%、30%、50%和70%海水比例(相對于海水鹽度的百分比,由海水晶提供,每升模擬廢水中分別含有0、3.5、10.5、17.5、24.5 g 海水晶)。每升模擬廢水中除了加入相應的海水晶外,含有乙酸鈉(2.0 g/L)、NaHCO3(1.0 g/L)、NH4Cl(0.3 g/L)、NaH2PO4·2H2O(6.08 g/L)、Na2HPO4·12H2O(21.8 g/L)及微生物所需的微量營養物質[17]。溫度維持在30±1℃。啟動過程采用間歇運行,逐步提高鹽度的方法。經過3個月的啟動期,改為陽極室使用蠕動泵連續供水,陰極保持啟動時的間歇曝氣模式。在1個周期內陰極運行的順序是進水0.5 h,曝氣6 h,停止曝氣2 h,出水0.5 h。將陽極室的出水收集到密閉容器中,陰極運行1個周期后再將陽極出水倒入陰極。
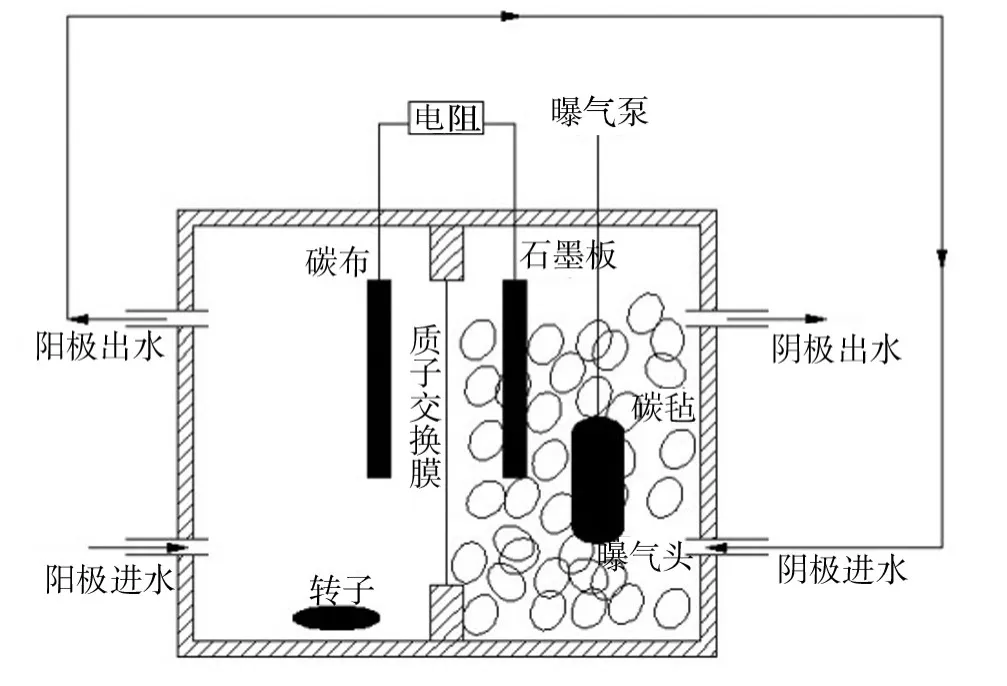
圖1 BCMFC實驗裝置
1.3 分析方法
實驗電壓使用信號采集器采集,采集器每隔1min將數據傳遞給電腦儲存電壓數據。通過改變外接電阻值測得電壓數據,經過公式(1)和(2)計算得出電流密度和功率密度,以電流密度為橫坐標,分別以電壓和功率密度為縱坐標繪制得到極化曲線與功率密度曲線。硝化反硝化酶的活性是以NH4Cl和Na2NO2作為測量指標,表征單位時間內,單位微生物所含蛋白質中NH4+-N或NO2--N增加或減少的物質的量。
電流密度JA(mA/m3):

式中,I為電流(A);VA為陽極室體積(m3)。
功率密度PA(mW/m3):
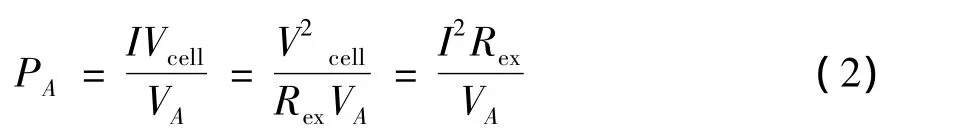
式中,Vcell為電池電壓(V);Rex為外接電阻(Ω)。
COD、NH4+-N、NO2--N和NO3--N等化學指標的測定方法均是國家標準方法。硝化反硝化過程中主要參與的酶有氨單加氧酶(AMO)、亞硝酸鹽氧化酶(NOR)、硝酸鹽還原酶(NR)以及亞硝酸鹽還原酶(NIR),其測定活性見文獻[18]。實驗所用試劑均為分析純。
2 結果與討論
2.1 鹽度對BCMFC三氮變化的影響
成功啟動5個不同鹽度的BCMFC,陽極連續進水,陽極的出水進入陰極,陰極按照SBR工藝運行,控制陰極進水時的溶解氧濃度為5.0 mg/L。外接500 Ω電阻,反應溫度維持在30±1℃。實驗中分別取陽極進水、陽極出水(陰極進水)、曝氣停止以及陰極最后出水,4個不同時間段的水樣測試。鹽度對陰陽兩室脫氮的影響見圖2所示。
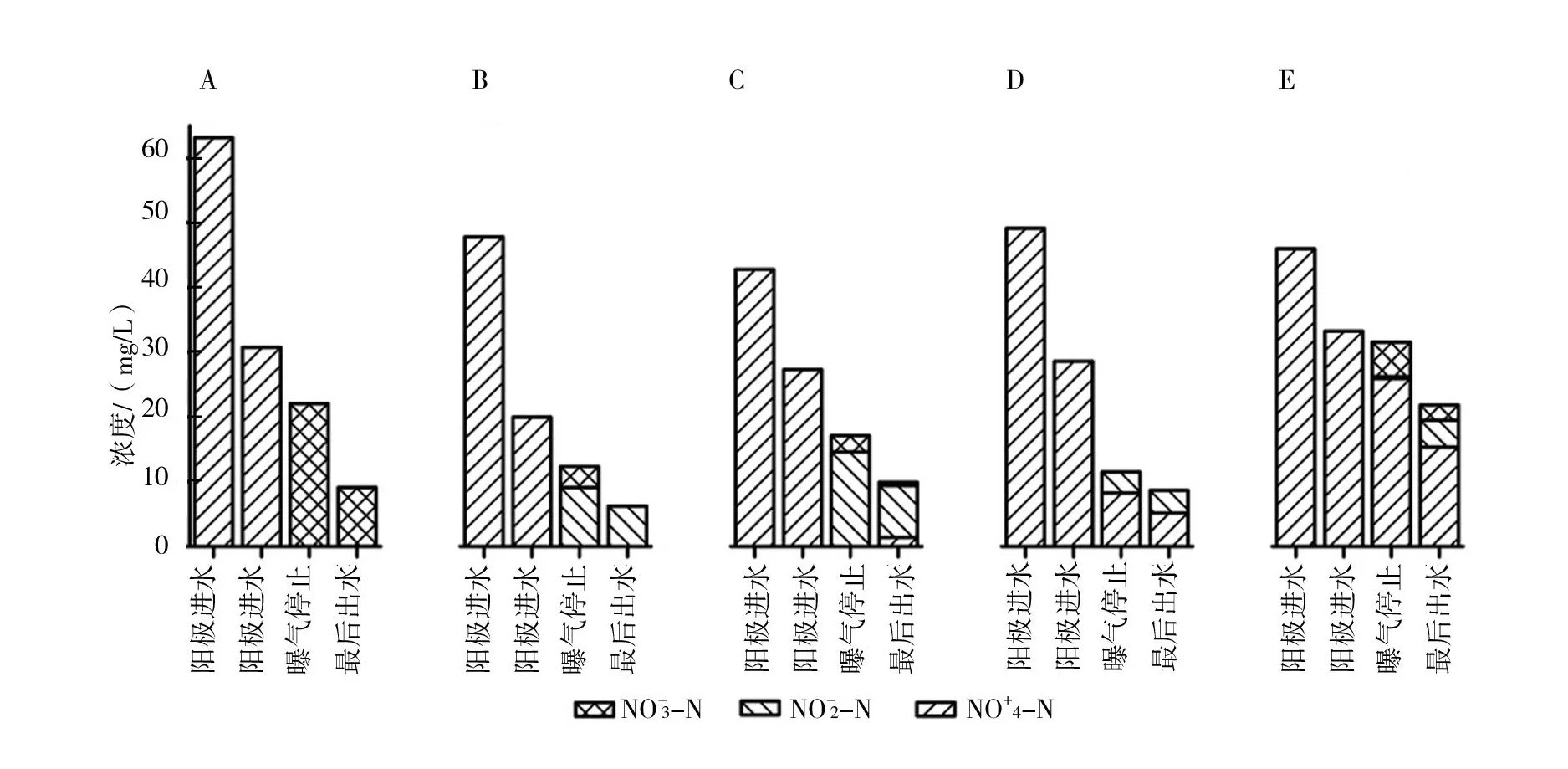
圖2 不同鹽度下BCMFC三氮濃度的變化(圖中A、B、C、D和E分別表示海水比例為0%、10%、30%、50%和70%鹽度)
由圖2可知,氮在陽極出水中主要以氨氮形式存在,受鹽度的影響,陽極微生物去除氨氮的性能變差,出水中氨氮的濃度隨著鹽度的增加而升高。曝氣時陰極發生硝化反應,在0%海水比例時,陰極室中的氮以硝態氮的形式存在,10%海水比例時,亞硝酸鹽出現并積累,曝氣結束時濃度達到12.64 mg/L。30%海水比例時,亞硝酸鹽的積累量達到最大,為20.26 mg/L。然而當鹽度超過30%海水比例時,亞硝酸鹽的積累量隨著鹽度的增加而變小。可能原因是亞硝酸鹽細菌和硝酸鹽細菌對鹽的耐受性不同[19],首先抑制硝酸鹽細菌的活性,導致亞硝酸鹽轉成硝酸鹽的過程變緩甚至停止,所以會造成亞硝酸鹽的積累。隨著鹽度繼續增加,亞硝酸鹽細菌亦受到鹽度的抑制作用,從而導致在鹽度≥50%海水比例時,亞硝酸鹽的濃度也減少。曝氣停止后,陰極發生反硝化反應,相比于0%海水比例的全程硝化反硝化過程,鹽度為10%海水比例則變成了短程硝化反硝化過程,縮短反硝化的時間。但是鹽度≥30%海水比例,反硝化微生物受到抑制,反硝化效果變差。最后出水中,三氮之和記為總氮(TN)濃度分別為9.13 mg/L、8.62 mg/L、11.71 mg/L、11.98 mg/L以及30.21 mg/L,去除率分別為 85.54%、86.99%、80.23%、82.41% 以及 52.55%。可以明顯看出當鹽度大于30%海水比例時,BCMFC的脫氮性能受到抑制。
2.2 鹽度對BCMFC化學需氧量去除的影響
BCMFC運行過程中COD(進水COD濃度約為1 600 mg/L)去除率的變化見圖3所示。
從圖3可以看出,鹽度<50%海水比例時,BCMFC對COD的去除效果大致相同,當鹽度≥50%海水比例,鹽度抑制BCMFC降解有機物。鹽度<50%海水比例時,陽極出水中COD的去除率變化不大,均能達到89%以上。當海水比例升高至50%時,去除率降至77%左右,70%海水比例鹽度下,COD去除率降至69%。曝氣停止時COD的濃度分別為19、22、82、104、326 mg/L,去除率分別為 99%、98%、95%、94%、80%。從圖3還可以看出,在氧氣足夠的情況下,僅有70%海水比例鹽度的BCMFC的COD去除率較差。最后出水中COD濃度分別為13、9、38、51、229 mg/L,去除率分別為 99%、99%、98%、97%、86%。以上現象說明鹽度對陽極和陽極微生物有抑制作用。原因是微生物在鹽度較高的條件下,會生成保護機制,分泌胞外聚合物保護細胞,平衡滲透壓,或者改變酶的代謝途徑以求生存,這些過程需要能量,所以微生物用于繁殖的能量變少,生長緩慢,生物量變少,COD去除效果自然降低。
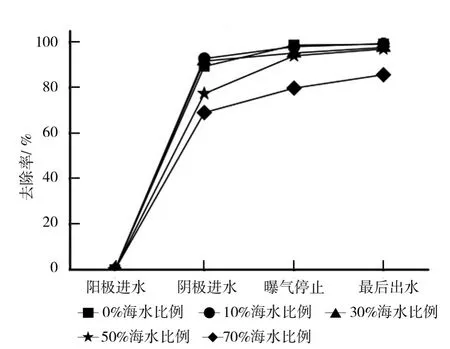
圖3 不同鹽度下BCMFC的COD去除率的變化
2.3 鹽度對BCMFC產電性能的影響
極化曲線與功率密度曲線能夠很好的反應BCMFC產電過程中內阻和輸出功率隨鹽度的變化。由于不曝氣的時候改變了DO的量,電壓值很小,輸出電流直線下降,功率密度也不大,所以本文所測的極化曲線與功率密度曲線均是在曝氣階段測試的。不同鹽度下的BCMFC極化曲線和功率密度曲線見圖4。
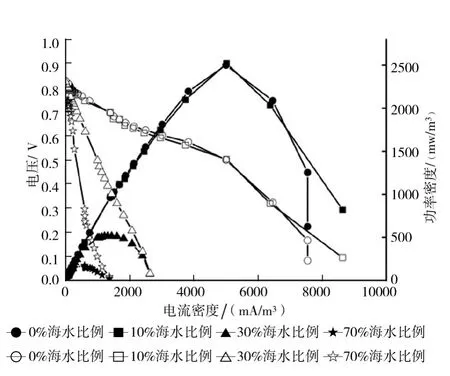
圖4 不同鹽度下BCMFC極化曲線和功率密度曲線(圖中實心圖標表示功率密度,空心圖標表示極化曲線)
從圖4可以看出,BCMFC的輸出功率及內阻受鹽度的影響較大。0%海水比例下,最大功率密度為2 500 mW/m3,根據全電路Ohm定律[3]計算出0%海水比例下的內阻為160 Ω。隨著鹽度的增加,功率密度有所上升,為2 520 mW/m3,內阻為151 Ω。原因是鹽度的加入,增加BCMFC的電導率,減少歐姆損失。參比電極與雙極膜間由于溶液傳導而引起的歐姆損失可由公式(4)計算[20]

式中,dw為溶液寬度(cm);I為電流密度,A/cm2;S為溶液的電導率(S/cm)。當溶液寬度(即極間距)固定不變時,增加電導率會使歐姆損失減少,從而提高功率密度。但是圖4可以明顯看出,當鹽度為30%海水比例及70%海水比例時,最大輸出功率分別為515 mW/m3和175 mW/m3,內阻分別為600 Ω和1 352 Ω。最大輸出功率密度隨著鹽度的增加而下降,內阻上升至10%海水比例的4倍和9倍。原因是:(1)在鹽度的作用下,雖然增加了電導率,但是電導率增加到一定程度就達到飽和,不能很大程度的增加功率密度和減少內阻。而且添加的海水晶中含有大量的Cl-,會對微生物有毒害作用,使陰陽兩極的產電微生物受到抑制,所以導致輸出功率密度變小,內阻變大;(2)微生物和海水晶會堵塞PEM,從而導致陽極到陰極質子的傳遞速率降低,引起輸出功率變小。
2.4 不同鹽度下BCMFC基質降解動力學分析
實驗使用自配污水,成分較為單一,實驗過程中保持參數恒定,所以認為基質的降解動力學與基質的濃度有關,因此可以用簡單動力學對BCMFC陽極降解有機物和陰極對氨氮去除過程加以描述,通過討論零級、一級和二級三種動力學方程及其回歸系數,來確定基質降解的反應級數和所對應的反應速率常數。比較不同鹽度下反應速率常數,進一步解釋鹽度對有機物和氨氮去除過程的影響。
零級反應動力學方程:

一級反應動力學方程:

二級反應動力學方程:

式中Ct表示t時間的基質濃度;C0表示基質的初始濃度;t表示時間;k0、k1、k2分別表示零級、一級、二級反應速率常數。
2.4.1 陽極有機物降解動力學分析
在鹽度影響下,陽極有機物降解動力學分析見表1。

表1 不同鹽度下陽極COD降解的反應動力學級數、反應速率常數及回歸系數
由表1可知,0%海水比例下,一級反應方程擬合較好(R21=0.980),零級次之(R20=0.929),二級最差(R22=0.785)。相同的現象也發生在鹽度為10%、30%和50%海水比例。這原因可能是由于底物乙酸鈉是一種單一類型的易降解有機物質。所以呈現出的動力學反應級數較為簡單。特殊的是在鹽度為70%海水比例時,R22(0.998)>R21(0.982)>R20(0.924)。原因可能是受到鹽度的影響,陽極微生物的種類與其他鹽度下的不同,產生代謝途徑不一樣。比較不同鹽度下的k1,隨著鹽度增加,k1先上升后下降,鹽度為10%海水比例的k1是70%海水比例的2.4倍。說明10%海水比例下,陽極微生物降解COD的速率最快,所以在相同時間內出水中的COD濃度最低。
2.4.2 陰極氨氮去除動力學分析
在鹽度影響下,陰極氨氮去除的反應動力學方程及回歸系數見表2。
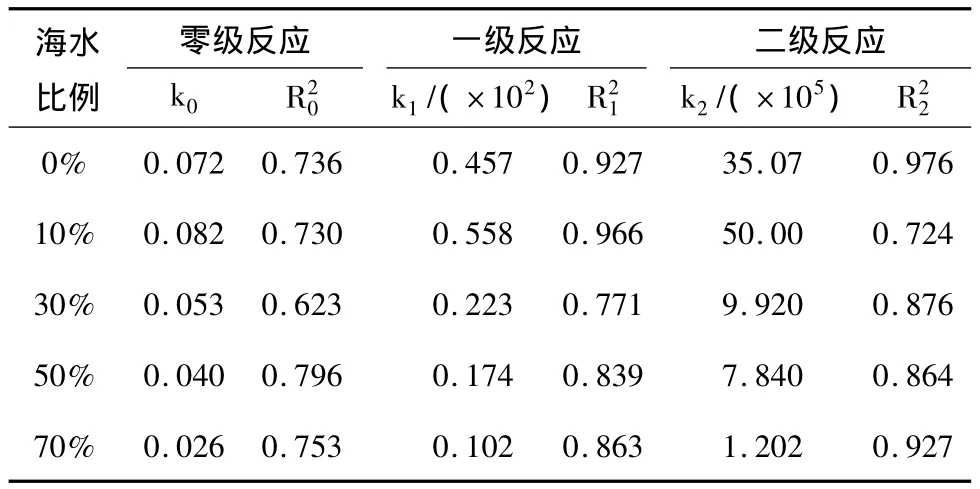
表2 不同鹽度下陰極NH+4-N去除的反應動力學級數、反應速率常數及回歸系數
由2表可知,比較5種鹽度下的反應級數變化,除了海水比例為0%和10%是一級反應外,其他鹽度下均為二級反應。10%海水比例下的k1是70%海水比例的5倍。說明鹽度不僅影響了陰極氨氮的去除速率,而且可能影響了氨氮在陰極去除的途徑,從圖2三氮的變化也可以看出。因為鹽度影響了陰極的亞硝酸鹽細菌與硝酸鹽細菌的活性,由于兩者的耐鹽性不同,隨著鹽度的增加,硝酸鹽細菌的活性受到抑制,出現亞硝酸鹽的積累;當鹽度繼續增加,抑制了亞硝酸鹽細菌的活性,阻礙了陰極的亞硝酸化的進程,降低了氨氮轉化速率以及影響了陰極微生物的代謝途徑。
2.5 硝化反硝化酶的活性
硝化反硝化過程中參與的酶:AMO、NIR、NR以及NIR的活性,見表3。
由表3可知隨著鹽度增加,AMO在鹽度≥50%海水比例時,活性下降。從圖2也可以看出,在海水比例為50%和70%時,二者的硝化過程產生的亞硝酸鹽的濃度小于海水比例為10%和30%的情況。NOR在鹽度為0%~30%海水比例范圍內變化不大,當鹽度≥50%海水比例時,NOR活性下降,說明鹽度對硝酸鹽細菌產生影響。從NR和NIR的變化可以看出,高鹽度對反硝化細菌活性起到的抑制性作用。這也與圖2所示一樣,隨著鹽度增加反硝化性能變差。
3 結論
實驗結果表明,BCMFC的陰極采用間歇曝氣模式,使得BCMFC去除COD和NH+4-N的同時能夠實現脫氮。
鹽度為10%海水比例時,BCMFC脫氮除碳及產電性能最佳,TN去除率為86.99%,COD去除率為99%,最大輸出功率為2 520 mW/m3,內阻為151 Ω。COD和NH+4-N符合一級反應動力學,反應速率常數最大。
BCMFC適宜的鹽度范圍為鹽度≤30海水比例,鹽度≥50%海水比例影響TN和COD的去除率,內阻增大至10%海水比例鹽度的9倍左右,輸出功率下降。隨著鹽度增加,反應級數由一級變為二級且反應速率常數減小;硝化反硝化酶的活性受到明顯的抑制。
[1]尤作亮,蔣展鵬.海水直接利用及其環境問題分析[J].給水排水,1998,24(3):64 -67.
[2]于德爽,李津,陸婕.MBR工藝處理含鹽污水的試驗研究[J].中國給水排水,2008,24(3):5 -8.
[3]Logan B E,Hamelers B,Rozendal R,et al.Microbial fuel cells:methodology and technology[J].Environmental science& technology,2006,40(17):5181-5192.
[5]尤世界,趙慶良,姜珺秋.廢水同步生物處理與生物燃料電池發電研究[J].環境科學,2006,27(9):1786-1790.
[6]詹亞力,王琴,閆光緒,等.高錳酸鉀作陰極的微生物燃料電池[J].高等學校化學學報,2008,29(3):559-563.
[7]李方,金春姬,崔燦洙,等.微生物燃料電池技術處理含鉻廢水的實驗研究[J].中國海洋大學學報(自然科學版),2013,43(12):081 -086.
[8]Wang Y,Niu C G,Zeng G M,et al.Microbial fuel cell using ferrous ion activated persulfate as a cathodic reactant[J].international journal of hydrogen energy,2011,36(23):15344-15351.
[9]Bergel A,Féron D,Mollica A.Catalysis of oxygen reduction in PEM fuel cell by seawater biofilm[J].Electrochemistry Communications,2005,7(9):900-904.
[10]Virdis B,Rabaey K,Rozendal R A,et al.Simultaneous nitrification,denitrification and carbon removal in microbial fuelcells[J].Water research,2010,44(9):2970-2980.
[11]Zhang G,Zhao Q,Jiao Y,et al.Biocathode microbial fuel cell for efficient electricity recovery from dairy manure[J].Biosensors and Bioelectronics,2012,31(1):537-543.
[12]Park D H,Laivenieks M,Guettler M V,et al.Microbial utilization of electrically reduced neutral red as the sole electron donor for growth and metabolite production[J].Applied and environmental microbiology,1999,65(7):2912-2917.
[13]Xie S,Liang P,Chen Y,et al.Simultaneous carbon and nitrogen removal using an oxic/anoxic-biocathode microbial fuel cells coupled system[J].Bioresource technology,2011,102(1):348 -354.
[14]印霞棐,劉維平,袁霞靜.連續流生物陰極微生物燃料電池廢水處理與產電性能[J].水處理技術,2014,40(1):52-55.
[15]羅勇,駱海萍,覃邦余,等.鹽度對MFC產電及其微生物群落的影響[J].中國環境科學,2013,33(5):832-837.
[16]于輝.過硫酸鹽陰極型微生物燃料電池降解活性艷藍及產電性能的研究[D].大連:中國海洋大學,2014.
[17]Lovely,D R,Phillips,E J,Novel mode of microbial energy metabolism:organism carbon oxidation coupled to dissimilatory reduction of iron and manganese[J].Appl.Environ.Microbiol.1988,54(6):1472–1480.
[18]Zheng X,Wu R,Chen Y.Effects of ZnO nanoparticles on wastewater biological nitrogen and phosphorus removal[J].Environmental science & technology,2011,45(7):2826-2832.
[19]Chen G H,Wong M T,Okabe S,et al.Dynamic response of nitrifying activated sludge batch culture to increased chloride concentration[J].Water research,2003,37(13):3125-3135.
[20]Ter Heijne A,Hamelers H V M,De Wilde V,et al.A bipolar membrane combined with ferric iron reduction as an efficient cathode system in microbial fuel cells[J].Environmental science& technology,2006,40(17):5200-5205.

