2-噻吩甲腈在高電壓鋰離子電池中的應用
齊愛,王志興,郭華軍,李新海
?
2-噻吩甲腈在高電壓鋰離子電池中的應用
齊愛,王志興,郭華軍,李新海
(中南大學 冶金與環境學院,湖南長沙,410083)
為了改善鋰離子電池在高電壓下的電化學性能,以2-噻吩甲腈作為一種新型的電解液添加劑,采用線性掃描伏安法(LSV)研究其對1 mol/L LiPF6/EC+EMC(EC與EMC質量分數之比為1:2)電解液電化學窗口的影響。通過掃描電鏡(SEM)、X線光電子能譜(XPS)、傅里葉紅外光譜(IR)、充放電測試、循環伏安(CV)和交流阻抗(EIS)對含不同電解液的鋰離子電池循環前后的正極材料表面及其電化學性能進行表征。研究結果表明:2-噻吩甲腈能優先于電解液溶劑發生氧化分解反應并在正極表面形成致密的導電聚合物膜;添加質量分數為0.1% 2-噻吩甲腈的鈷酸鋰電池在3.0~4.5 V以0.5倍率循環100次后容量保持率高達91.99%,在5倍率下放電比容量為152.8 mA·h·g?1;與電解液中未添加2-噻吩甲腈的電池相比,其循環后電荷轉移阻抗的增加被抑制,在高電壓下表現出較好的循環和倍率性能。
鋰離子電池;電解液添加劑;2-噻吩甲腈
鋰離子電池因其具有優異的循環性能、高比容量和無記憶效應等優點自1991年市場化以來便占領了便攜式移動設備電源的主要市場,然而,其能量密度仍無法滿足在電動汽車及儲能等領域應用的要求,開發高電壓電池是實現鋰離子電池大型化及動力化的必然趨勢[1?2]。高的工作電壓對電池的材料體系尤其是對電解液的電化學穩定性提出了更高的要求。目前的常規電解液體系由鋰鹽和碳酸酯類有機溶劑組成,在高電壓下碳酸酯類溶劑會發生顯著的氧化分解反應并在正極材料表面形成一層高阻抗物質,同時,正極材料中過渡金屬原子的催化作用和表面效應加劇了分解反應的發生,因此,在長循環中造成容量大幅度衰減[3?4]。為了提高鋰離子電池在高電壓下的循環穩定性,其中一種途徑是在正極材料表面包覆惰性金屬氧化物[5](如ZnO,Al2O3和Bi2O3),C材料[6?7]以及高分子有機物PPy[8]等,阻止正極材料與電解液的直接接觸。然而,表面包覆不僅延長了材料的生產流程,其包覆層的均勻性很難控制,同時還會降低電池能量的有效體積密度。另一種途徑是通過優化電解液的組成,提高其在高電壓下的穩定性。與表面包覆相比,后者更能經濟、簡便地與現有生產體系相結合。高電壓電解液的開發可以通過更換抗氧化能力低的碳酸酯類溶劑,采用腈類、離子液體以及砜類等高氧化電位的有機溶劑來實現[9?11],然而,徹底更換電解液體系面臨著與鋰離子電池正負極兼容性差的問題,如何優化現有電解液體系是目前研究的重點。電解液添加劑優先于常規溶劑在正極表面發生分解,形成類似包覆的表面膜能有效改善電池的高電壓電化學性能。微量的甲烷二磺酸二甲酯(MMDS)[12]、三(三甲基硅烷)硼酸酯[13]、LiODFB[14?15]和HFiP[16]等都被證實能優先分解成膜,改善鋰離子電池高電壓下的循環性能。Abe等[17]提出降低電聚合型防過充保護添加劑(聯苯、三聯苯和呋喃等)的使用量,當達到其氧化電位后能在正極表面分解形成合適厚度的表面膜,但改善效果不明顯。基于前人的研究,考慮到結合C包覆和有機物包覆良好的導電性及塑性的特點,本文作者選擇一種可形成導電聚合物的單體即噻吩,通過富電荷的氰基官能團取代氫原子(即2-噻吩甲腈),研究其在1 mol/L LiPF6/EC+EMC(EC與EMC質量分數之比為1:2)基礎電解液(簡稱STD)中對鈷酸鋰電池高電壓電化學性能的影響。氰基取代旨在通過電荷平衡效應使添加劑與正極材料表面的Co原子附著,從而達到更好的保護效果。
1 實驗
1.1 電解液的配制
將電池級的電解質鋰鹽LiPF6、碳酸乙烯酯(EC)和碳酸甲乙酯(EMC)在充滿高純氬氣(體積分數≥99.9%)的手套箱中配制1 mol/L LiPF6/EC+EMC(EC與EMC質量分數之比為1:2)的基礎電解液(簡稱STD),向電解液中分別加入質量分數為0.1%,0.5%及1.0% 2-噻吩甲腈(簡稱TC)。電解液中水分質量分數采用Karl Fisher水分測定儀測試,其質量濃度均小于10 mg/L;游離酸質量濃度采用酸堿滴定法測試,均小于30 mg/L。以上試劑均由江西優鋰新材股份有限公司提供。
1.2 電池的組裝與測試
將LiCoO2(由湖南杉杉戶田新材料有限公司提供)、導電劑Super P和黏結劑PVDF按質量比8:1:1混合,用有機溶劑NMP攪拌混合成糊狀料漿,將料漿均勻涂覆在鋁箔上,在120 ℃鼓風干燥箱中干燥 12 h,切片壓制成直徑為14 mm的正極片。將正極片與負極鋰片、電解液和隔膜(Celgard 2300 PP/PE/PP)在充滿氬氣的手套箱中組裝成CR2032扣式電池。組裝完成的扣式電池經過12 h靜置后,在新威測試儀上進行小倍率活化,即以0.1倍率在3.0~4.5 V區間恒流恒壓充電、恒流放電3次,然后,在常溫下以0.5倍率進行循環性能測試。
線性掃描(LSV)測試采用Pt電極(直徑為1 mm)作為工作電極,鋰片為對電極和參比電極在上海辰華CHI660A電化學工作站上完成,掃描速率為0.1 mV/s。循環伏安(CV)測試方法為:在3.0~4.5 V電位下對樣品進行三角波電位循環掃描,觀察電流隨時間的變化情況,從而得出充放電過程中電極的電化學行為。交流阻抗測試(EIS)采用三電極體系,LiCoO2作為工作電極,鋰片作為對電極和參比電極,測試頻率為0.01~ 100 000 Hz,正弦波振幅為5 mV。
1.3 正極材料表面檢測
充放電測試完成后的電池在手套箱中打開,用碳酸二甲酯(DMC)清洗極片表面殘留的鋰鹽,然后在 60 ℃真空干燥箱中干燥12 h。用JSM-5600型掃描電子顯微鏡(SEM)對循環后的LiCoO2正極材料表面形貌進行表征。表面成分采用X線光電子能譜(XPS,PHl5300,PHI公司)表征;采用Al Ka(1486.7 eV)X光源,樣品倉真空度為1×10?9Pa。采用Avatar 360 FTm傅里葉變換紅外光譜儀(Thermo Nicolet)對LiCoO2正極材料表面能團進行表征分析。
2 結果與討論
2.1 2-噻吩甲腈對電解液電化學窗口的影響
采用線性伏安掃描(LSV)研究2-噻吩甲腈對電解液電化學窗口的影響。圖1所示為含有2-噻吩甲腈及基礎電解液的線性掃描曲線。從圖1可見:當加入質量分數為0.1%的2-噻吩甲腈(曲線2)后,電解液在4.48 V便發生分解,而基礎電解液在5 V以上才出現明顯的氧化電流(曲線1)。這表明2-噻吩甲腈具有更低的分解電壓,可優先于電解液溶劑氧化分解。

1—STD;2—0.1% TC
2.2 2-噻吩甲腈對LiCoO2表面形貌及成分的影響
為了研究2-噻吩甲腈對鈷酸鋰正極高電壓電化學性能的影響,避免LiCoO2材料在4.6 V以上受結構不穩定的干擾,將不同電解液組裝的LiCoO2電池在3.0~4.5 V之間進行充放電循環測試。通過掃描電子顯微鏡(SEM)觀察循環100次前后的正極材料表面形貌,如圖2所示。由圖2可知:循環前的材料(圖2(a)和 2(b))顆粒比較明顯,能清楚辨別顆粒的棱角。經過100次循環后,正極材料表面都覆蓋一層物質,尤其是在含2-噻吩甲腈的電解液中(圖2(e)和(f)),表面膜更加明顯。

(a),(b) 循環前;(c),(d) STD循環后;(e),(f) 0.1% TC循環后
為進一步分析材料表面成分的差異,對循環前后的正極材料表面進行X線光電子能譜(XPS)分析和紅外光譜分析。XPS能譜圖如圖3所示,C1s,O1s和F1s的XPS能譜如圖4所示,正極材料表面各元素質量分數如表1所示。由圖3可知:只有在電解液含2-噻吩甲腈的LiCoO2正極循環后,在164.8 eV(S—C)出現1個微弱的峰,對應著添加劑的分解產物。
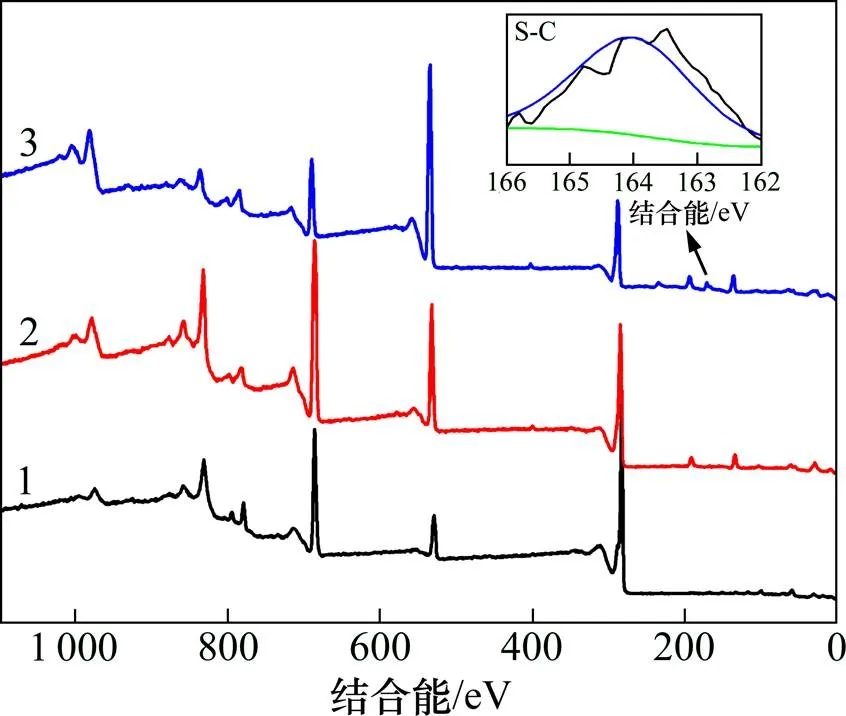
1—循環前;2—STD循環后;3—0.1% TC循環后

(a) 循環前C1s;(b) 循環前O1s;(c) 循環前F1s;(d) STD循環后C1s;(e) STD循環后O1s;(f) STD循環后F1s;(g) 0.1% TC循環后C1s;(h) 0.1% TC循環后O1s;(i) 0.1% TC循環后F1s
圖4 含不同電解液的LiCoO2電池循環前后正極材料的C1s,O1s和F1s的XPS能譜
Fig. 4 C1s,O1s and F1s XPS spectra of LiCoO2cathodes before and after cycle in different electrolytes

表1 含不同電解液的LiCoO2電池循環前后正極材料表面的元素質量分數
由圖4可知:循環前正極材料的C1s 能譜在290.3eV(C—F)和285.7 eV(C—H)的2個峰對應于極片制作過程中添加的黏結劑PVDF,在284.8 eV(C—C)的峰對應導電劑Super P。循環后的正極材料表面由于電解液的分解在286.0 eV(C—O)和288.0 eV(C=O)出現新的峰。含2-噻吩甲腈添加劑的LiCoO2電池與在常規電解液中循環100次后的正極材料相比在287.3 eV多1個新的C—S峰,與圖3中在164.8 eV出現的S—C峰相對應,證實了聚噻吩類物質的形成。
在O1s能譜中,循環后的Me—O峰(529.5 eV)強度都有不同程度減弱,這是由于電解液在高電壓下的氧化分解在正極材料表面覆蓋了一層分解產物膜。在含有2-噻吩甲腈添加劑的LiCoO2正極表面,Me-O峰的強度更弱,表明添加劑在充放電循環過程中氧化分解形成的導電聚合物膜更致密。
循環前的F1s能譜只在687.7 eV有1個單獨的峰對應于黏結劑PVDF,循環后的電極都在684.5 eV出現1個新的LiF峰。含2-噻吩甲腈的電池循環后電極表面的LiF和PVDF峰強更弱,說明表面膜中LiF質量分數更小。LiF為電子絕緣體,少量LiF能提高表面膜的穩定性,但LiF過量將會導致阻抗顯著增大,影響Li+的嵌入和脫出。
從表1可以看出:循環后的正極材料由于表面膜的形成導致Co質量分數有所降低;含2-噻吩甲腈的電解液正極材料表面由于形成的聚合物導電膜更致密,故Co質量分數最低。同時,S和N的出現證實了2-噻吩甲腈參與成膜過程。
圖5所示為鈷酸鋰電池循環前后的正極材料紅外光譜。從圖5可見:在電解液中,只有含2-噻吩甲腈的正極材料循環后的表面在1 436.84,1 488.12和 1 638.23 cm?1出現聚噻吩的芳香環振動[18],表明2-噻吩甲腈添加劑參與了正極表面膜的形成。
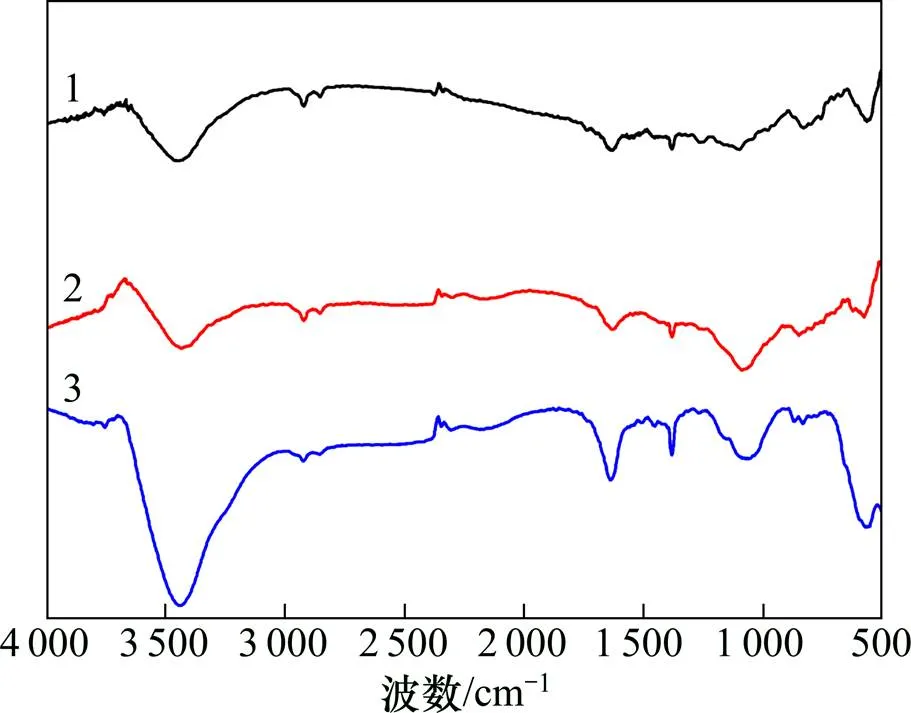
1—循環前;2—STD循環后;3—0.1% TC循環后
2.3 2-噻吩甲腈對LiCoO2電池電化學性能的影響
2-噻吩甲腈能優先于電解液溶劑發生氧化分解,在正極表面形成致密的聚噻吩甲腈膜,防止電解液在高電壓下持續氧化,因此,對2-噻吩甲腈在LiCoO2電池高電壓下電化學性能的影響進行研究。圖6所示為不同電解液的LiCoO2電池首次循環伏安(CV)曲線。從圖6可見:STD電解液組裝的LiCoO2電池只出現了4.06 V的氧化峰和3.85 V的還原峰,分別對應于Li+的脫出和嵌入;而含2-噻吩甲腈的LiCoO2電池則在4.17 V和4.28 V出現2個氧化峰,分別對應于Li+的脫出與2-噻吩甲腈的氧化分解,3.8 V的還原峰則對應Li+的嵌入。CV曲線進一步證明了2-噻吩甲腈在首次充電過程中參與了正極表面的成膜過程。

1—STD;2—0.1% TC
圖7所示為不同2-噻吩甲腈添加量的LiCoO2電池在3.0~4.5 V以0.1倍率的首次充放電曲線和前3次充放電庫侖效率。從圖7可見:在高充電電壓下,由于電解液的氧化分解消耗了Li+,導致充電比容量高于LiCoO2在4.5 V時的理論比容量(180 mA·h·g?1),此部分消耗的Li+在放電時不能可逆嵌入,所以造成首次庫侖效率較低;當添加劑質量分數增大時,添加劑的氧化分解消耗更多的Li+,首次庫侖效率也隨之降低;當添加劑質量分數較低時(0.1%),氧化分解成膜發生在首次充電過程,所以,隨著循環的進行,庫侖效率迅速提高;質量分數為0.1%的2-噻吩甲腈電解液第2次循環的庫侖效率從85.77%增大至96.99%。對于未含添加劑的電池,電解液在首次充電時形成的表面膜不足以完整保護正極,故在高電壓循環過程中持續氧化分解造成庫侖效率較低。

(a) 首次充放電曲線;(b) 前3次循環庫侖效率曲線
不同質量分數的2-噻吩甲腈對LiCoO2電池高電壓下的循環性能影響如圖8所示。從圖8可知:添加少量2-噻吩甲腈對LiCoO2電池在3.0~4.5 V電壓范圍內的循環性能有明顯改善,但當添加量(質量分數,下同)達1.0%時,過多的添加劑分解形成的表面膜膜過厚反而造成容量快速衰減(62次循環后僅為首次容量的61.67%);當添加量為0.1%和0.5% 時,0.5倍率下循環100次后放電比容量分別為151.6 mA·h/g和149.0 mA·h/g,容量保持率分別達91.99%和89.22%,而常規的電解液100次循環后放電比容量衰減到120.80 mA·h/g,僅為首次容量的69.27%。適量的2-噻吩甲腈氧化分解形成的導電聚合物薄膜對LiCoO2材料形成保護作用,從而提高了其在高電壓下的循環穩定性。由圖8可知:較合適的添加劑質量分數為0.1%。
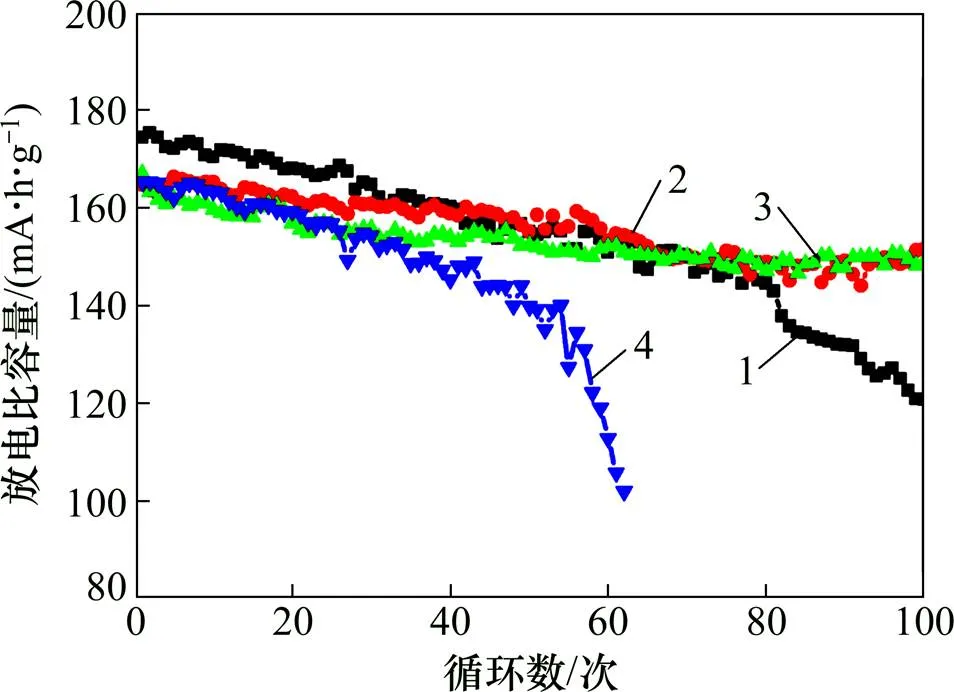
1—STD;2—0.1% TC;3—0.5% TC;4—1.0% TC
2-噻吩甲腈對循環前后的阻抗影響如圖9所示。從圖9可見:循環前(圖9(a))的交流阻抗圖由1個半圓和1條直線組成,半圓與實軸的截距代表電解液與金屬Li負極和Al集流體產生的阻抗e(通常為5~10 Ω),半圓的半徑代表反應界面電荷轉移阻抗ct,低頻區的斜線是由鋰離子在電極材料中的遷移引起的Warburg阻抗[19];循環100次后(圖9(b)),除了代表ct的半圓外,由于SEI膜的形成,在高頻區出現了另一個半圓,代表電解液與電極表面的SEI膜阻抗SEI,而低頻區的斜線在測試頻率范圍內沒有被檢測到。

(a) 100次循環前;(b) 100次循環后
1—STD;2—0.1% TC;3—0.5% TC;4—1% TC
′為阻抗實部;″為阻抗虛部
圖9 不同質量分數的2-噻吩甲腈對LiCoO2電池循環前后EIS圖譜的影響
Fig. 9 Electrochemical impedance spectra of LiCoO2/Li cells with various 2-thiophenecarbonitrile contents before and after 100 cycles
循環前的電池阻抗差異并不明顯,循環后的電荷轉移阻抗ct明顯增大,且不同電解液的增幅出現明顯差異。對于含2-噻吩甲腈的電解液,除了添加劑質量分數達1%的電池外,其余的電荷轉移阻抗均比STD電解液的低;添加適量的2-噻吩甲腈分解形成低LiF的導電聚合物膜包覆在LiCoO2材料表面,阻止了電解液在高電壓下的持續氧化分解,其形成的表面膜更有利于Li+的遷移,故循環后的ct比STD的更小,改善了LiCoO2正極高電壓下的循環性能;當添加劑的使用量過大時,過多的添加劑分解形成較厚的膜,導致阻抗顯著增大,反而惡化了其循環性能。
鋰離子電池的倍率性能是評價其應用性的一個重要參數,為此,在獲得較優循環性能的添加量下考察2-噻吩甲腈對鈷酸鋰電池倍率性能的影響,實驗結果如圖10所示。從圖10可見:在低倍率下,2-噻吩甲腈對放電比容量沒有明顯影響;當放電倍率達2以上時,含0.1% 2-噻吩甲腈的電池顯示更高的放電比容量;在5倍率下,首次放電比容量達152.8 mA·h/g,與STD電解液相比高5%;2-噻吩甲腈分解形成的聚合物膜具有良好的導電性且LiF質量分數更低,有利于Li+的可逆嵌入與脫出,因此,倍率性能更優異。

1—STD;2—0.1% TC
3 結論
1) 2-噻吩甲腈能優先于電解液溶劑發生氧化分解反應;2-噻吩甲腈參與了LiCoO2正極表面膜的形成,且該表面膜的LiF質量分數比基礎電解液的更低,有利于Li+的嵌入和脫出。
2) 添加0.1% 2-噻吩甲腈的LiCoO2電池在3.0~4.5 V的充電電壓下,以0.5倍率充放電循環100次后容量保持率達91.99%,與STD電解液(69.27%)相比提高了22.72%;在5倍率下放電比容量提高了5.00%。與電解液中未含添加劑的鈷酸鋰電池相比,表現出較好的循環和倍率性能的原因是其電化學阻抗更低,添加劑在正極材料表面活性點分解形成了性能優異的低阻抗導電聚合物膜,阻止了溶劑在高電壓下的持續氧化分解。
[1] Goodenough J B. Rechargeable batteries: Challenges old and new[J]. Journal of Solid State Electrochemistry, 2011, 16(6): 2019?2029.
[2] Tarascon J M, Amand M A. Issues and challenges facing rechargeable lithium batteries[J]. Nature, 2001, 414: 359?367.
[3] XU Kang. Nonaqueous liquid electrolytes for lithium-based rechargeable batteries[J]. Chemical Reviews, 2004, 104(10): 4303?4417.
[4] Aurbach D, Markovsky B, Salitra G, et al. Review on electrode–electrolyte solution interactions, related to cathode materials for Li-ion batteries[J]. Journal of Power Sources, 2007, 65(2): 491?499.
[5] Baggetto L, Unocic R R, Dudney N J, et al. Fabrication and characterization of Li-Mn-Ni-O sputtered thin film high voltage cathodes for Li-ion batteries[J]. Journal of Power Sources, 2012, 211: 108?118.
[6] Xing L Y, Hu M, Tang Q, et al. Improved cyclic performances of LiCoPO4/C cathode materials for high-cell-potential lithium-ion batteries with thiophene as an electrolyte additive[J]. Electrochimica Acta, 2012, 59: 172?178.
[7] Zaghib K, Dontigny M, Perret P, et al. Electrochemical and thermal characterization of lithium titanate spinel anode in C–LiFePO4//C–Li4Ti5O12cells at sub-zero temperatures[J]. Journal of Power Sources, 2012, 248: 1050?1057.
[8] TANG Wei, LIU Lili, ZHU Yusong, et al. An aqueous rechargeable lithium battery of excellent rate capability based on a nanocomposite of MoO3coated with PPy and LiMn2O4[J]. Energy & Environmental Science, 2012(5): 6909?6913.
[9] Nagahama M, Hasegawa N, Okada S. High voltage performances of Li2NiPO4F cathode with dinitrile-based electrolytes[J]. Journal of the Electrochemical Society, 2010, 157(6): A748?A752.
[10] Angell C A, Ansari Y, ZHAO Zuofeng. Ionic liquids past, present and future[J]. The Royal Society of Chemistry, 2012, 154(9): 9?27.
[11] LI Shiyou, LI Bucheng, XU Xiaoli, et al. Electrochemical performances of two kinds of electrolytes based on lithium bis(oxalate) borate and sulfolane for advanced lithium ion batteries[J]. Journal of Power Sources, 2012, 209: 295?300.
[12] ZUO Xiaoxi, FAN Chengjie, XIAO Xin, et al. Methylene Methanedisulfonate as an electrolyte additive for improving the cycling performance of LiNi0.5Co0.2Mn0.3O2/graphite batteries at 4.4 v charge cutoff voltage[J]. ECS Electrochemistry Letters, 2012, 1(3): A50?A53.
[13] ZUO Xiaoxi, FAN Chengjie, LIU Jiansheng, et al. Effect of tris(trimethylsilyl)borate on the high voltage capacity retention of LiNi0.5Co0.2Mn0.3O2/graphite cells[J]. Journal of Power Sources, 2013, 229: 308?312.
[14] ZHU Ye, LI Yan, Bettge M, et al. Positive electrode passivation by LiDFOB electrolyte additive in high-capacity lithium-ion cells[J]. Journal of the Electrochemical Society, 2012, 159(12): A2109?A2117.
[15] HU Meng, WEI Jinping, XING Liying, et al. Effect of lithium difluoro(oxalate)borate (LiDFOB) additive on the performance of high-voltage lithium-ion batteries[J]. Journal of Applied Electrochemistry, 2012, 42(5): 291?296.
[16] Cresce A V, XU Kang. Electrolyte additive in support of 5 V Li ion chemistry[J]. Journal of the Electrochemical Society, 2011, 158(3): A337?A342.
[17] Abe K, Ushigoe Y, Yoshitake H, et al. Functional electrolytes: Novel type additives for cathode materials, providing high cyclability performance[J]. Journal of Power Sources, 2006, 153(2): 328?335.
[18] Sato M, Tanaka S, Kaeriyama K. Electrochemical preparation and properties of poly(3-aryl-2,5-thienylene)s[J]. Macromolecular Chemistry and Physics, 1989, 190(6): 1233?1241.
[19] Levi M D, Salitra G, Markovsky B, et al. Solid-state electrochemical kinetics of Li-ion intercalation into Li1-xCoO2: simultaneous application of electroanalytical techniques SSCV, PITT and EIS[J]. Journal of the Electrochemical Society, 1999, 146(4): 1279?1289.
(編輯 陳燦華)
Application of 2-Thiophenecarbonitrile on high-voltage lithium-ion batteries
QI Ai, WANG Zhixing, GUO Huajun, LI Xinhai
(School of Metallurgy and Environment, Central South University, Changsha 410083, China)
In order to improve the high-voltage performance of lithium-ion batteries, 2-Thiophenecarbonitrile as a novel additive was evaluated in commercial electrolyte. The influence of 2-Thiophenecarbonitrile on electrochemical window of commercial electrolyte was detected by linear sweep voltammetry (LSV). The surface chemistry and electrochemical behaviors of cathodes were investigated using scanning electron microscope(SEM), X-ray photoelectron spectroscopy (XPS), Fourier transform infrared spectrometer (IR), charge-discharge test and cyclic before the decomposition of solvents and electrochemical impedance spectroscopy (EIS). The results indicate that 2-Thiophenecarbonitrile can be oxidized in preference to solvents and form a conducting polymer film on the surface of cathodes. With 0.1% (mass fraction) 2-Thiophenecarbonitrile in electrolyte, the capacity retention of LiCoO2battery keeps 91.99% after 100 cycles in the voltage of 3.0 V to 4.5 V, and the specific discharge capacity at high rate (5) reaches 152.8 mA·h·g?1. Compared with cells without additive in electrolyte, the increase of charge transfer resistance is restrained and the electrochemical properties under high voltage operation are improved significantly.
lithium-ion batteries; electrolyte additive; 2-thiophenecarbonitrile
10.11817/j.issn.1672-7207.2015.06.004
TM912.9
A
1672?7207(2015)06?1999?08
2014?07?10;
2014?09?22
國家重點基礎研究發展計劃項目(973計劃)(2014CB643406)(Project (2014CB643406) supported by the National Basic Research Development Program (973 Program) of China)
王志興,教授,從事新能源材料與器件研究;E-mail:zxwang.csu@hotmail.com

