二苯乙烯苷調節ROS相關JNK通路對LPC誘導HUVECs損傷的作用
趙 晶, 徐守竹, 宋 凡, 年 倫, 周暄宣, 王四旺
(第四軍醫大學藥學系天然藥物學教研室,陜西 西安 710032)
二苯乙烯苷調節ROS相關JNK通路對LPC誘導HUVECs損傷的作用
趙 晶, 徐守竹, 宋 凡, 年 倫, 周暄宣, 王四旺*
(第四軍醫大學藥學系天然藥物學教研室,陜西西安710032)
目的 探討從何首烏提取的二苯乙烯苷(TSG)對溶血卵磷脂(LPC)誘導人臍靜脈血管內皮細胞(HUVECs)凋亡的影響及其可能機制。方法 體外培養HUVECs,篩選溶血卵磷脂損傷內皮細胞的最適藥物濃度,采用CCK-8檢測細胞活力,透射電鏡觀察細胞形態,激光共聚焦顯微鏡檢測和觀察活性氧(ROS)水平,Western blot檢測p-JNK蛋白的水平。結果 LPC能引起細胞損傷,并隨質量濃度增加,細胞活力降低,其中10μg/mL LPC作用細胞后,與正常組比較細胞活力明顯降低,細胞內空泡增多,線粒體腫脹,產生ROS的水平增高,p-JNK蛋白表達水平顯著上調。經二苯乙烯苷預處理1 h后,二苯乙烯苷1.0μmol/L和10μmol/L組與溶血卵磷脂組比較,細胞活力增強,細胞內空泡減少,線粒體較完整,產生ROS水平降低,p-JNK蛋白表達量顯著下調(P<0.05)。結論 二苯乙烯苷具有降低溶血卵磷脂所致HUVECs的細胞損傷作用,其機制可能與調節ROS相關JNK通路有關。
二苯乙烯苷;溶血卵磷脂(LPC);人臍靜脈血管內皮細胞(HUVECs);ROS;p-JNK
動脈粥樣硬化(Atherosclerosis,AS)的形成是一個多因素的復雜過程,常見的動脈粥樣硬化的誘發因素有高血脂、高血壓、糖尿病以及吸煙等,這些因素均與內皮功能障礙有關[1-4]。血管內皮損傷被認為是動脈粥樣硬化發生發展的始動環節[5]。因此尋找一種有效抑制血管內皮細胞損傷和降低心血管疾病的藥物非常重要。
二苯乙烯苷(2,3,5,4′-tetrahydroxystilbene-2-O-β-D-glucosid,TSG)是從寥科植物何首烏的干燥塊根中提取的水溶性生物活性成分,研究表明TSG有抗氧化、抗炎、抗衰老、抗動脈粥樣硬化[6-9]、抗血小板凝集[10]、促進毛發生長[11]和提高記憶力與學習能力[12-13]等作用。近些年來在抗動脈粥樣硬化方面被人們廣泛關注,但其作用機制仍不明確。Ox-LDL是動脈粥樣硬化的危險因素,而溶血卵磷脂(lysophosphatidylcholine,LPC)是ox-LDL的有效成分,研究發現溶血卵磷脂能夠完全模擬ox-LDL致動脈粥樣硬化作用,并有促進單核細胞的化學趨化作用,促進巨噬細胞增殖,抑制內皮源性舒張因子引起的血管舒張[14]。本研究主要觀察TSG對LPC所致HUVECs損傷的保護作用及其機制。
1 材料與方法
1.1材料及主要儀器
1.1.1藥物與試劑 人臍靜脈血管內皮細胞(購自中國科學院細胞生物學研究所上海細胞庫);二苯乙烯苷(批號120619)、辛伐他汀(批號100601-201003)均為中國藥品生物制品檢定所產品;溶血卵磷脂(批號111M5210V)購自Sigma公司;DMEM/LOW GLUCOSE和胎牛血清購自Hy-Clone公司;胰蛋白酶購自南京建成科技有限公司;CCK-8試劑盒、ROS試劑盒均購自上海碧云天生物有限公司,抗體p-JNK購自Abcam公司。
1.1.2實驗儀器 酶標儀M680-UV(Bio-Rad Laboratories,Marnes La Coquette,法國);流式細胞儀(Becton Dickinson,San Jose,CA,美國);透射電鏡(JEM-101,Jeol Electron Inc,日本);激光共聚焦顯微鏡(Olympus FV1000,日本)。
1.2方法
1.2.1細胞培養及分組 HUVECs接種于無菌培養瓶中,用含10%胎牛血清的低糖培養基在37℃、5%CO2、95%飽和相對濕度條件下培養。取對數生長期的內皮細胞,用MTT法篩選不同質量濃度溶血卵磷脂(5、10、20、40μg/mL)對內皮細胞活力的影響,確定溶血卵磷脂對內皮細胞損傷的最適藥物質量濃度。其余實驗均分為6組:(1)DMEM組;(2)溶血卵磷脂組;(3)Simvastatin組,即5μmol/L辛伐他汀預處理1 h+終質量濃度10μg/mL溶血卵磷脂處理24 h;(4)二苯乙烯苷(0.1)組,即0.1μmol/L二苯乙烯苷預處理1 h+終質量濃度10μg/mL溶血卵磷脂處理24 h;(5)二苯乙烯苷(1.0)組,即1.0μmol/L二苯乙烯苷預處理1 h+終質量濃度10μg/mL處理24 h;(6)二苯乙烯苷(10.0)組,即10.0μmol/L二苯乙烯苷預處理1 h+終質量濃度10μg/mL處理24 h。
1.2.2MTT法篩選LPC造模質量濃度 取接種在96孔板中對數生長期的細胞,用無血清培養基同步培養12 h,每組設8個平行復孔。按分組要求給予不同處理因素,培養24 h后,每孔加MTT 20 μL,培養4 h后,棄上清,加入DMSO 150μL,待紫色結晶完全溶解后,用酶聯免疫儀在波長490 nm處測定吸光度值。
1.2.3CCK-8法檢測細胞活力 取接種在96孔板中對數生長期的細胞,用無血清培養基同步培養12 h,再換新鮮培養基,按分組要求給予不同的處理因素,每組設8個平行復孔。培養24 h后,每孔加CCK-8 20μL,培養4 h后,用酶聯免疫儀在波長450 nm處測定吸光度值。
1.2.4透射電鏡觀察細胞形態 取對數生長期的HUVEC接種在6孔板內,3 mL/孔,接種密度約為3×105個/孔,用含10%胎牛血清的低糖培養基在37℃、5%CO2、95%飽和相對濕度條件下培養至鋪滿80%,無血清培養基同步12 h后,按分組要求給予不同的處理因素,在37℃、5%CO2、95%培養箱中培養24 h后,用0.25%的胰蛋白酶消化貼壁細胞,收集細胞,800 r/min離心5min,棄上清,PBS漂洗2遍,離心去PBS,立即加戊二醛固定。再經固定,脫水,浸透,包埋,修塊,切片,電子染色過程后,在透射電鏡下觀察細胞形態。
1.2.5激光共聚焦法觀察并檢測細胞內活性氧的水平 取對數生長期的HUVEC接種在6孔板內,3 mL/孔,接種密度約為3×105個/孔,用含10%胎牛血清的低糖培養基在37℃、5%CO2、95%飽和濕度條件下培養至鋪滿80%,無血清培養基同步12 h后,按分組要求給予不同的處理因素,在37℃、5%CO2、95%培養箱中培養24 h后,PBS沖洗3遍,加入含有10μmol/L DCFH-DC的培養液,37℃孵育箱中避光培養20 min,用無血清培養基沖洗細胞3次,然后用激光共聚焦顯微鏡觀察并檢測細胞內活性氧水平。
1.2.6Western blotting檢測p-JNK蛋白的表達取對數生長期的HUVEC接種在培養瓶內,每瓶5 mL,接種密度約為6×105個/瓶,用含10%胎牛血清的低糖培養基在37℃、5%CO2、95%飽和相對濕度條件下培養至鋪滿80%,無血清培養基同步12 h后,按分組要求給予不同的處理因素,在37℃、5%CO2、95%培養箱中培養24 h后,用0.25%的胰蛋白酶消化貼壁細胞,收集各組細胞,用細胞裂解液裂解細胞后提取細胞總蛋白,BCA法測定蛋白質含量。每組取60μg蛋白進行SDSPAGE電泳分離,轉移到硝酸纖維素膜上,用含5%脫脂奶粉的TBST的封閉液中4℃過夜,加入一抗4℃孵育過夜,TBST緩沖液洗膜10 min×4,加HRP標記二抗(1∶5 000)室溫孵育1 h,室溫下用脫色搖床TBST洗膜10 min×3。化學發光試劑顯色,膠片顯影,掃描膠片后用凝膠圖像分析系統測光面密度值。
1.2.7統計學分析 應用SPSS 13.0統計軟件,統計學方法采用單因素方差分析(ANOVA)及t檢驗,實驗數據均用均數±標準差,以P<0.05表示有顯著性差異。
2 結果
2.1篩選LPC損傷HUVECs的最適藥物質量濃度
MTT結果(圖1)顯示,以不同質量濃度溶血卵磷脂(0、5、10、20、40μg/mL)作用于HUVECs 24 h后,隨著LPC質量濃度的增加,HUVECs的活力逐漸降低,其中5μg/mL溶血卵磷脂處理后細胞活力無明顯差異(P>0.05),10~40 μg/mL溶血卵磷脂處理細胞后,細胞活力顯著降低(P<0.05)。故選擇10μg/mL溶血卵磷脂為造模質量濃度。
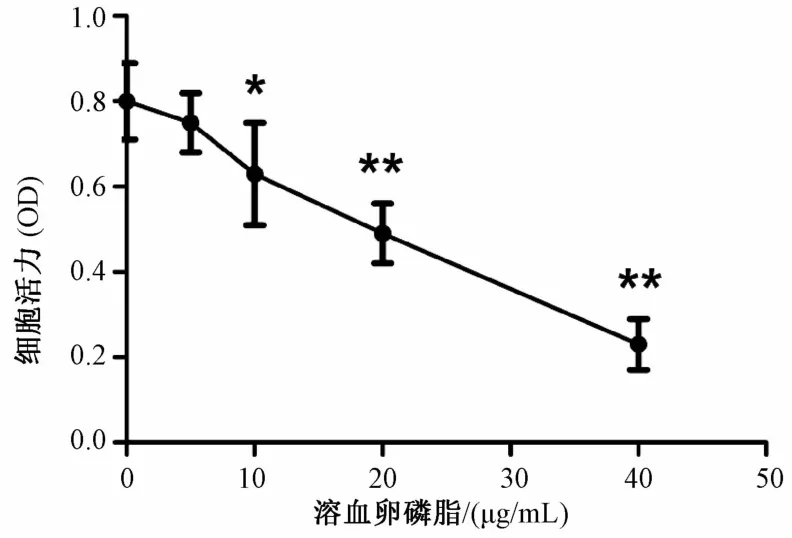
注:與DMEM組比較,*P<0.05,**P<0.01
2.2二苯乙烯苷對溶血卵磷脂損傷HUVECs活力的影響 CCK-8結果(圖2)顯示,給藥24 h處理后,損傷組細胞活力明顯降低,TSG組,隨著濃度增加,細胞活力逐漸增加,與溶血卵磷脂組比較1μmol/L TSG和10μmol/L TSG保護作用顯著(P<0.05)。
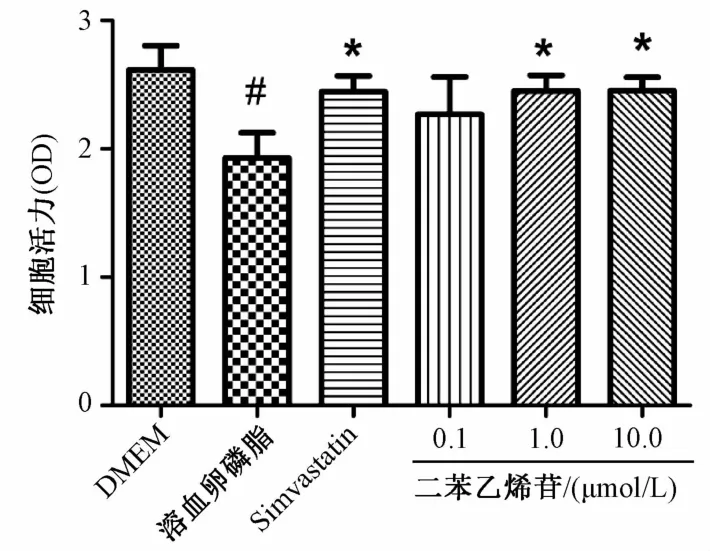
圖2 二苯乙烯苷對溶血卵磷脂損傷內皮細胞活力的影響Fig.2 Effects of TSG on HUVECs-induced by LPC
2.3二苯乙烯苷對溶血卵磷脂損傷HUVECs形態的影響 透射電鏡下觀察,損傷組較正常組空泡明顯增多,線粒體腫脹,細胞受損程度顯著,TSG預處理后,隨著濃度增高,細胞形態明顯好轉,空泡減少,線粒體豐富,細胞形態逐漸趨于正常。見圖3。
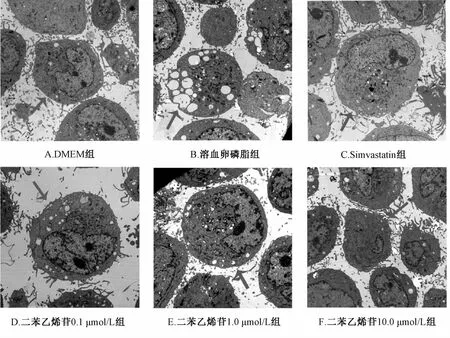
圖3 二苯乙烯苷對溶血卵磷脂損傷內皮細胞形態的影響(6000×)Fig.3 Effects of LPC-induced on cellmorphology of TSG(originalmagnification 6000×)
2.4二苯乙烯苷對LPC誘導細胞內ROS產生水平的影響 采用激光共聚焦顯微鏡法,直接觀察并檢測細胞內ROS水平。LPC組細胞內熒光水平明顯增強,二苯乙烯苷組,隨著濃度的增加,細胞內熒光水平逐漸降低。HUVECs經溶血卵磷脂處理24 h,與正常組比較細胞內ROS水平增加7.72倍(表1),但經0.1、1.0、10.0μmol/L二苯乙烯苷預處理,細胞內ROS水平明顯下降。可見,二苯乙烯苷處理可劑量依賴性明顯降低溶血卵磷脂誘導HUVECs細胞內產生ROS。見表1。
表1 二苯乙烯苷對溶血卵磷脂損傷內皮細胞產生ROS水平的影響(±s,n=3)Tab.1 Effects of TSG on HUVECs-induced by LPC the production of ROS(±s,n=3)
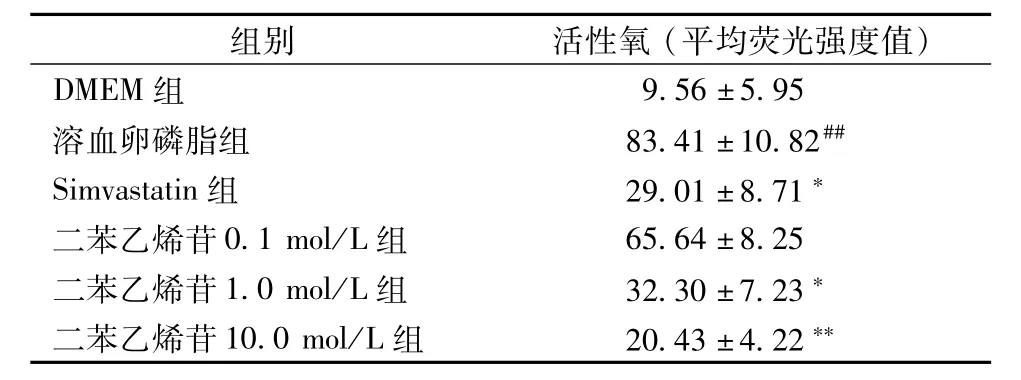
表1 二苯乙烯苷對溶血卵磷脂損傷內皮細胞產生ROS水平的影響(±s,n=3)Tab.1 Effects of TSG on HUVECs-induced by LPC the production of ROS(±s,n=3)
注:與DMEM組比較,#P<0.05,##P<0.01;與溶血卵磷脂組比較,*P<0.05,**P<0.01
組別活性氧(平均熒光強度值)DMEM組9.56±5.95溶血卵磷脂組83.41±10.82##Simvastatin組29.01±8.71*二苯乙烯苷0.1 mol/L組65.64±8.25二苯乙烯苷1.0 mol/L組32.30±7.23*二苯乙烯苷10.0 mol/L組20.43±4.22**
2.5二苯乙烯苷對LPC損傷HUVECs p-JNK表達水平的影響 圖4 Western blot結果顯示,溶血卵磷脂作用HUVECs 24 h,p-JNK蛋白表達上調,與DMEM組具有統計學差異(P<0.05)。二苯乙烯苷處理后p-JNK蛋白表達呈現濃度負相關(P<0.05)。
3 討論
溶血卵磷脂是ox-LDL主要活性成分,已知LPC可誘導產生ROS引起氧化應激并減少NO釋放,進而使內皮細胞功能受損[15]。內皮細胞作為血管的第一保護層,一旦受到損傷,功能發生障礙,喪失保護血管的功能,單核細胞侵入血管壁下層,分泌更多的炎性分子,促進平滑肌細胞遷移到內層而大量增殖,內皮細胞過度凋亡與平滑肌細胞過度增殖而形成動脈粥樣硬化斑塊,所以,阻止血管內皮細胞受損是防治動脈粥樣硬化發生發展的關鍵措施[16-17]。細胞凋亡過程中有很多蛋白因子被激活,除了經典的caspase級聯外,其中最重要的就是環境壓力感受器JNK和P38[18-19]。JNK蛋白位于細胞質中,其他可以接受多種刺激而活化,磷酸化JNK又可激活多種核轉錄因子,如c-Jun、ATF2和ELK等,進而導致細胞凋亡。有研究認為JNK的激活可以增強TNF誘導ROS產生;更有研究證實,高糖誘導HUVECs產生ROS并激活JNK和caspase-3引起內皮細胞凋亡[20]。這看似矛盾的結論提示細胞凋亡過程中JNK磷酸化激活和ROS大量產生可能有相互促進的正反饋效應。

圖4 二苯乙烯苷對溶血卵磷脂損傷內皮細胞p-JNK蛋白表達的影響Fig.4 Effects of TSG on p-JNK expression of HUVECsindued by LPC
本實驗結果表明,LPC處理HUVECs 24 h,細胞活性明顯降低,細胞內空泡增多,線粒體多腫脹,細胞內產生大量ROS,p-JNK蛋白表達明顯升高。二苯乙烯苷處理后細胞活性顯著增強,細胞形態趨于正常,空泡顯著減少,線粒體多數完整;細胞內ROS水平降低,p-JNK蛋白表達量降低,并且這種降低具有劑量依賴性。由此說明JNK在LPC誘導的細胞凋亡中起到了非常重要的作用,同時二苯乙烯苷可能是通過或者部分通過ROS調節JNK通路起到保護作用。當然JNK基因表達的調控過程非常復雜,其信號傳導過程中該藥物還參與了哪些調控尚待進一步探討。
總之,深入研究二苯乙烯苷對ROS/JNK通路的調控機制有助于治療動脈粥樣硬化藥物的開發與創制。
[1] Vuong T D,de Kimpe S,de Roos R,et al.Albumin restores lysophosphatidylcholine-induced inhibition of vasodilation in rat aorta[J].Kidney Int,2001,60(3):1088-1096.
[2] Casino PR,Kilcoyne CM,Cannon R R,etal.Impaired endothelium-dependent vascular relaxation in patients with hypercholesterolemia extends beyond themuscarinic receptor[J].Am JCardiol,1995,75(1):40-44.
[3] Cardillo C,Campia U,Kilcoyne CM,et al.Improved endothelium-dependent vasodilation after blockade of endothelin receptors in patients with essential hypertension[J].Circulation,2002,105(4):452-456.
[4] Celermajer D S,Adams M R,Clarkson P,et al.Passive smoking and impaired endothelium-dependent arterial dilatation in healthy young adults[J].N Engl JMed,1996,334(3):150-154.
[5] Chapman M J.From pathophysiology to targeted therapy for atherothrombosis:a role for the combination of statin and aspirin in secondary prevention[J].Pharmacol Ther,2007,113(1):184-196.
[6] Zeng C,Xiao J H,Chang M J,et al.Beneficial effects of THSG on acetic acid-induced experimental colitis:involvement of upregulation of PPAR-gamma and inhibition of the Nf-Kappab inflammatory pathway[J].Molecules,2011,16(10):8552-8568.
[7] Zhang JK,Yang L,Meng G L,et al.Protective effect of tetrahydroxystilbene glucoside against hydrogen peroxide-induced dysfunction and oxidative stress in osteoblastic MC3T3-E1 cells[J].Eur JPharmacol,2012,689(1-3):31-37.
[8] Yao W,Fan W,Huang C,et al.Proteomic analysis for antiatherosclerotic effect of tetrahydroxystilbene glucoside in rats[J].Biomed Pharmacother,2013,67(2):140-145.
[9] Zhou X X,Yang Q,Xie Y H,etal.Protective effectof tetrahydroxystilbene glucoside against D-galactose induced aging process in mice[J].Phytochem Lett,2013,6(3):372-378.
[10] Xiang K,Liu G,Zhou Y J,et al.2,3,5,4′-tetrahydroxystilbene-2-O-beta-D-glucoside(THSG)attenuates human platelet aggregation,secretion and spreading inυitro[J].Thromb Res,2014,133(2):211-217.
[11] Sun Y N,Cui L,LiW,etal.Promotion effectof constituents from the root of Polygonum multiflorum on hair growth[J]. Bioorg Med Chem Lett,2013,23(17):4801-4805.
[12] Zhang L,Xing Y,Ye C F,et al.Learning-memory deficit with aging in APP transgenic mice of Alzheimer's disease and intervention by using tetrahydroxystilbene glucoside[J].Behaυ Brain Res,2006,173(2):246-254.
[13] Zhang L,Huang L,Chen L,et al.Neuroprotection by tetrahydroxystilbene glucoside in the MPTPmouse model of Parkinson's disease[J].Toxicol Lett,2013,222(2):155-163.
[14] SakaiM,Miyazaki A,Hakamata H,et al.Lysophosphatidylcholine plays an essential role in themitogenic effectof oxidized low density lipoprotein on murine macrophages[J].J Biol Chem,1994,269(50):31430-31435.
[15] Hsu JH,Wu JR,Liou S F,et al.Labedipinedilol-A prevents lysophosphatidylcholine-induced vascular smooth muscle cell death through reducing reactive oxygen species productionand anti-apoptosis[J].Atherosclerosis,2011,217(2):379-386.
[16] Nagy J,Csiky B,Kovacs T,et al.Endothelial dysfunction[J].OrυHetil,2001,142(31):1667-1672.
[17] Luscher T F.Vascular protection:current possibilities and future perspectives[J].Int JClin Pract Suppl,2001,117(1):3-6.
[18] Fuller C L,Braciale V L,Samelson L E.All roads lead to actin:the intimate relationship between TCR signaling and the cytoskeleton[J].Immunol Reυ,2003,191(1):220-236.
[19] Kuhne M R,Lin J,Yablonski D,et al.Linker for activation of T cells,zeta-associated protein-70,and Src homology 2 domain-containing leukocyte protein-76 are required for TCR-induced microtubule-organizing center polarization[J].J Immunol,2003,171(2):860-866.
[20] Ho FM,Lin W W,Chen B C,et al.High glucose-induced apoptosis in human vascular endothelial cells is mediated through NF-kappaB and c-Jun NH2-terminal kinase pathway and prevented by PI3K/Akt/eNOS pathway[J].Cell Signal,2006,18(3):391-399.
2,3,5,4′-Tetrahydroxystilbene-2-O-β-D-glucoside regulates ROS-related JNK pathway against LPC-induced HUVECs injury
ZHAO Jing, XU Shou-zhu, SONG Fan, NIAN Lun, ZHOU Xuan-xuan, WANG Si-wang*
(Department of Natural Medicine,School of Pharmacy,Fourth Military Medical Uniυersity,Xi'an 710032,China)
AIM To study the protective effect of 2,3,5,4′-tetrahydroxystilbene-2-O-β-D-glucoside(TSG)extracted from Polygonimultiflori Radix on lysophosphatidylcholine(LPC)-induced HUVECs and to explore its possiblemechanism.METHODS After treating HUVECs with LPC(5μg/mL,10μg/mL,20μg/mL,40 μg/mL)for 24 h,the optimal concentration of LPC was chosen based on the results from MTT assay and the cell viability wasmeasured by CCK-8 assay.Transmission electron microscope was used to study cellmorphology.The level of reactive oxygen species(ROS)production in HUVECs was observed by laser scanning confocal microscope.The expression of p-JNK was detected by Western-blot.RESULTS LPC could induce endothelial cell in-jury.The cell viability decreased with the increase of the concentration of LPC.Compared with DMEM group,the concentration of10μg/mL LPC significantly decreased the cell viability,increased the cell vacuoles,caused mitochondria to swell,increased the production of ROS and significantly up-regulated the expression of p-JNK.Compared with LPC group,TSG treatment group(1.0μmol/L and 10.0μmol/L)enhanced the cell viability,decreased cell vacuoles,mitochondria with complete cristae,and down-regulated the expression of p-JNK(P<0.05).CONCLUSION TSG inhibits LPC-induced damage to HUVECs,which may be associated with regulating ROS-related JNK pathway.
2,3,5,4′-tetrahydroxystilbene-2-O-β-D-glucoside(TSG);lysophosphatidylcholine(LPC);human umbilical vein endothelial cells(HUVECs);endothelial injury;reactive oxygen species(ROS);p-JNK pathway
R966
A
1001-1528(2015)03-0487-06
10.3969/j.issn.1001-1528.2015.03.005
2014-04-23
陜西省科技統籌重大專項(2012KTCQ03-02)
趙 晶(1987—),女,碩士生,研究方向為分子中藥與藥理。E-mail:18792402773@163.com
王四旺(1958—),男,教授,博士生導師,研究方向為分子中藥與藥理。E-mail:wangsiw@fmmu.edu.cn

