響應(yīng)面設(shè)計(jì)優(yōu)化復(fù)合酶法提取菊苣菊粉工藝研究
翟丹云,陳興都,陳慶安,牛 婕,馮 平,趙莉莉,楊曉麗
(甘肅省商業(yè)科技研究所,甘肅蘭州730010)
響應(yīng)面設(shè)計(jì)優(yōu)化復(fù)合酶法提取菊苣菊粉工藝研究
翟丹云,陳興都,陳慶安,牛婕,馮平,趙莉莉,楊曉麗
(甘肅省商業(yè)科技研究所,甘肅蘭州730010)
以菊苣根為原料,采用果膠酶和纖維素酶復(fù)合法提取菊粉。在單因素的基礎(chǔ)上,選取料液比、溫度、時(shí)間、pH為自變量,以菊粉提取率為響應(yīng)值,通過Box-Behnken響應(yīng)面實(shí)驗(yàn)設(shè)計(jì)對(duì)其提取工藝參數(shù)進(jìn)行優(yōu)化。結(jié)果顯示復(fù)合酶法提取菊苣菊粉最優(yōu)工藝為:料液比1∶8g/mL,提取溫度60℃,提取時(shí)間2.5h,提取pH6.0,復(fù)合酶配比為1∶2的條件下,菊粉提取率可達(dá)到54.63%。與熱水浸提法相比,提取率高出64.10%。
菊苣,菊粉,果膠酶,纖維素酶,響應(yīng)面設(shè)計(jì)
菊苣(Cichorium intybus L.),又名苦苣、苦菊,為菊科菊苣屬草本植物,廣泛分布于亞歐大陸和北美等地,在我國(guó)陜西、甘肅、新疆、山西、河北、遼寧等地區(qū)種植[1],菊苣具有耐熱耐寒、抗逆性強(qiáng)、適應(yīng)性強(qiáng)等特點(diǎn)[2],是常見的藥食兩用型經(jīng)濟(jì)作物,具有豐富的營(yíng)養(yǎng)價(jià)值和良好的生理功能[3]。除傳統(tǒng)的作為蔬菜、牧草利用外,還可作為功能性食品等進(jìn)行開發(fā)[4]。
菊粉(inulin)又稱菊糖,是一類天然果聚糖的碳水化合物,具有低聚果糖和膳食纖維的特性[5],其結(jié)構(gòu)是由果糖殘基以β-(2-1)-糖苷鍵連接而成的直鏈多糖,末端或連有葡萄糖殘基[6]。菊粉的主要功能有:降低血脂、血糖,調(diào)節(jié)能量代謝;促進(jìn)礦物質(zhì)的吸收和利用[7];維持腸內(nèi)微生物菌群的平衡;增強(qiáng)人體的抗癌免疫機(jī)能[8]。因其菊粉特殊的生理功能,被大量用于食品、醫(yī)藥和化工行業(yè)[9]。
目前,酶法提取菊糖具有高效性、專一性,不引入其他雜質(zhì),同時(shí)不影響菊糖的組織結(jié)構(gòu)和生物活性等特點(diǎn)[10],是當(dāng)前研究的熱點(diǎn)。對(duì)菊糖酶法提取的研究主要集中在果膠酶、蛋白酶等單酶上[10-11],但復(fù)合酶提取菊粉的研究報(bào)道很少。本實(shí)驗(yàn)以菊苣根為原料,通過復(fù)合酶法對(duì)菊粉的提取進(jìn)行研究,獲得菊粉提取的最優(yōu)工藝參數(shù),為菊苣資源的綜合利用和深加工提供技術(shù)參考。
1 材料與方法
1.1材料與儀器
菊苣購于白銀熙瑞生物工程有限公司,鮮菊苣采收,去葉,清洗,低溫冰箱-18℃保藏,處理時(shí)常溫解凍,清洗去皮,切成絲狀(直徑2~3mm),冰箱低溫保存[12];果膠酶(酶活力20000U/g) 上海中秦化學(xué)試劑有限公司;纖維素酶(酶活力20000U/g) 白銀賽諾生物科技有限公司;蒽酮、硫脲、D-果糖、鹽酸、氫氧化鈉、3,5-二硝基水楊酸等均為分析純。
UV-3802型紫外分光光度計(jì)上海江儀儀器有限公司;GF-2型鼓風(fēng)電熱恒溫干燥箱廣州東方紅醫(yī)療儀器廠;DK-S12型電熱恒溫水浴鍋上海森信實(shí)驗(yàn)儀器有限公司;AL204型電子天平梅特勒-托利多儀器有限公司;GL-21M型湘儀離心機(jī)長(zhǎng)沙湘儀離心機(jī)儀器有限公司;BCD-238S型低溫冷凍冰箱青島海爾股份有限公司;PHS-3C型pH計(jì)上海虹益儀器有限公司。
1.2實(shí)驗(yàn)方法
1.2.1菊粉提取率的測(cè)定參照楊振的方法[13],計(jì)算式為:菊粉提取率(%)=(提取液總糖質(zhì)量×0.9-提取液還原糖質(zhì)量)/原料中菊粉質(zhì)量×100
還原糖濃度的測(cè)定:采用3,5-二硝基水楊酸(DNS)比色法[13]。取7支10m L的比色管,依次加入0.2、0.4、0.6、0.8、1.0、1.2、1.4m L的D-果糖標(biāo)準(zhǔn)液,蒸餾水定容至2m L,配成不同濃度的D-果糖反應(yīng)液。分別加入2.0m L的3,5-二硝基水楊酸搖勻,沸水浴煮2m in顯色,流水冷卻,定容至25m L,540nm下測(cè)吸光值,以D-果糖濃度為橫坐標(biāo),吸光度為縱坐標(biāo)制作標(biāo)準(zhǔn)曲線和樣品測(cè)定。依還原糖測(cè)定標(biāo)準(zhǔn)曲線的回歸方程:y=0.0263x-0.0124(R2=0.9963)。
總糖濃度的測(cè)定:采用蒽酮比色法[14]。取7支比色管,依次加入0.5、1.0、1.5、2.0、2.5、3.0、3.5m L的D-果糖標(biāo)準(zhǔn)液,蒸餾水定容至2m L,配成不同濃度的D-果糖反應(yīng)液,分別加入5.0m L冷的蒽酮溶液,混勻后沸水浴保持10m in,流水冷卻20m in,定容至25m L,于620nm下測(cè)吸光值,以D-果糖濃度為橫坐標(biāo),吸光度為縱坐標(biāo)制作標(biāo)準(zhǔn)曲線和樣品測(cè)定。依總糖測(cè)定標(biāo)準(zhǔn)曲線的回歸方程:y=0.0804x+0.0113(R2= 0.9965)。
1.2.2提取單因素實(shí)驗(yàn)在預(yù)實(shí)驗(yàn)的基礎(chǔ)上,選擇纖維素酶與果膠酶復(fù)合法提取菊苣中菊粉,以料液比、提取溫度、提取時(shí)間、提取pH、酶液濃度以及復(fù)合酶配比6個(gè)因素進(jìn)行單因素實(shí)驗(yàn),分別考察其對(duì)菊粉提取率的影響,確定各個(gè)因素的優(yōu)化區(qū)間。
稱取5.0g菊苣塊莖絲,置于250m L的燒瓶中,在提取菊苣中菊粉的過程中控制體系料液比1∶8g/m L,溫度60℃,時(shí)間2.5h,pH 6.0,果膠酶和纖維素酶的配比為1∶2,分別選擇料液比為1∶8、1∶11、1∶14、1∶17、1∶20g/m L;溫度為30、40、50、60、70℃;時(shí)間為1.0、1.5、2.0、2.5、3.0h;pH為4.0、5.0、6.0、7.0、8.0;酶液濃度為0.1、0.2、0.3、0.4、0.5%;果膠酶與纖維素酶配比為2∶1、2∶2、2∶3、2∶4、2∶5,加入檸檬酸-磷酸氫二鈉緩沖液調(diào)節(jié)pH,熱回流提取,過濾取上清液[11,15-17],備用。
1.2.3響應(yīng)面實(shí)驗(yàn)設(shè)計(jì)在單因素實(shí)驗(yàn)的基礎(chǔ)上,固定復(fù)合酶配比為1∶2,以料液比、溫度、時(shí)間以及pH為自變量,菊粉提取率為因變量,通過中心旋轉(zhuǎn)組合設(shè)計(jì)來篩選最優(yōu)提取工藝參數(shù)[18-19],因素水平如表1所示。
1.2.4數(shù)據(jù)分析方法采用MicrosoftOffice Excle 2007和Design Expert 8.03軟件數(shù)據(jù)分析。
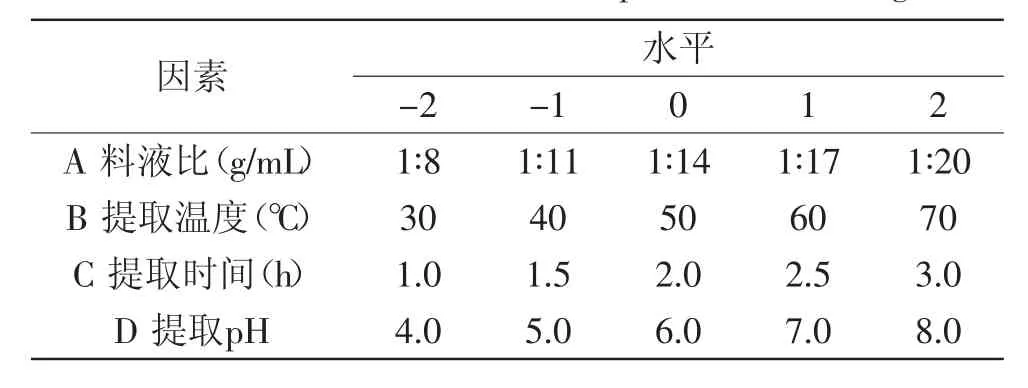
表1 響應(yīng)面設(shè)計(jì)因素水平表Table 1 Factors and levels of response surface design
2 結(jié)果與討論
2.1提取工藝參數(shù)的確定
2.1.1料液比對(duì)菊粉提取率的影響由圖1可知,隨料液比增大,在兩種酶制劑的作用下,提取液中菊粉提取率均呈逐漸下降的趨勢(shì)。當(dāng)料液比為1∶8g/m L時(shí),果膠酶酶促反應(yīng)下,菊粉提取率39.32%,比1∶11高出61.35%,而纖維素酶促反應(yīng)下,菊粉提取率為51.20%,比1∶11高11.94%。這與鐘丹等超聲波提取牛蒡菊糖的工藝研究的結(jié)果有差異[20],這可能與原料的提取溶劑、其活性成分的結(jié)構(gòu)不同有關(guān)。考慮到生產(chǎn)成本,因此本實(shí)驗(yàn)選取料液比為1∶8g/m L。
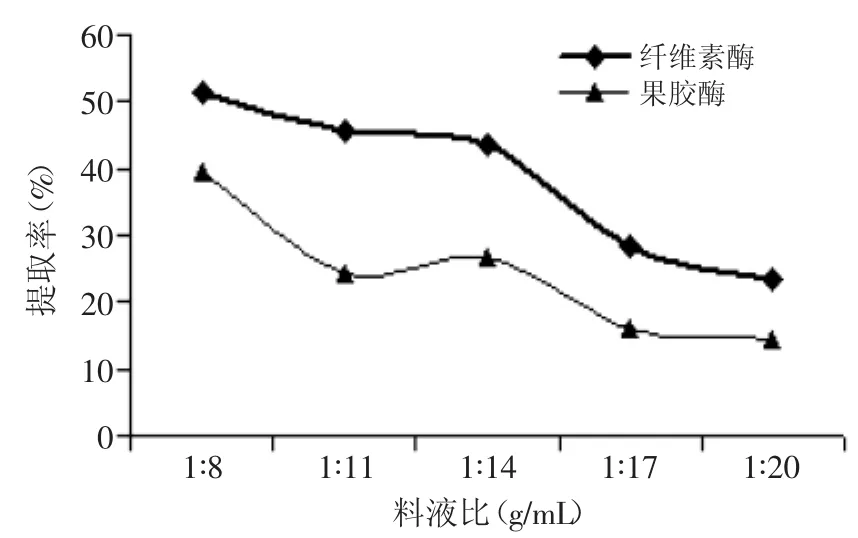
圖1 料液比對(duì)菊粉提取率的影響Fig.1 Effectof ratio of solid to liquid on inulin yield
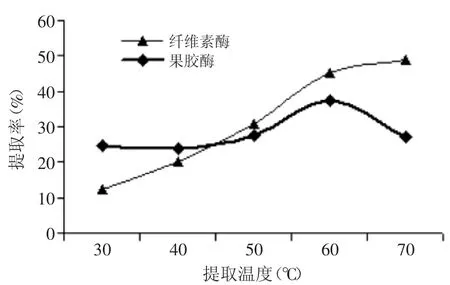
圖2 提取溫度對(duì)菊粉提取率的影響Fig.2 Effectof extraction temperature on inulin yield
2.1.2溫度對(duì)菊粉提取率的影響由圖2可知,隨溫度升高,在纖維素酶的作用下,菊粉提取率呈不斷上升的趨勢(shì),60℃時(shí)菊粉提取率達(dá)到45.25%,比70℃低13.51%。而在果膠酶的作用下,菊粉提取率隨溫度的增加呈現(xiàn)先上升后下降的趨勢(shì),當(dāng)溫度為60℃時(shí),菊粉提取率最高,達(dá)到37.40%。溫度升高,會(huì)促使酶液分子受熱擴(kuò)散,增大與菊苣的接觸程度,加速菊苣中菊粉的降解溶出。但溫度過高,會(huì)抑制酶活性,甚至?xí)鹈甘Щ钭冃裕焕诰辗廴艹觥R虼藭簳r(shí)選取溫度為60℃。
2.1.3時(shí)間對(duì)菊粉提取率的影響由圖3可知,隨提取時(shí)間的延長(zhǎng),在兩種酶制劑的作用下,提取液中菊粉提取率均呈先上升后趨于穩(wěn)定的趨勢(shì)。纖維素酶促反應(yīng)下,菊粉提取率在2.5h時(shí)菊粉提取率為45.95%,比時(shí)間2h高97.38%,比時(shí)間3h低8.47%。而果膠酶促反應(yīng)下,提取時(shí)間在2.5h時(shí)菊粉提取率達(dá)到37.70%,比時(shí)間2h高144.81%,比時(shí)間3h低3.08%。在適宜的溫度下,延長(zhǎng)提取時(shí)間酶促反應(yīng)使菊苣根中的菊糖迅速溶出,當(dāng)達(dá)到擴(kuò)散的動(dòng)態(tài)平衡后,提取液中菊糖提取率趨于不變,這與胡建鋒等菊芋中菊粉提取工藝比較研究結(jié)果類似[21]。因此本實(shí)驗(yàn)選取時(shí)間為2.5h。
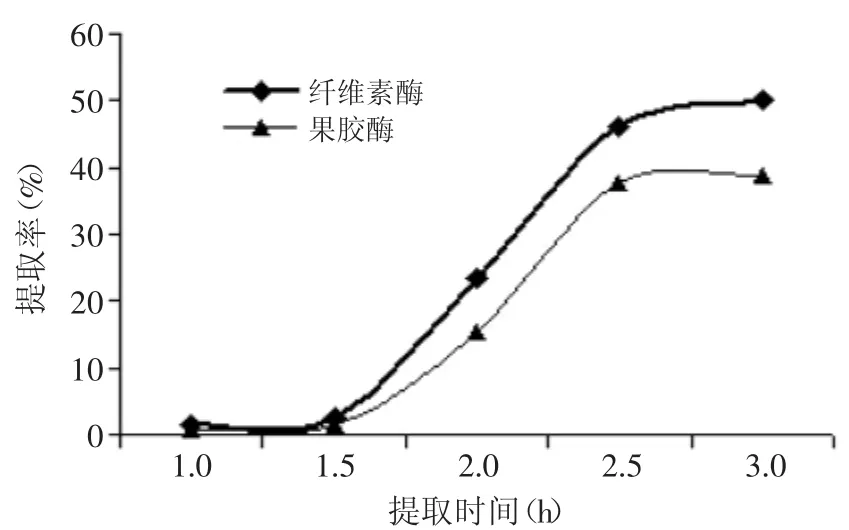
圖3 提取時(shí)間對(duì)菊粉提取率的影響Fig.3 Effectof extraction time on inulin yield
2.1.4pH對(duì)菊粉提取率的影響由圖4可知,隨提取pH的增加,在纖維素酶的作用下,提取液中菊粉提取率呈逐漸上升的趨勢(shì),當(dāng)提取pH為7時(shí),菊粉提取率達(dá)到42.59%,比pH 8低15.48%。而在果膠酶的作用下,提取液中菊粉提取率呈先上升后下降的總趨勢(shì),當(dāng)提取pH為5時(shí),菊粉提取率最高,為35.71%。可能原因是在最適提取pH下,菊苣細(xì)胞分解,菊粉迅速溶出,高于或低于最適pH,均會(huì)使酶活性受到抑制,菊粉的溶出率會(huì)下降。這與曹澤虹酶法提取牛蒡菊糖的結(jié)果一致[22]。因此,本實(shí)驗(yàn)暫定響應(yīng)面設(shè)計(jì)時(shí)提取pH的0水平為6.0,通過響應(yīng)面實(shí)驗(yàn)設(shè)計(jì)進(jìn)一步優(yōu)化其參數(shù)。
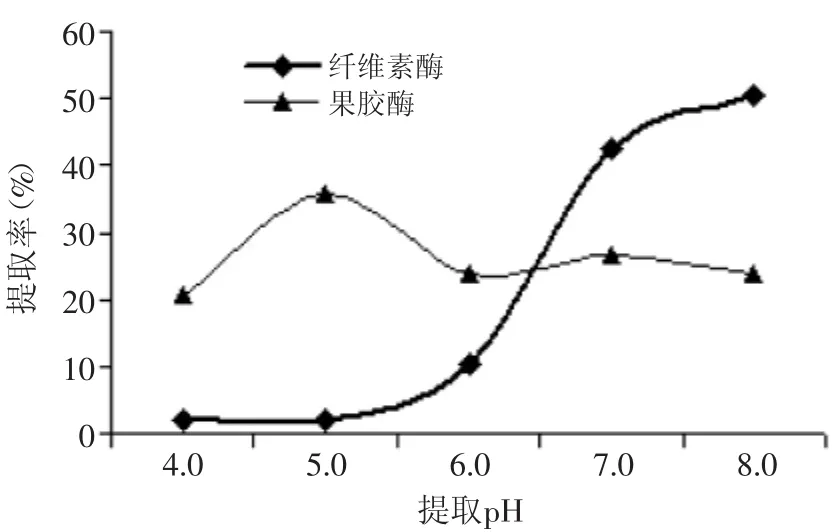
圖4 提取pH對(duì)菊粉提取率的影響Fig.4 Effect of extraction pH on inulin yield
2.2復(fù)合酶比例的確定
2.2.1酶液濃度對(duì)菊粉提取率的影響由圖5可知,在果膠酶的作用下,隨酶液濃度的增大,提取液中菊粉提取率呈不斷上升的趨勢(shì),在酶液濃度為0.5%時(shí),提取率最高,為35.89%,比濃度0.4%高77.23%。而在纖維素酶的作用下,提取液中菊粉提取率呈先上升后下降的趨勢(shì),當(dāng)酶液濃度為0.4%時(shí),菊粉提取率最高,為43.34%。在適宜的條件下,增加酶液濃度,會(huì)增大與菊苣接觸的表面積,加速菊粉的溶出。考慮到生產(chǎn)成本,本實(shí)驗(yàn)暫定果膠酶和纖維素酶濃度分別為0.2%和0.4%。
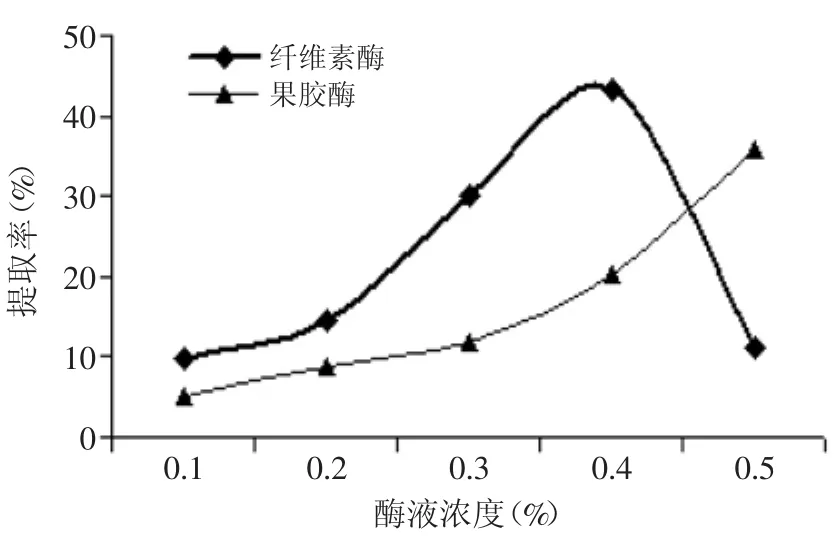
圖5 酶液濃度對(duì)菊粉提取率的影響Fig.5 Effectof enzyme liquid concentratione on inulin yield
2.2.2復(fù)合酶配比對(duì)菊粉提取率的影響由圖6可知,復(fù)合酶中隨纖維素酶比例的增加,菊粉提取率呈先上升后下降的趨勢(shì),當(dāng)果膠酶與纖維素酶比例為2∶4時(shí),菊粉提取率最高為54.95%。因此,考慮到生產(chǎn)成本和產(chǎn)品質(zhì)量。本實(shí)驗(yàn)選取果膠酶和纖維素酶比例為2∶4,即1∶2。
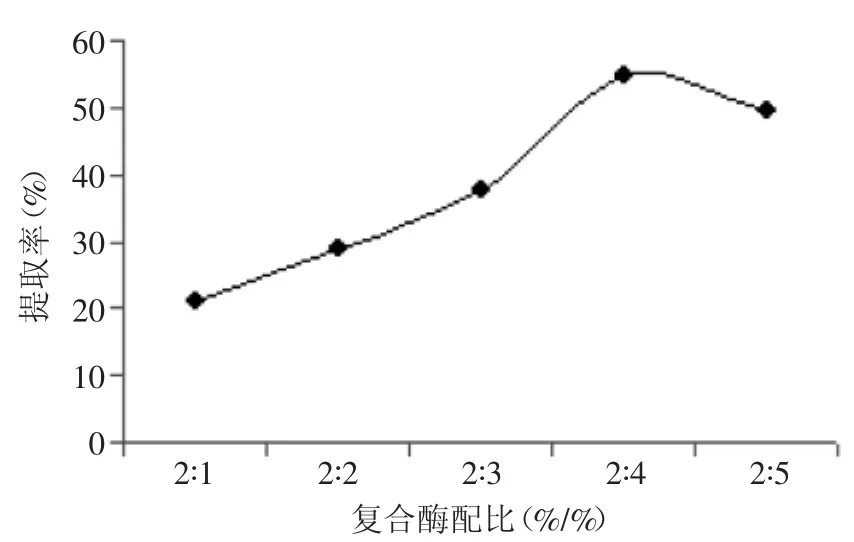
圖6 復(fù)合酶配比對(duì)菊粉提取率的影響Fig.6 Effectof the ratio of compound enzymes on inulin yield
2.3響應(yīng)面實(shí)驗(yàn)設(shè)計(jì)結(jié)果分析
菊粉提取響應(yīng)面設(shè)計(jì)實(shí)驗(yàn)結(jié)果如表2所示,利用Design-expert 8.06進(jìn)行回歸擬合,得到自變量與菊粉提取率(Y)的二次多項(xiàng)回歸方程為:Y=33.86-0.58A+ 0.34B+0.12C-3.70D+6.53AB-2.54AC-1.37AD+2.12BC+ 2.66BD-2.32CD-0.58A2+0.83B2-3.32C2-2.58D2。
為確定響應(yīng)面實(shí)驗(yàn)設(shè)計(jì)中4個(gè)實(shí)驗(yàn)因素對(duì)菊粉提取效果的影響,以及各個(gè)因素的交互作用和顯著性,進(jìn)行回歸方差分析(表3)。結(jié)果顯示:模型p<0.01,相關(guān)系數(shù)R2為0.9162,校正系數(shù)R2Adj為0.8380,響應(yīng)變量高于0.80,模型回歸極顯著,各因素之間的交互作用見圖7~圖12。失擬項(xiàng)不顯著(p>0.05),表明該回歸方程對(duì)菊苣復(fù)合酶法提取實(shí)驗(yàn)擬合情況良好。通過模型系數(shù)顯著性檢驗(yàn),得到提取因素的主效應(yīng)關(guān)系:D>A>B>C,即pH>料液比>溫度>時(shí)間,其中A2對(duì)提取效果影響顯著,而因素D、C2、D2對(duì)菊粉提取效果有極顯著的影響。
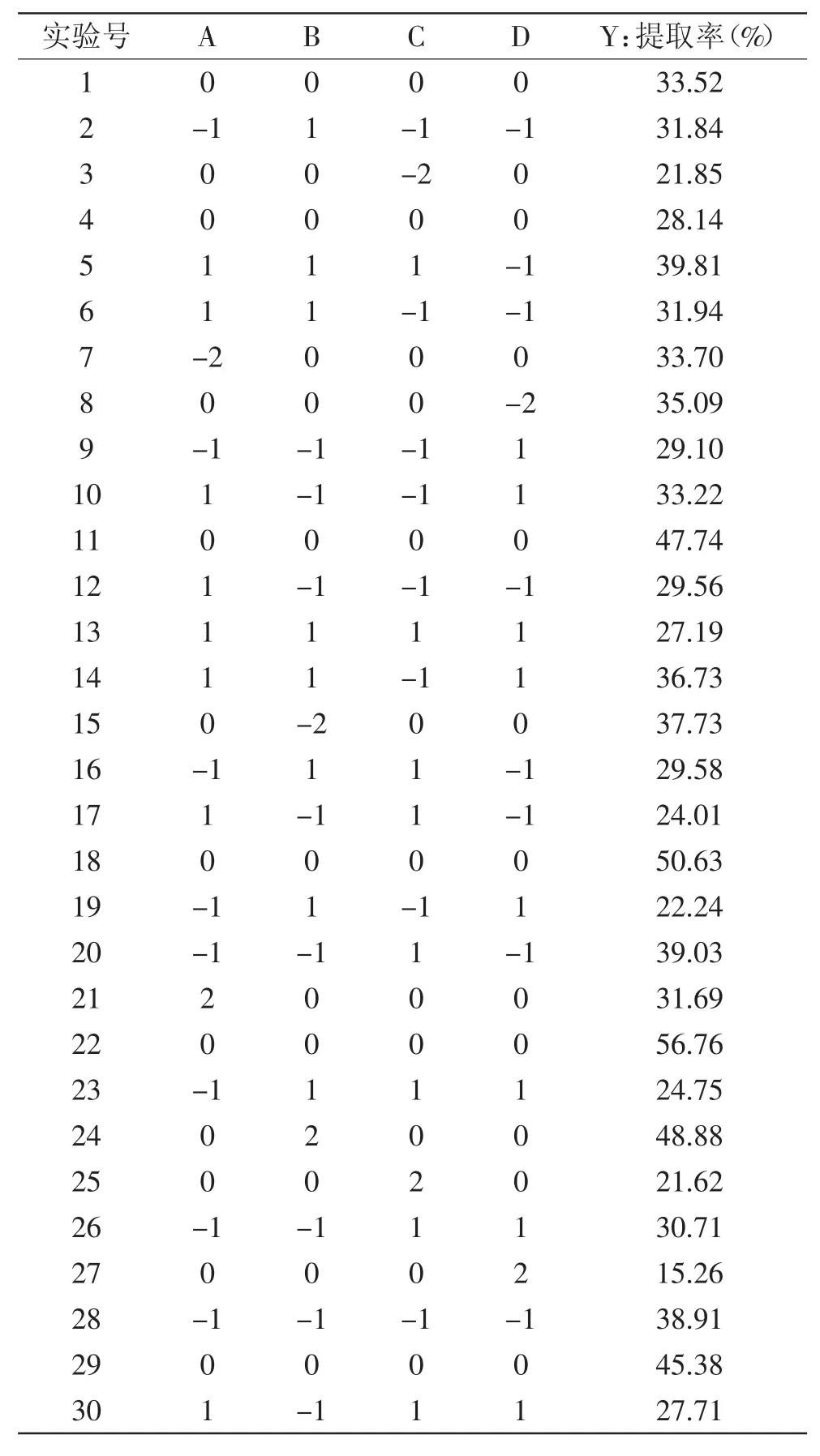
表2 Box-Behnken實(shí)驗(yàn)設(shè)計(jì)結(jié)果Table 2 Design and results of Box-Behnken test
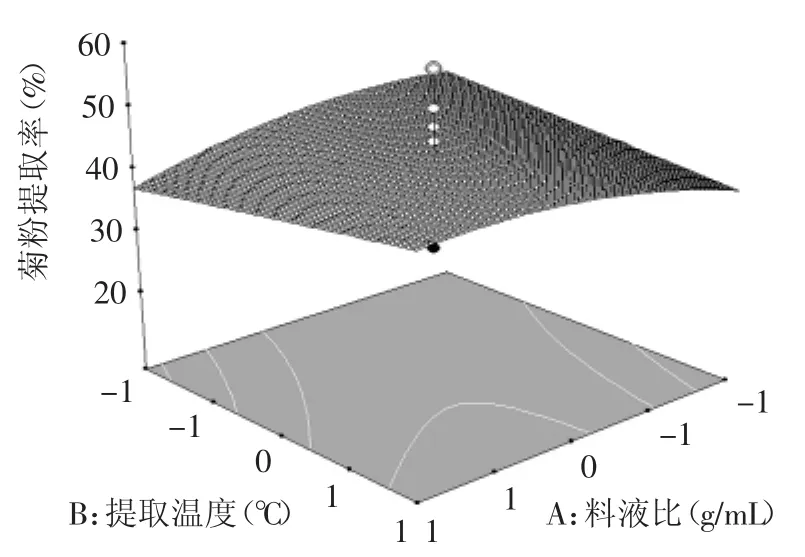
圖7 料液比和提取溫度對(duì)菊粉提取率的影響Fig.7 Effectof ratio of solid to liquid and extraction temperature on inulin yield
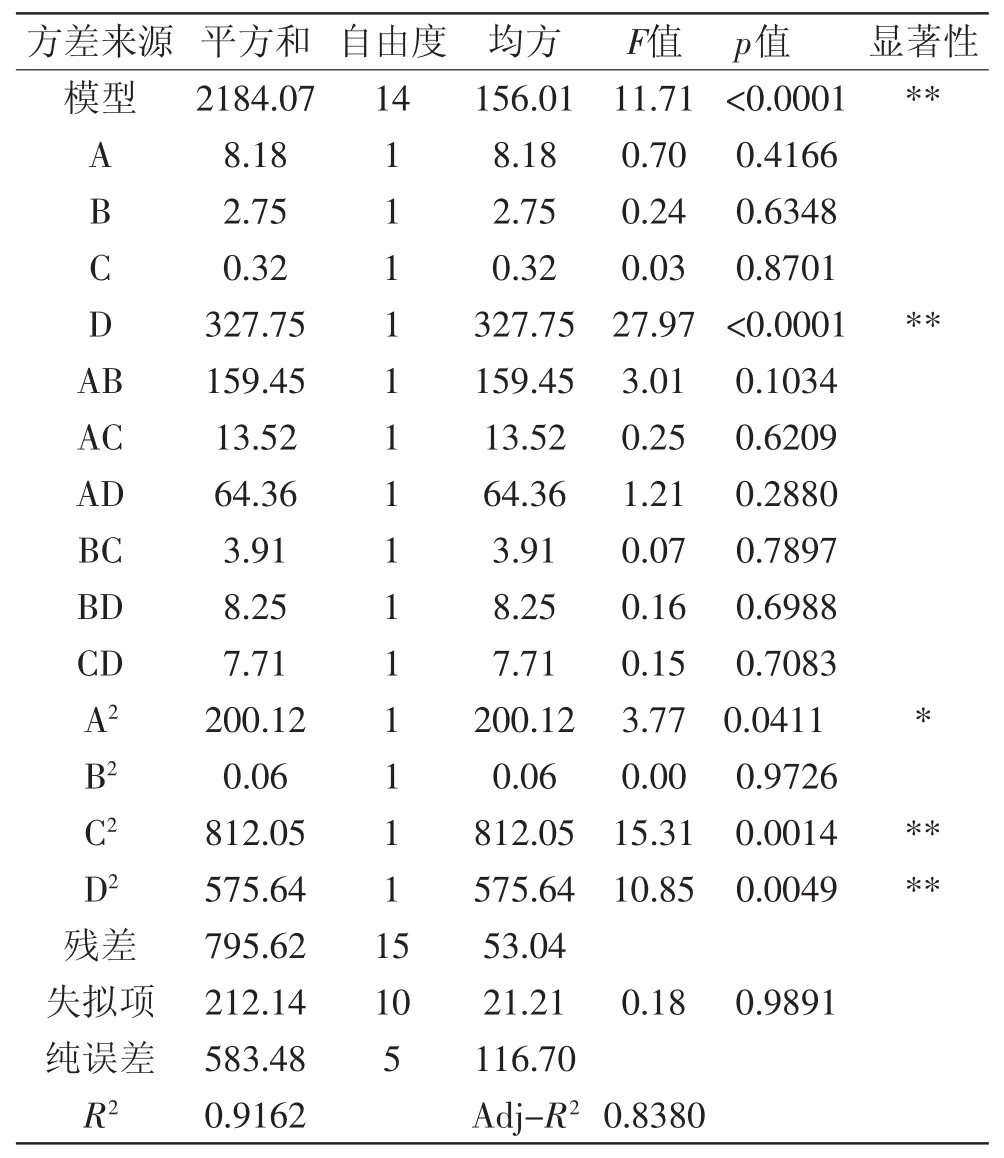
表3 方差分析結(jié)果Table 3 Results of variance analysis
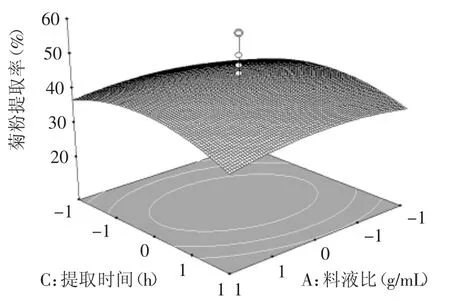
圖8 料液比和提取時(shí)間對(duì)菊粉提取率的影響Fig.8 Effectof ratio of solid to liquid and extraction time on inulin yield
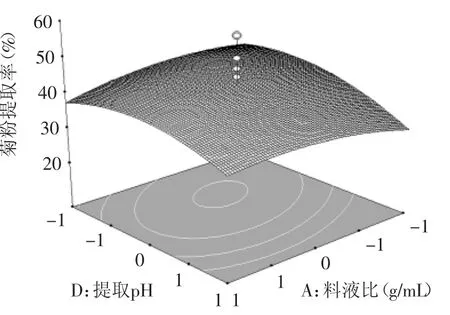
圖9 料液比和提取pH對(duì)菊粉提取率的影響Fig.9 Effectof ratio of solid to liquid and extraction pH on inulin yield
通過復(fù)合酶破碎降解菊苣果肉細(xì)胞,便于菊粉充分溶出,響應(yīng)面設(shè)計(jì)優(yōu)化菊粉的最優(yōu)提取工藝為:料液比1∶8g/m L、溫度60℃、時(shí)間2.5h、pH6.0。在此條件下,菊苣中菊粉提取率預(yù)測(cè)值為55.17%,驗(yàn)證實(shí)驗(yàn)值為54.63%,實(shí)際值與預(yù)測(cè)值之間的相對(duì)誤差為0.98%。而通過實(shí)驗(yàn)驗(yàn)證,最優(yōu)熱浸提條件(料液比1∶8g/m L,提取溫度75℃,提取時(shí)間2h),菊粉的提取率可達(dá)33.29%。因而,復(fù)合酶法的提取效率比熱水浸提高出64.10%。

圖10 提取溫度和提取時(shí)間對(duì)菊粉提取率的影響Fig.10 Effectof extraction temperature and time on inulin yield
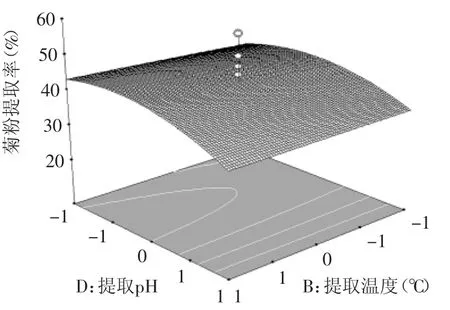
圖11 提取溫度和提取pH對(duì)菊粉提取率的影響Fig.11 Effectof extraction temperature and pH on inulin yield
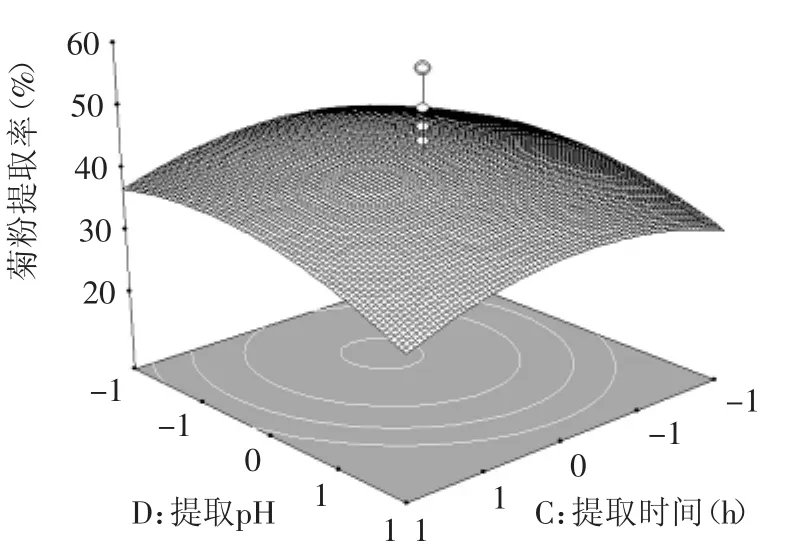
圖12 提取時(shí)間和提取pH對(duì)菊粉提取率的影響Fig.12 Effectof extraction time and pH on inulin yield
3 結(jié)論
3.1在單因素實(shí)驗(yàn)的基礎(chǔ)上,通過響應(yīng)面實(shí)驗(yàn)優(yōu)化酶法提取菊苣菊粉工藝,確定出果膠酶和纖維素酶最優(yōu)比例為1∶2。通過響應(yīng)面設(shè)計(jì)優(yōu)化菊苣中菊粉提取工藝,確定最佳復(fù)合酶提取條件:料液比1∶8g/m L,溫度60℃,時(shí)間2.5h,pH 6.0。
3.2在最優(yōu)提取條件下,測(cè)得其菊粉提取率為54.63%,比熱浸提下高出64.10%。經(jīng)過復(fù)合酶法提取的粗提液中含有蛋白質(zhì)、色素、果膠、有機(jī)酸等雜質(zhì),需要進(jìn)一步純化、精制,以提高菊粉的利用率。
[1]柳溪,王曉蕾.新鮮菊苣提取和純化菊粉的工藝[J].食品研究與開發(fā),2013,34(13):37-40.
[2]張玉,白史且,李達(dá)旭,等.菊苣開發(fā)與利用[J].中國(guó)野生植物資源,2009,28(4):10-14.
[3]徐雅梅,高國(guó)榮.菊苣的開發(fā)與利用研究綜述[J].安徽農(nóng)業(yè)科學(xué),2009,37(28):13569-13571.
[4]徐偉君,張九東,陶貴榮,等.野生菊苣營(yíng)養(yǎng)成分分析[J].北方園藝,2012(3):30-31.
[5]張曉玲.菊苣綜合利用與菊粉的純化及活性研究[D].楊凌:西北農(nóng)林科技大學(xué),2008.
[6]彭英云,鄭清,張濤.菊粉的功能與利用[J].食品研究與開發(fā),2012,33(10):236-240.
[7]李雨露,劉麗萍,佟麗媛.菊粉的特性及在食品中的應(yīng)用[J].食品工業(yè)科技,2013,34(13):392-394.
[8]Monasteroloa R C,Llauradoa M G,Rubio-Torrentsa C,etal. Safety and efficacy of inulin and oligofructose supplementation in infant formula:Results from a randomized clinical trial[J]. Clinical Nutrition,2013,32(6):918-927.
[9]王金剛,杜寧娟.菊粉的工業(yè)化生產(chǎn)技術(shù)與發(fā)展前景[J].食品工業(yè)科技,2008,29(11):309-312.
[10]陸慧玲,胡飛.酶法提取菊糖工藝的研究[J].食品工業(yè)科技,2006,27(10):158-160.
[11]李雪雁,陳曉前,王玉麗.果膠酶浸提菊芋菊糖的研究[J].食品工業(yè)科技,2009,30(11):223-225.
[12]肖仔君,朱定和,王小紅,等.菊芋中菊粉提取工藝的研究[J].現(xiàn)代食品科技,2013,29(2):315-318.
[13]楊振,楊富民,王雪燕.菊苣中菊粉提取工藝優(yōu)化研究[J].甘肅農(nóng)業(yè)大學(xué)學(xué)報(bào),2009,44(5):147-151.
[14]何新華,劉玲,張靜,等.菊苣總糖和菊粉提取工藝條件優(yōu)化[J].食品研究與開發(fā),2009,30(8):76-79.
[15]高向陽.食品分析與檢測(cè)[M].北京:中國(guó)計(jì)量出版社,2006:130-135.
[16]孔濤,吳祥云.菊芋中菊糖提取及果糖制備研究進(jìn)展[J].食品工業(yè)科技,2013,34(18):375-378.
[17]Gaafar A M,Boudy E A,El-Gazar HH,et al.Extraction Conditions of Inulin from Jerusalem Artichoke Tubers and its Effects on Blood Glucose and Lipid Profile in Diabetic Rats[J]. Journal of American Science,2010,6(5):36-43.
[18]賀寅,王強(qiáng),鐘葵.響應(yīng)面優(yōu)化酶法提取龍眼多糖工藝[J].食品科學(xué),2009,32(2):79-83.
[19]易建華,朱振寶.響應(yīng)面優(yōu)化酶法提取芹菜黃酮工藝研究[J].食品科學(xué),2009,30(10):92-96.
[20]鐘丹,張建新,張世恒.超聲波提取牛蒡菊糖的工藝研究[J].西北農(nóng)業(yè)學(xué)報(bào),2008,17(2):297-300.
[21]胡建鋒,邱樹毅.菊芋中菊粉不同提取工藝比較研究[J].貴州農(nóng)業(yè)科學(xué),2009,37(10):181-183.
[22]曹澤虹,董玉瑋,苗敬芝,等.酶法提取牛蒡菊糖的研究[J].食品工程,2009(11):143-146.
Study on optim ization on com posite enzyme extraction process of inulin from Cichorium intybus L.by response surface design
ZHAIDan-yun,CHEN Xing-du,CHEN Qing-an,NIU Jie,F(xiàn)ENG Ping,ZHAO Li-li,YANG Xiao-li
(Gansu Institute of Business and Technology,Lanzhou 730010,China)
In this experiment,w ith chicory rootas a raw material,pectinase and cellulase com pound p reparations was used to extract inulin.Four extraction parameters inc luding the ratio of material and solvent,extraction tem perature,extraction time and extraction pH were op tim ized as the result of the conditions for maximum extraction of inulin from Cichorium intybus L.by Box-Behnken response surface design methodology based on the inulin extraction rate as a response value.Results showed that the op timum cond ition of inulin extraction was as follows the ratio of material and solvent 1∶8g/m L,extraction tem perature 60℃,extraction time 2.5h,extraction pH6.0,and the ratio of compound enzymes 1∶2.Under this cond ition inulin extraction rate was up to 54.63%.The extraction rate inc reased by 64.10%,com pared w ith the method of hotwater extrac tion.
chicory;inulin;pec tinase;cellulase;response surface design
TS201.1
A
1002-0306(2015)06-0190-05
10.13386/j.issn1002-0306.2015.06.034
2014-07-03
翟丹云(1964-),女,本科,高級(jí)工程師,注冊(cè)咨詢工程師,主要從事食品工程等相關(guān)方面的研究。
甘肅省技術(shù)研究與開發(fā)專項(xiàng)計(jì)劃(1207TCYA039);甘肅省科技廳科技支撐計(jì)劃(2011GS0408)。

