金納米棒聯合125I粒子誘導肝癌HepG2細胞凋亡的實驗研究
沈蕾,高斌,賀克武,肖衛華
金納米棒聯合125I粒子誘導肝癌HepG2細胞凋亡的實驗研究
沈蕾,高斌,賀克武,肖衛華
目的探討葉酸偶聯二氧化硅包覆的金納米棒(GNRs@SiO2-FA)聯合125I粒子誘導肝癌HepG2細胞凋亡及其可能的機制,為臨床提高肝癌125I粒子組織間植入療效提供理論依據。方法將體外培養的肝癌HepG2細胞隨機分成空白對照組,單純金納米棒組,單純125I粒子照射組及金納米棒聯合125I粒子照射組,采用流式細胞儀檢測細胞凋亡情況,PT-PCR檢測bax mRNA、bcl-2 mRNA表達水平,免疫細胞化學檢測凋亡相關基因bax、bcl-2表達水平及腫瘤細胞核增殖性抗原Ki67表達情況。結果流式細胞儀檢測4組肝癌HepG2細胞凋亡率,單純金納米棒組、單純125I粒子照射組較空白對照組均有升高(P<0.05);聯合組較單純金納米棒組和單純125I粒子照射組明顯升高,差異有統計學意義(P<0.05)。聯合組bax mRNA表達明顯高于單純金納米棒組與單純125I粒子照射組,bcl-2 mRNA表達明顯低于單純金納米棒組與單純125I粒子照射組。肝癌HepG2細胞bax表達于胞質,bcl-2表達于胞質和胞膜,Ki67表達于胞核,均表現為棕黃色細顆粒狀沉淀。4組肝癌HepG2細胞凋亡相關基因bax、bcl-2及增殖核抗原Ki67蛋白表達量比較,差異均有統計學意義(P<0.05);聯合組較單純金納米棒組和單純125I粒子照射組Bax蛋白陽性表達率明顯升高,Bcl-2、Ki67蛋白陽性表達率明顯降低,差異有統計學意義(P<0.05)。結論金納米棒與125I粒子聯合應用能更有效增加肝癌細胞凋亡率,其機制可能是通過增加Bax蛋白的表達,抑制Bcl-2蛋白的表達來實現。
金納米棒;125I粒子;肝癌;細胞凋亡;Bax;Bcl-2;Ki67
肝癌是常見的惡性腫瘤之一,全球發病率居第5位,死亡率居第3位[1]。我國是肝癌發病率最高的國家,占所有癌癥死亡的第2位,僅次于肺癌[2]。因此,如何提高患者的生存率是臨床工作者亟待攻克的難題。放射性125I粒子組織間植入近距離照射治療肝癌已經廣泛開展并顯示出良好療效,如CT引導下125I粒子組織間植入可誘導兔VX2腫瘤細胞凋亡[3]。金納米棒聯合放射性125I粒子對肝癌HepG2細胞的研究并不多見。本實驗以人肝癌HepG2細胞為研究對象,重點探討金納米棒聯合125I粒子對肝癌HepG2細胞凋亡及Bax、Bcl-2蛋白表達的影響,為腫瘤的聯合治療提供實驗依據,從而為肝癌的臨床治療開辟一條新路徑。
1 材料與方法
1.1試劑與儀器
肝癌HepG2細胞株(購自上海細胞庫)、DMEM培養基(Hyclone公司)、胎牛血清(四季青公司)、細胞凋亡試劑盒(貝博公司)、PCR相關試劑(Thermo公司)、bax抗體(Abcam公司)、bcl-2抗體(CST公司)、Ki67抗體(博士德公司)、DAB顯色試劑盒(中杉金橋)、流式細胞儀(FCM,BD公司)、細胞培養箱(Thermo公司)、紫外發光凝膠成像系統(天能公司)、125I粒子(欣科公司)。
1.2方法
1.2.1細胞培養HepG2細胞在37℃、體積分數為0.05的CO2條件下培養于含10%胎牛血清的DMEM培養基中。將實驗分為空白對照組、單純金納米棒組、單純125I粒子照射組、金納米棒聯合125I粒子照射組。空白對照組予正常培養;單純金納米棒組,給予終濃度為40 μg/ml的金納米棒;單純125I粒子照射組,距培養皿1 cm內給予9粒放射性活度為0.8 mCi的125I粒子照射;聯合組,同時給予金納米棒和125I粒子。倒置顯微鏡下觀察細胞生長狀態,照射48 h后收集細胞。
1.2.2FCM檢測細胞凋亡率取各組HepG2細胞,用0.25%胰酶消化,2 000 r/min,離心5 min,棄上清液。調整細胞密度為1×106/ml,冷PBS洗2遍。將細胞重懸于400 μl的Annexin V結合液中,加入10 μl Annexin V和5 μl PI染液,輕輕混勻,4℃避光反應15 min,上機檢測。實驗重復4次。
1.2.3RT-PCR檢測bax、bcl-2 mRNA表達收集各組細胞,提取RNA后進行RT-PCR。以GAPDH為內參。GAPDH上游引物:5'-AGAAGGCTGGGGCTCATTTG-3';下游引物:5'-AGGGGCCATCCACAGTCTTC-3',產物長度258 bp。bax上游引物:5'-GCCCACCAGCTCTGAGCAGATCAT-3';下游引物:5'-CGGCAATCATCCTCTGCAGC-3',產物長度209 bp。bcl-2上游引物:5'-GACTTCGCCGAGATGTCCAG-3';下游引物:5'-CAGGTGCCGGTTCAGGTACT-3',產物長度225 bp。將擴增產物行瓊脂糖凝膠電泳,紫外透射分析儀下觀察結果并拍照。
1.2.4細胞免疫化學法檢測bax、bcl-2、Ki67基因表達①制作細胞爬片:取對數生長期的HepG2細胞,消化離心后以密度為2×10/ml接種于事先放好蓋玻片的培養皿內,培養24 h。②處理方法:按上述分組方法干預細胞,48 h后處理細胞。③細胞免疫化學法:常規設立陰性對照。取出蓋玻片用4%多聚甲醛固定20 min,PBS洗5 min×3次;0.1%Triton× 100 4℃10 min,PBS洗5 min×3次;3%H2O2室溫孵10 min消除內源性H2O2酶的活性,PBS洗5 min× 3次;滴加血清封閉液,室溫濕盒內孵育30 min,封閉非特異性抗原;滴加抗體:傾去血清后直接滴加的一抗bax、bcl-2、Ki67(稀釋比例均為1∶100)使其完全覆蓋細胞,于4℃下過夜;PBS洗5 min×3次,加人生物素化羊抗兔IgG(1∶200),37℃,30 min,PBS洗5 min×3次;DAB顯色:每片滴加DAB 100 μl,顯微鏡下觀察3~5 min,至陽性顯色明顯時用自來水沖洗,終止顯色。復染:用蘇木精復染約10 s,自來水充分沖洗。70%、80%、90%、95%、100%梯度乙醇脫水。二甲苯透明、中性樹膠封片。
1.2.5IHC結果判定bax陽性表現為細胞質內棕黃色顆粒,bcl-2陽性表現為細胞質和細胞膜內棕黃色顆粒。①定量分析:在光學顯微鏡400倍視野下,每張切片隨機選取陽性細胞分布均勻的10個視野,計數200個細胞中的陽性細胞數并計分,<5%(0分),5%~25%(1分),25%~50%(2分),50%~75%(3分),>75%(4分)。②著色程度:陰性為未著色(0分),弱陽性呈淡黃色(1分),中等陽性呈黃色或深黃色(2分),強陽性呈褐色或棕褐色(3分)。以陽性細胞率和染色強度分值的乘積作為每一例的積分[4]。
Ki67陽性表現為細胞核內棕黃色細顆粒狀沉淀,每張切片觀察10個以上典型視野(高倍鏡下),至少計數200個細胞。以棕色核染為陽性細胞,其百分比為Ki-67細胞增殖指數(Ki-67 proliferation index,KI)。
1.3統計學分析
所有數據資料采用SPSS13.0軟件進行統計處理,以均數±標準差表示。多組間比較用方差分析,兩兩比較采用q檢驗,以P<0.05為差異有統計學意義。
2 結果
2.1FCM檢測細胞凋亡率
4組肝癌HepG2細胞凋亡率比較,差異有統計學意義(P<0.05);單純金納米棒組、單純125I粒子照射組及聯合組肝癌HepG2細胞凋亡率較空白對照組明顯升高,差異均有統計學意義(P<0.05);聯合組肝癌HepG2細胞凋亡率較單純金納米棒組和單純125I粒子照射組明顯升高,差異均有統計學意義(P<0.05)。見表1、圖1。
表1 4組肝癌HepG2細胞凋亡率比較(±s)
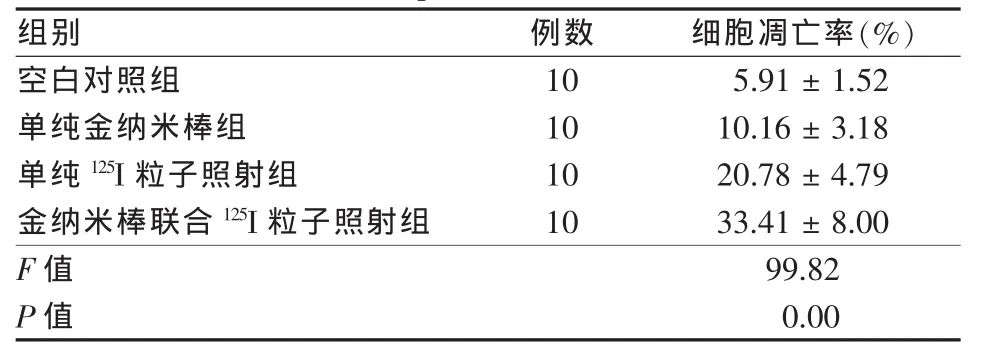
表1 4組肝癌HepG2細胞凋亡率比較(±s)
組別例數細胞凋亡率(%)空白對照組105.91±1.52單純金納米棒組1010.16±3.18單純125I粒子照射組1020.78±4.79金納米棒聯合125I粒子照射組1033.41±8.00 F值99.82 P值0.00
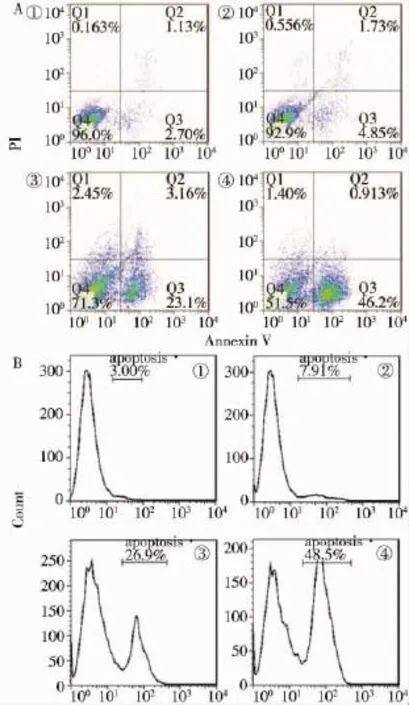
圖1 FCM檢測各組細胞凋亡情況(A和B)
2.2RT-PCR檢測bax、bcl-2 mRNA表達
單純金納米棒組與單純125I粒子照射組的bax mRNA表達均高于空白對照組,聯合組bax mRNA表達明顯高于單純金納米棒組和單純125I粒子照射組。金納米棒組與單純125I粒子照射組的bcl-2 mRNA表達均低于空白對照組,聯合組bcl-2 mRNA表達明顯低于單純金納米棒組和單純125I粒子照射組。提示金納米棒與射線作用于肝癌HepG2細胞后bax mRNA的表達量增加,bcl-2 mRNA的表達量減低。見圖2。
2.3Bax、Bc1-2、Ki67蛋白在肝癌HepG2細胞中的表達
2.3.1Bax蛋白在肝癌HepG2細胞中的表達空白對照組、單純金納米棒組、單純125I粒子照射組和聯合組染色陽性的HepG2細胞Bax蛋白陽性表達積分分別為0.95±0.18、1.51±0.44、4.29±0.86、7.55±1.40。聯合組與單純金納米棒組和單純125I粒子照射組比較,Bax蛋白表達增加更明顯,差異有統計學意義(P<0.05)。
2.3.2Bc1-2蛋白在肝癌HepG2細胞中的表達空白對照組、單純金納米棒組、單純125I粒子照射組和聯合組染色陽性的HepG2細胞Bcl-2蛋白陽性表達積分依次為9.01±1.02、8.39±0.47、3.81±1.28、1.70±0.83。聯合組與單純金納米棒組和單純125I粒子照射組比較,Bc1-2蛋白表達降低更明顯,差異有統計學意義(P<0.05)。
2.3.3IHC檢測HepG2細胞增殖相關抗原Ki67表達空白對照組細胞形態飽滿,多數細胞核被染成棕黃色;聯合組Ki67表達強度較單純125I粒子照射組和單純金納米棒組明顯減弱,細胞核呈淡染。4組KI之間差異有統計學意義(P<0.05)。見表2,圖3、4。
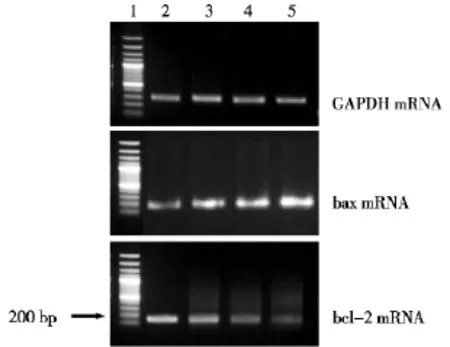
圖2 RT-PCR檢測金納米棒聯合125I粒子照射作用于肝癌HepG2細胞后bax、bcl-2、GAPDH mRNA表達
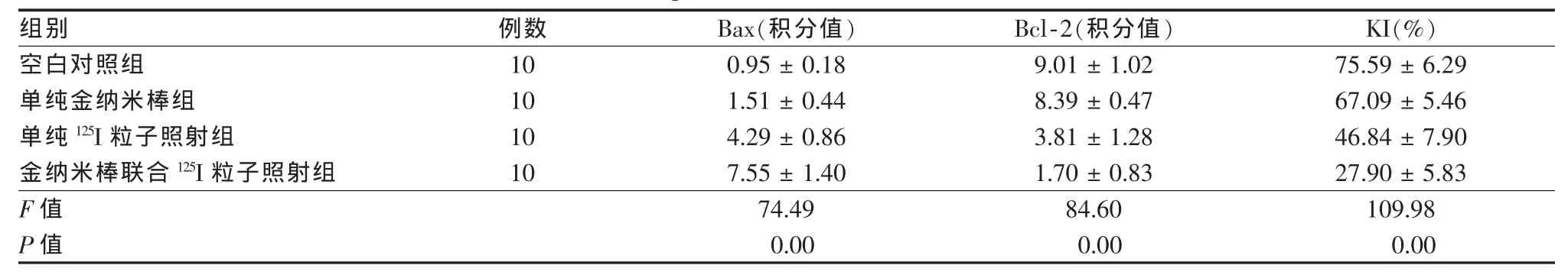
表2 4組肝癌HepG2細胞Bax、Bcl-2、KI蛋白表達情況
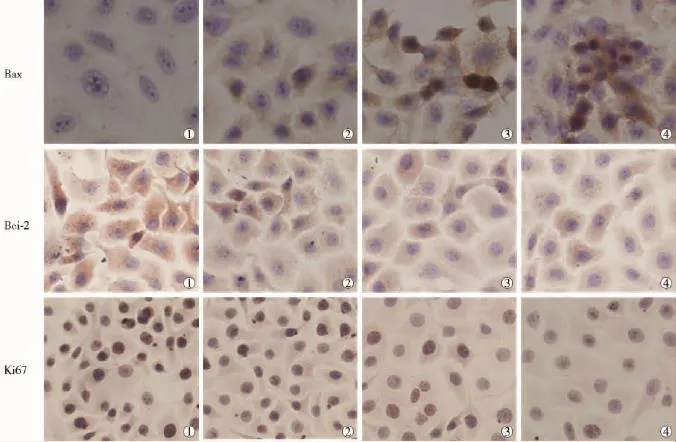
圖3 各組肝癌HepG2細胞Bax、Bcl-2、KI蛋白表達情況(SP×400)

圖4 各組肝癌HepG2細胞Bax、Bcl-2、KI蛋白表達情況
3 討論
目前,肝癌多采用綜合治療的手段,手術、放療、熱療等多種方法聯合應用對抗腫瘤起到協同作用[5-6]。外放療作為肝癌治療的常規手段,由于正常肝臟組織對放射線的耐受量限制了肝癌照射量的提升,因此肝癌外放療效果欠佳。125I粒子植入近距離治療不同于外放療,125I粒子具有在組織局部劑量最高、近籽源處劑量較高、周圍組織劑量陡降等特性,經過足夠的劑量和半衰期持續殺傷腫瘤細胞,使腫瘤組織損傷較為徹底。但125I粒子植入屬于人工操作,難免存在冷點[7],通過放射增敏的辦法,旨在達到完全適形放射治療。
本實驗采用的金納米棒可作為放射治療領域中一類新型的放射增敏劑[8],其機制主要是金納米棒中的金元素具有高的原子序數[9-10],且金納米棒的尺寸遠大于金原子,其光電吸收截面積遠超越金原子[11],都致使其在腫瘤組織內產生較周圍正常組織強的光電吸收效應。另外,金納米棒表面等離子共振特性即當光入射時在特定波長范圍內具有強的光吸收能力,增強的光吸收量也可有效增強腫瘤組織的吸收劑量。金納米棒聯合射線照射后則產生更強的光電吸收效應,加速DNA鏈斷裂,最終導致細胞死亡[12]。
細胞凋亡是一種多基因參與的調控機制,凋亡基因與抗凋亡基因的相互協調作用決定了凋亡的啟動或抑制。目前研究最深入的一對細胞凋亡調節基因是bax和bcl-2[13]。bax基因最早是在人前B細胞基因庫中發現,其產物主要定位于胞質中,具有拮抗Bcl-2蛋白的作用,還有直接促進細胞凋亡的功能。bcl-2基因最初是在濾泡性B細胞淋巴瘤的研究中發現,其產物主要定位于胞膜,具有抑制凋亡蛋白的功能。大量研究顯示,bax/bcl-2比值決定細胞的生或死,bax/bcl-2升高,細胞接受凋亡信號刺激發生凋亡;bax/bcl-2降低細胞不凋亡[14]。有學者采用香芹酚、苦參堿等藥物誘導人肝癌細胞凋亡的體外研究,通過線粒體途徑上調Bax蛋白、下調Bcl-2蛋白表達水平,升高bax/bcl-2比值來治療肝癌[15-16]。Ki67是一種與細胞周期相關的增殖核抗原,可作為肝癌治愈率和總生存率的獨立預后指標[17],Ki67表達減少表明腫瘤細胞增殖受到抑制。
本研究結果表明,單純金納米棒組、單純125I粒子照射組、金納米棒聯合125I粒子照射組與空白對照組相比,肝癌HepG2細胞Bax表達增加,Bcl-2、Ki67表達降低,說明金納米棒與125I粒子二者單獨或聯合應用時均能增加肝癌HepG2細胞Bax的表達同時降低Bcl-2、Ki67的表達。金納米棒聯合125I粒子照射組與125I粒子照射組相比,Bax表達增加更顯著,Bcl-2、Ki67表達降低更顯著。
綜上所述,在體外實驗中證實金納米棒聯合125I粒子具有明顯的協同抗腫瘤效果,目前國內外對金納米棒聯合125I粒子的研究尚不多見。本實驗在分子水平上為金納米棒聯合125I粒子治療肝癌提供了實驗依據,但其明確的生物學機制尚待更深入研究。
[1]Pakin DM,Bray F,Ferlay J,et al.Estimating the world cancer burden:Globocan 2002[J].CA Cancer J Clin,2005,55:74-75.
[2]葉勝龍.2013年肝癌領域新進展[J].中華肝臟病雜志,2014,22:2-4.
[3]賀克武,高斌,李嘉嘉.CT導引下125I粒子組織間植入治療兔VX2腫瘤的實驗研究[J].介入放射學雜志,2008,17:428-431.
[4]Lo Muzio L,Staibano S,Pannone G,et al.Expression of theapoptosisinhibitorsurvivinginaggressivesquamous cellcarcinoma[J].Exp Mol Pathol,2001,70:249-254.
[5]Ko SH,Ueno T,Yoshimoto Y,et al.Optimizing a novel regional chemotherapeutic agent against melanoma:hyperthermia-induced enhancement of temozolomide cytotoxicity[J].Clin Cancer Res,2006,12:289-297.
[6]儲玉山,朱小慶,張玉宇,等.索拉非尼聯合奧沙利鉑對肝癌HepG2細胞的抑制作用[J].介入放射學雜志,2011,20:810-814.
[7]Skowronek J.Low-dose-rate or high-dose-rate bra-chytherapy in treatment of prostate cancer-between options[J].J Contemp Brachytherapy,2013,5:33-41.
[8]Gui C,Cui DX.Functionalized Gold nanorods for tumor imaging and targeted therapy[J].Cancer Biol Med,2012,9:221-233.
[9]Roeske JC,Nunez L,Hoggarth M,et al.Characterization of the theorectical radiation dose enhancement from nanoparticles[J]. Technol Cancer Res Treat,2007,6:395-401.
[10]Cho SH,Jones BL,Krishnan S.The dosimetric feasibility of Gold nanoparticle-aided radiation therapy(GNRT)via brachytherapy using low-energy gamma-/x-ray sources[J].Phys Med Biol,2009,54:4889-4905.
[11]Park YS,Kasuya A,Dmytruk A,et al.Concentrated colloids of silica-encapsulatedGoldnanoparticles:colloidalstability,cytotoxicity,and X-ray absorption[J].J Nanosci Nanotechnol,2007,7:2690-2695.
[12]Conde J,Doria G,Baptista P.Noble metal nanoparticles applications in cancer[J].J Drug Deliv,2012:751075.
[13]Cory S,Adams JM.Killing cancer cells by flipping the Bcl-2/ Bax Switch[J].Cancer Cell,2005,8:5-6.
[14]Stefanaki C,Antoniou C,Stefanaki K,et al.Bcl-2 and Bax in congenital naevi[J].Br J Dermatol,2006,154:1175-1179.
[15]Yin QH,Yan FX,Zu XY,et al.Anti-proliferative and proapoptotic effect of carvacrol on human hepatocellular carcinoma cell line HepG-2[J].Cytotechnology,2012,64:43-51.
[16]Liang CZ,Zhang JK,Shi Z,et al.Matrine induces caspasedependent apoptosis in human osteosarcoma cells in vitro and in vivothroughtheupregulationofBaxandFas/FasLand downregulation of Bcl-2[J].Cancer Chemother Pharmacol,2012,69:317-331.
[17]Stroescu C,Dragnea A,Ivanov B,et al.Expression of p53,Bcl-2,VEGF,Ki67 and PCNA and prognostic significance in hepatocellular carcinoma[J].J Gastrointestin Liver Dis,2008,17: 411-417.
Apoptosis of hepatoma cell line HepG2induced by the combination use of GNRs@SiO2-FA and125Iseeds:an experimental study
SHEN Lei,GAO Bin,HE Ke-wu,XIAO Wei-hua.Medical Imaging Center,Third Affiliated Hospital,Anhui Medical University,Hefei,Anhui Province 230061,China
GAO Bin,E-mail:gaobin_3136@163.com
ObjectiveTo explore the possible mechanism of the apoptosis of hepatoma cell line HepG2induced by the combination use of GNRs@SiO2-FA and125I seeds and to discuss its relationship with Bcl-2 and Bax protein expressions so as to provide theoretical basis for clinical treatment of hepatic cancer with interstitial brachytherapy by using125I seeds.MethodsIn vitro cultured HepG2cells were randomly divided into 4 groups:blank control group(not treated),simple GNRs@SiO2-FA group,simple125I seeds group,and combination group(GNRs@SiO2-FA plus125I seeds).The apoptosis of HepG2cells was determined by flow cytometry.The expression of Bax mRNA and Bcl-2 mRNA of HepG2cells were tested by RT-PCR. The apoptosis-related genes(Bax and Bcl-2)and the tumor proliferation cell nuclear antigen(Ki67)proteins expression on HepG2cells were examined with immunohistochemistry method.ResultsThe flow cytometry examination showed that the apoptosis rate of HepG2cells in the simple GNRs@SiO2-FA group and simple125I seeds group was higher than that in blank control group(P<0.05),and the apoptosis rate of the combination group was significantly higher than that of the simple GNRs@SiO2-FA group and the simple125I seeds group(P<0.05).The expression level of Bax mRNA in the combination group was higher than that in the simpleGNRs@SiO2-FA group and simple125I seeds group,while the expression level of Bcl-2 mRNA in the combination group was obviously lower than that in the simple GNRs@SiO2-FA group and simple125I seeds group.Bax protein was expressed on cytoplasm,Bcl-2 protein was expressed on cytoplasm and cell membrane,while Ki67 protein was expressed on nucleus.All of them presented as brown finely granular precipitations.Statistically significant differences in the amount of Bax,Bcl-2 and Ki67 protein expression existed between each other among the four groups(P<0.05).The positive expression rate of Bax protein in the combination group was significantly higher than that of the simple GNRs@SiO2-FA group and the simple125I seeds group,while the positive expression rate of Bcl-2 and Ki67 protein was significantly lower than that of the simple GNRs@SiO2-FA group and the simple125I seeds group,and the differences were statistically significant(P<0.05).ConclusionThe combination use of GNRs@SiO2-FA and125I seeds can more effectively induce the apoptosis of HepG2cells.This effect may be accomplished through increasing the expression of Bax protein and inhibiting the expression of Bcl-2 and Ki67 proteins.(J Intervent Radiol,2015,24:236-241)
gold nanorod;125I seed;hepatocarcinoma;apoptosis;Bax;Bcl-2;Ki67
R735.7
A
1008-794X(2015)-03-0236-06
2014-09-05)
(本文編輯:李欣)
10.3969/j.issn.1008-794X.2015.03.013
國家自然科學基金資助項目(81071240)
230061合肥安徽醫科大學第三附屬醫院影像中心(沈蕾、高斌、賀克武);中國科技大學生命科學院(肖衛華)
高斌E-mail:gaobin_3136@163.com

