三次肝移植1例報告
王振,李世朋,張建軍(.天津醫科大學一中心臨床學院,天津 3009;.天津市第一中心醫院東方器官移植中心,天津 3009)
肝移植是目前治療終末期肝病最有效的方法,但肝移植術后患者會因膽道并發癥、肝癌復發、移植肝功能喪失等原因需再次進行肝移植。而3次肝移植臨床病例較為少見。
本研究回顧性分析了1例2009年12月至2012年5月在天津市第一中心醫院先后接受3次肝移植術患者的臨床資料,探討3次肝移植術的技巧和療效。
1 病例報告
患者入院7天前無誘因嘔吐咖啡色胃內容物500 ml,無黑便,無頭暈,無腹痛,未救治。4天前再次嘔吐咖啡色胃內容物600 ml,黑便1次,未救治。入院2天前無誘因突然嘔吐大量鮮血約1 500 ml,伴頭暈、四肢濕冷。急診先后輸全血400 ml,紅細胞400 ml,血漿200 ml。胃鏡顯示患者食管靜脈曲張,CT示肝臟硬化、大量腹腔積液。患者于2009年12月17日在全麻下行原位肝移植術,術后早期膽汁量少,考慮缺血/再灌注損傷,肝功逐漸恢復,術后14天膽道造影吻合口無膽瘺,關閉T管,患者術中門靜脈取栓,術后給予華法林抗凝。患者恢復順利,FK藥物濃度穩定,肝功能恢復正常后出院。患者2010年2月3日因肝功能異常歸院復查,調整免疫抑制方案后病情有所好轉。2010年3月15日開放膽道引流后見膽汁內大量絮狀物,膽道造影見膽道顯影不完全,大量膽泥沉積,更換T管為16Fr引流管,此后持續引流(膽汁內大量絮狀物,涂片見白細胞),先后使用豐迪、舒普深、他格適抗感染治療,膽汁性狀好轉,4月2日行膽道鏡清理膽道內膽泥。2010年9月13日患者肝功能指標仍持續異常,9月17日膽道支撐管脫出,重新留置膽道支撐管分別于左肝管、右肝管及受體側膽道內,術后發熱,給予舒普深抗感染治療。患者因肝移植術后膽道非吻合口狹窄,于2010年11月26日在全麻下行第2次原位肝移植術。術后肝功能恢復順利,術后2周出現發熱,考慮膽道感染,給予廣譜抗生素治療。術后1個月行膽道造影檢查,結果提示移植肝膽道纖細,排空略延遲,更換T管為6Fr引流管,造影后1天出現體溫高熱,給予特治星抗感染治療。2011年1月11日復查肝功能異常,超聲提示肝門靜脈吻合口纖細狹窄,腹部CT證實,行球囊擴張并內支架成形術,術后給予肝素、華法林預防門靜脈血栓形成。2011年8月28日患者因“2次肝移植術后9個月,膽道吻合口狹窄7個月”入院復查,入院后完善各項化驗檢查,診斷明確,膽紅素水平持續升高,經膽道造影見膽道多發狹窄、閉塞、消失,右側肝管幾乎無分支,左側肝管遠端少量擴張分支。2012年4月27日行膽道造影,重新留置膽道引流管,通過膽道引流穩定患者情況。2012年5月26日患者在全麻下行第3次原位肝移植術,術程順利,術后肝功能逐漸恢復,給予他克莫司(FK506)+嗎替麥考酚酯(MMF)+激素三聯免疫抑制,免疫抑制劑濃度穩定,B超監測移植肝血流正常,術后2周常規行膽道造影檢查,未見特殊異常,予以關閉,無發熱、腹痛等不適反應,術后3周傷口拆線,愈合良好,無感染裂開。患者第3次肝移植術后血生化指標變化情況詳見表1。
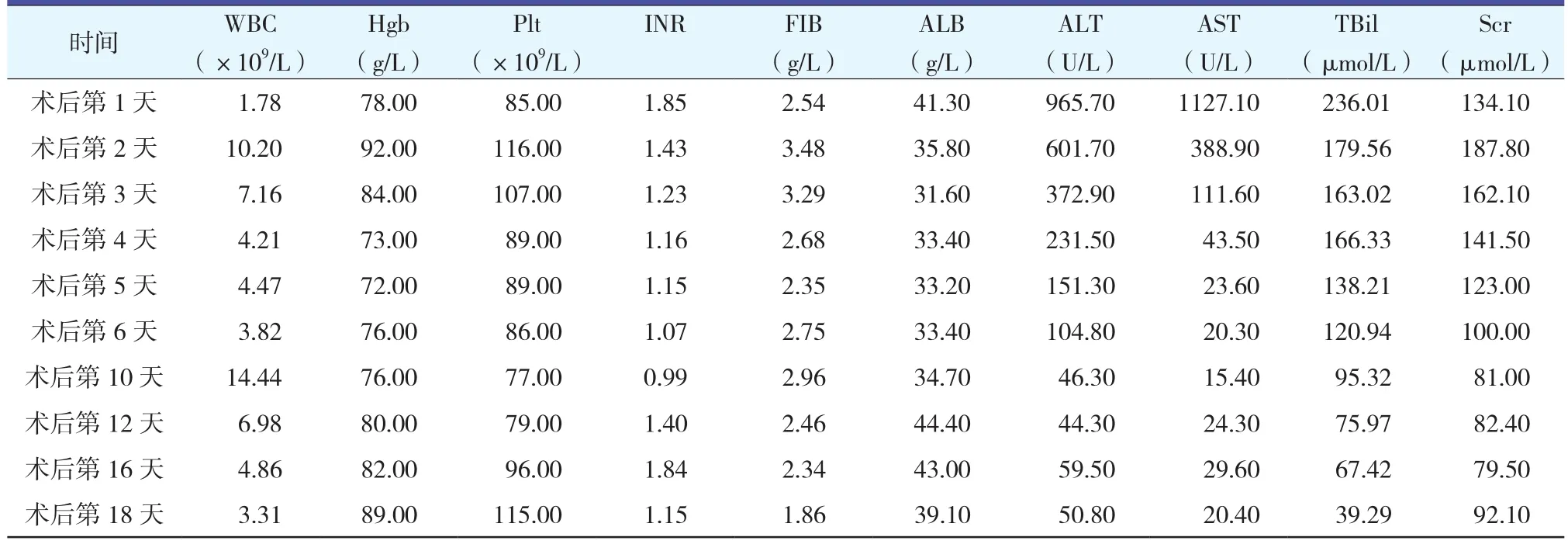
表1 患者第3次肝移植術后血生化指標變化情況
2 討 論
隨著醫療技術的發展,終末期肝病患者可以接受多次肝移植。國外文獻報道,再次肝移植率為10%~20%,再次移植次數最多者為5次[1-2];國內3次肝移植僅在3篇文獻中被報道[3-5]。第3次肝移植適應證主要為膽道并發癥、原發病復發及慢性排斥反應[6]。本例患者行第3次肝移植原因為膽道并發癥。患者因已行2次肝移植,在進行第3次肝移植時,腹腔內黏連情況已十分嚴重,手術非常困難,手術時間和出血量較第1、2次肝移植明顯增加[7-8]。本例患者第1、2、3次肝移植手術時間分別為9小時、13小時30分鐘、14小時30分鐘;3次肝移植術中出血量分別為1 000 ml、2 000 ml、3 000 ml。因此,術中操作必須仔細,使用銳性分離,避免損傷血管及周圍重要結構,盡可能減少術中出血、輸血[9-11]。術前應盡量改善患者的一般狀況,選擇合適的手術時機并制定合理的免疫抑制劑方案,必要時可預防性進行抗感染治療,術中選擇正確的手術方式及血管、膽道吻合方式,將會大大提高3次肝移植手術成功率。

