重組人干擾素β-1a注射液對大鼠肝纖維化模型的治療作用
王 妍,林孝發,張微微,韋 康,王中漢,田建明*
(1.深圳職業技術學院,廣東深圳518044;2.吉林省中醫藥科學院,長春130021;
3.吉林大學第二臨床醫院,長春130041)
重組人干擾素β-1a注射液對大鼠肝纖維化模型的治療作用
王 妍1,林孝發1,張微微2,韋 康2,王中漢3,田建明2*
(1.深圳職業技術學院,廣東深圳518044;2.吉林省中醫藥科學院,長春130021;
3.吉林大學第二臨床醫院,長春130041)
目的 研究重組人干擾素β-1a注射液及白蛋白注射液對肝纖維化大鼠的治療作用。方法 通過給大鼠灌服50%的四氯化碳花生油溶液1 mL/kg,每周2~3次,5周后開始使用受試藥物(隔日注射1次),同時繼續同上灌服50%的四氯化碳花生油溶液。9周后取血、取肝臟,測定血清ALT、AST、TP、ALB、TBIL,測定肝組織羥脯氨酸含量,并對肝臟做病理組織學檢查。結果 干擾素β-1a、白蛋白注射液均能明顯降低肝纖維化模型大鼠血清的ALT、AST、TBIL,能明顯升高肝纖維化大鼠血清ALB、ALB/GLB,且能明顯降低肝纖維化大鼠肝組織羥脯氨酸含量。結論 干擾素β-1a、白蛋白注射液對肝纖維化模型大鼠的肝纖維化程度均有明顯的抑制作用。
重組人干擾素β-1a注射液;白蛋白注射液;大鼠肝纖維化模型
肝纖維化是指由各種致病因子所致肝內結締組織異常增生,導致肝內彌漫性細胞外基質過度沉淀的病理過程,如病毒性肝炎,酒精性肝炎及一些自身免疫疾病都可發展導致肝纖維化[1]。目前臨床對于肝纖維化的治療主要是針對原發疾病的處理以及一些護肝、抑制炎性增生的治療措施,而具體對于抗纖維化的治療仍是缺乏的。在80年代早期,Tacobs最早開始人干擾素方面的研究,至今已取得了飛躍性的發展。現在β-la和β-1b干擾素(IFN)均已在全世界范圍內用于多發性硬化(MS)復發及緩解期的治療,并取得了滿意的療效[2-4]。本項目組曾報道[5]重組人干擾素β-1a對BALB/C小鼠硬化癥的療效評價,證實重組人干擾素β-1a對小鼠硬化癥模型有明顯的改善作用,本文繼續就本院自主研發的重組人干擾素β-1a及白蛋白注射液在治療大鼠肝纖維化的機制方面做進一步的探討。報道如下。
1 實驗材料
1.1 動物 Wistar大鼠80只,雄性,體質量100~120 g,購自遼寧長生生物技術有限公司,許可證號:SCXK(遼)2010-0001。
1.2 受試藥物 重組人干擾素β-1a注射液(簡稱β-1a),濃度0.22 mg/mL,活性3.2×106IU/mL,批號20140701,深圳職業技術學院提供;白蛋白注射液,濃度0.17 g/mL,批號20140801,深圳職業技術學院提供;利比(進口重組人干擾素β-1a注射液),規格:22 μg/0.5 mL,產品批號:BA003059,由默克雪蘭諾公司意大利藥廠提供。
1.3 試劑 苯巴比妥,分析純,含量≥99% ,天津化學試劑三廠,生產批號:20140518;谷丙轉氨酶(ALT)試劑盒,深圳邁瑞醫療電子股份有限公司,批號140114032;谷草轉氨酶(AST)試劑盒,深圳邁瑞醫療電子股份有限公司,批號140214024;總膽紅素(TBIL)試劑盒,深圳邁瑞醫療電子股份有限公司,批號140215004;總蛋白(TP)試劑盒,深圳邁瑞醫療電子股份有限公司,批號140813021;白蛋白(ALB)試劑盒,深圳邁瑞醫療電子股份有限公司,批號140914018;羥脯氨酸測定試劑盒:由南京建成生物工程研究所提供;規格:50T/48樣,生產批號20141219,有效期至20150618。
1.4 儀器 迪瑞CS-600B全自動生化分析儀;GFD800型半自動生化分析儀,山東高密彩虹分析儀器有限公司。
2 方法
2.1 肝纖維化模型制備[6-8]取Wistar雄性大鼠80只,將造模大鼠先自由飲用35 mg/dL的苯巴比妥溶液,2周后灌胃給予50%的四氯化碳花生油溶液1.0~1.2 mL/kg體質量,每周2~3次,共9周。
2.2 分組 在灌胃給予50%的四氯化碳造模的第5周,將造模大鼠分成5組:模型組、陽性藥利比組、白蛋白注射液組、β-1a干擾素低、高劑量組,另一組為正常對照組。
2.3 劑量設計 陽性對照藥利比,22 μg/0.5 mL,臨床用量1~4周內22 μg/人,即0.314 3 μg/kg(人均體質量按70 kg計),折算成大鼠的劑量為2.05 μg/kg(5.6×105IU/kg);β-1a大鼠的低、高劑量分別為5.6、11.2×105IU/kg;陽性對照藥白蛋白注射液,濃度為0.17 mg/mL,按1 mL/kg的容積給藥,劑量為0.17 mg/kg。2.4 給藥途徑及頻次 途徑:造模的第5周開始,各組按上述劑量分別注射各受試藥物(干擾素β-1a皮下注射、白蛋白腹腔注射、利比皮下注射),隔日1次,共計給藥5周。給予受試藥期間仍然繼續按前述劑量灌胃給予50%的四氯化碳,直到試驗結束。
2.5 取材 末次給藥后24 h,6%水合氯醛麻醉,腹主動脈取血,3 000 r/min離心5 min,取血清備用;取肝組織稱重;取肝組織約80 mg備用;再取肝組織(一個肝葉),置10%福爾馬林溶液中固定備用。
2.6 檢測指標
2.6.1 血清生化指標 血清谷丙轉氨酶(ALT)、谷草轉氨酶(AST)、總蛋白(TP)、白蛋白(ALB)、總膽紅素(TBIL)。
2.6.2 肝組織羥脯氨酸含量 方法:取80 mg左右的肝組織,按照羥脯氨酸試劑盒說明書Ⅵ(樣本減水解法)進行操作及計算含量。
2.6.3 病理組織學檢查 取肝用10%的福爾馬林溶液固定,常規石蠟包埋,切片,HE染色,進行病理組織學檢查,照相。
3 結果
3.1 對肝纖維化大鼠體質量及肝臟臟體系數的影響見表1。
表1 干擾素β-1a、白蛋白對肝纖維化大鼠體質量及肝臟臟體系數的影響(±s)

表1 干擾素β-1a、白蛋白對肝纖維化大鼠體質量及肝臟臟體系數的影響(±s)
注:與正常組比較 ,###P<0.001;與模型組比較 ,△P<0.05
臟體系數正常對照組 12 574.9±41.46 13.57±1.02 2.37±0.17模型組 14 439.6±43.97### 14.91±2.93 3.38±0.53###β-1a 5.6×105IU/kg組 13 459.0±34.93 15.33±1.81 3.35±0.43 β-1a 11.2×105IU/kg組 12 490.4±47.03△ 15.58±2.25 3.19±0.47白蛋白0.17 mg/kg組 13 463.0±42.92 13.39±2.68 2.99±0.42△利比5.6×105IU/kg組 11 459.5±31.16 14.35±2.15 3.12±0.39組 別 n 體質量/g 肝臟重/g
3.2 對肝纖維化大鼠血清生化指標的影響見表2。
表2 干擾素β-1a對肝纖維化大鼠血清生化指標的影響(±s)
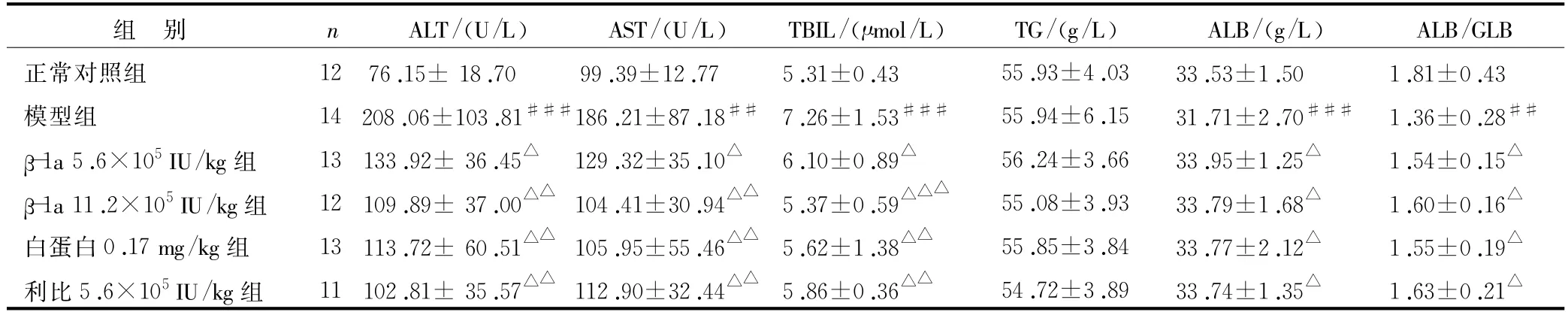
表2 干擾素β-1a對肝纖維化大鼠血清生化指標的影響(±s)
注:與正常組比較,##P<0.01,###P<0.001;與模型組比較,△P<0.05,△△P<0.01,△△△P<0.001
GLB正常對照組 12 76.15±18.70 99.39±12.77 5.31±0.43 55.93±4.03 33.53±1.50 1.81±0.43模型組 14 208.06±103.81###186.21±87.18## 7.26±1.53### 55.94±6.15 31.71±2.70### 1.36±0.28##β-1a 5.6×105IU/kg組 13 133.92±36.45△129.32±35.10△ 6.10±0.89△ 56.24±3.66 33.95±1.25△ 1.54±0.15△β-1a 11.2×105IU/kg組 12 109.89±37.00△△104.41±30.94△△ 5.37±0.59△△△ 55.08±3.93 33.79±1.68△ 1.60±0.16△白蛋白0.17 mg/kg組 13 113.72±60.51△△105.95±55.46△△ 5.62±1.38△△ 55.85±3.84 33.77±2.12△ 1.55±0.19△利比5.6×105IU/kg組 11 102.81±35.57△△112.90±32.44△△ 5.86±0.36△△ 54.72±3.89 33.74±1.35△ 1.63±0.21組 別 n ALT/(U/L) AST/(U/L) TBIL/(μmol/L) TG/(g/L) ALB/(g/L) ALB/△
3.3 對肝組織羥脯氨酸含量的影響 見表3。
3.4 病理組織學檢查 病理形態觀察結果判定。纖維化程度分期[9]:0期,無纖維化;1期,匯管區擴大,輕度纖維化;2期,匯管區周圍纖維化,纖維隔形成,小葉結構保留;3期,纖維隔伴小葉結構紊亂,無肝硬化;4期,早期肝硬化。光鏡下閱片,觀察組織病理學改變,對評分數據進行統計分析。結果,正常組12只全部為0期;模型組有2只為3期、12只為4期;β-1a干擾素5.6×105IU/kg組有4只為2期、3只為3期、6只為4期;β-1a干擾素11.2×105IU/kg組有1只為2期、3只為2期、4只為3期、4只為4期;白蛋白組有1只為2期、7只為3期、5只為4期;利比組有3只為2期、3只為3期、5只為4期。
表3 干擾素β-1a對肝纖維化大鼠肝組織羥脯氨酸含量的影響(±s) μg/mg
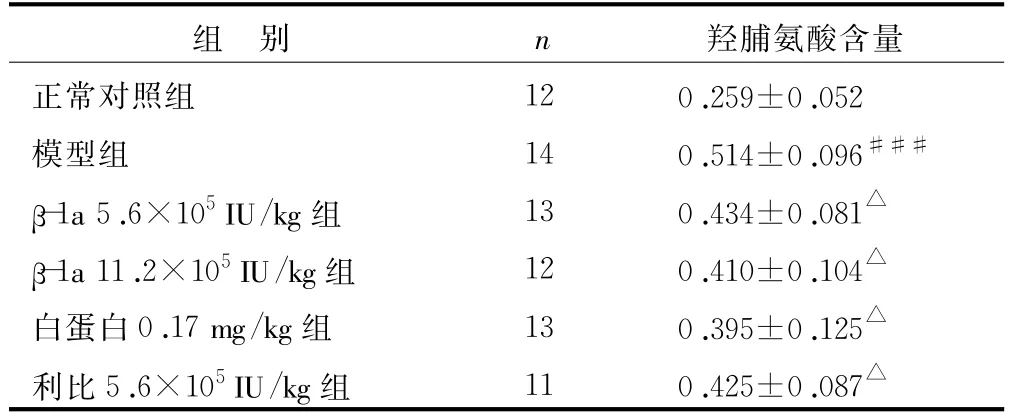
表3 干擾素β-1a對肝纖維化大鼠肝組織羥脯氨酸含量的影響(±s) μg/mg
注:與正常組比較 ,###P<0.001;與模型組比較 ,△P<0.05
羥脯氨酸含量正常對照組 12 0.259±0.052模型組 14 0.514±0.096###β-1a 5.6×105IU/kg組 13 0.434±0.081△β-1a 11.2×105IU/kg組 12 0.410±0.104△白蛋白0.17 mg/kg組 13 0.395±0.125△利比5.6×105IU/kg組 11 0.425±0.087組 別 n△
4 討論
正常時肝的纖維組織形成和降解保持動態的平衡。如果在各種致病因子的作用下,纖維組織形成增多而降解減少則可導致肝纖維化[10-11]。本試驗動物肝臟病理形態學觀察結果統計表明,大鼠口服CCl4可造成肝纖維化及早期肝硬化,注射受試藥物β-1a干擾素、利比及白蛋白進行干預治療后,肝纖維化程度均有不同程度的明顯減輕。
肝纖維化后,肝細胞受損,肝臟合成蛋白質水平下降,導致器官發育受阻,導致體質量減輕,而由于肝纖維化時肝臟內成纖維細胞分泌大量膠原纖維,可致肝臟重量增加[12]。表1所示,經受試藥干預后,體質量下降、臟體系數升高均有一定改善,其中β-1a高劑量組體質量明顯高于模型組,白蛋白組肝臟臟體系數明顯低于模型組。
肝臟是體內多種生化反應的主要場所,當其受到損傷引發病理性病變時,可引起ALT、AST、TBIL、TG等血清學指標的變化[13]。表2所示,經受試藥干預后ALT、AST、TBIL與模型組比較明顯下降,ALB、ALB/GLB與模型組比較明顯升高。
由于羥脯氨酸為膠原纖維所特有,故測定組織羥脯氨酸的含量,可間接換算出膠原蛋白的含量,以判斷肝纖維化程度[14],據此也可以判斷治療效果。表3所示,各受試藥物均能明顯降低肝硬化小鼠肝內羥脯氨酸的含量,降低膠原蛋白的含量,使肝組織膠原纖維化程度明顯減輕。由于蛋白質類藥物具有高活性、特異性強、低毒等特點,所以近年來治療肝纖維化的蛋白質藥物有了很大發展,但很多該類藥物還停留在實驗研究階段[15]。
本研究證實,干擾素β-1a、白蛋白注射液能抑制肝纖維化大鼠肝內成纖維細胞合成膠原纖維的功能 ,使肝內細胞外基質積聚減少,有效延緩肝纖維化進程,改善肝功能。本研究對肝纖維化從宏觀水平深入到細胞、分子水平進行了研究,闡述了干擾素β-1a、白蛋白注射液預防性治療大鼠肝纖維化的效果和機理 ,證實干擾素β-1a、白蛋白注射液能有效地治療四氯化碳誘導的肝纖維化,具有廣闊的開發前景。
[1]吳曉寧,尤紅.抗肝纖維化的治療策略[J].現代消化及介入診療,2012,17(4):220-223.
[2]阮春云,曾秋明,張怡,等.干擾素β-1b對多發性硬化患者生活質量影響的1年隨訪[J].國際神經病學神經外科學雜志,2014,41(3):216-220.
[3]賀電,李婭 ,徐竹,等 .干擾素-β治療復發-緩解型多發性硬化系統評價[J].中國現代神經疾病雜志,2014,14(9):775-788.
[4]邵清,張健 ,李梵,等.聚乙二醇干擾素α-2a聯合利巴韋林治療慢性丙型肝炎對肝纖維化的影響[J].傳染病信息,2013,26(3):152-154.
[5]張麗君,張英,陳獻雄,等.重組人干擾素β-1a對BALB/C小鼠硬化癥的療效評價[J].中國新藥與臨床雜志 ,2014,33(9):677-682.
[6]徐叔云.藥理實驗方法學[M].3版 .北京:人民衛生出版社,2002:1350-1351.
[7]那坤,武亮,李瀅,等.大鼠肝纖維化實驗動物模型的建立方法[J].中國中醫基礎醫學雜志,2015,21(3):272-274.
[8]馮英巧,楊元生,崔淑蘭,等.肝纖維化實驗動物模型造模方法及應用研究進展[J].廣東藥學院學報,2013,29(5):570-574.
[9]韋坤,王興華,張海清,等.肝纖維化指數評價實驗兔肝纖維化程度的研究[J].中國中西醫結合影像學雜志,2014,12(3):272-274.
[10]袁曉棟.肝纖維化的病理機制[J].西安醫專論壇,2012,4(1):113-115.
[11]邵祥強,肖華勝.肝纖維化發病機制與臨床診斷的研究進展[J].世界華人消化雜志,2011,19(3):268-274.
[12]丁寧.肝纖維化形成機制的研究進展[J].臨床肝膽病雜志,2009,25(1):73-77.
[13]張金金,胡振林,張俊平.肝纖維化的細胞和分子機制[J].生命的化學,2011,31(5):684-687.
[14]張磊,李俊,朱鵬里,等.四氯化碳誘導大鼠肝纖維化進展期和恢復期模型的建立[J].中國藥理學通報,2011,27(12):1757-1760.
[15]韓軍勇,高永華.治療肝纖維化的蛋白質藥物研究進展[J].現代生物醫學進展,2012,12(13):2596-2600.
Therapeutical effect of human-interferon recombineβ-1a injection on model of rats with hepatic fibrosis
WANG Yan1,LIN Xiaofa1,ZHANG Weiwei2,WEI Kang2,WANG Zhonghan3,TIAN Jianming2*
(1.Shenhzen Polytechnic,Shenzhen 518044,China;2.Jilin Academy of Traditional Chinese Medicine,Changchun 130021,China;3.The Second Clinical Medical College of Jilin University,Changchun 130041,China)
Objective To analyze the therapeutical effect of human-interferon recombineβ-1a injectio and the albumin injectio on the rats hepatic fibrosis.Methods Feed rats with 50%solutions of CCl peanut oil 1 mL/kg,2-3 times/week,use the testing drugs after 5 weeks(alternates day per times),and at the same time continuously feed the rats with 50%solutions of CCl peanut oil.Sample the blood and liver after 9 weeks and measure ALT,AST,TP,ALB,TBIL of the blood plasma and the Hyp of the liver tissue,and undertake the histopathology of the liver tissue.Results Human-interferon recombine β-1a injectio and the albumin injectiocan obviously decrease the ALT,AST,TBIL of blood plasma of the model of the hepatic fibrosis rats evidently,and increase Hyp of the liver tissue of the model of the hepatic fibrosis rats at the meantime.Conclusi on Human-interferon recombineβ-1a injectio and the albumin injectio can inhibit the level of the hepatic fibrosis of the model rats.
human-interferon recombineβ-1a injection;albumin injectio;model of rats with hepatic fibrosis
R963
A
2095-6258(2015)05-0904-04
10.13463/j.cnki.cczyy.2015.05.008
2015-05-05)
廣東省教育廳項目(2012B091100408);深圳市科技創新委項目(CXZZ20120619162250509)。
王 妍(1962-),女,博士,研究員,主要從事分子生物學研究。
*通信作者:田建明,女,碩士,主任藥師,電話-13500806753,電子信箱-tianjm62@sina.com

