白骨壤幼苗對鎘脅迫的生長及生理生態響應
陳昌徐,陸志強,鄭文教*
(1.廈門大學環境與生態學院,福建 廈門361102;2.集美大學水產學院,福建 廈門 361021)
紅樹林是生長在熱帶、亞熱帶海岸潮間帶的木本植物群落,它不僅能保護海岸、防風固堤,也為海洋動物、鳥類等提供食物來源和棲息環境,是重要的濕地生態系統之一[1-2].作為位于陸海交界地帶的生態系統,紅樹林的生態環境既受控于海域環境,也與陸域環境關系密切.由于近幾十年來沿海地區工業化與城市化的快速發展,紅樹林正遭受著越來越多的污染問題[3-4].在眾多污染物中,重金屬污染成為破壞紅樹林生態環境的重要因素之一[5-6].隨著沿海城市人口與經濟的增長,流域工農業生產的發展,尤其是沿海城市廣泛選擇海灣河口作為廢物污水排放地,使大量重金屬污染物直接或間接進入紅樹林生態系統中[7].
鎘(Cd)雖然不是植物的必需元素,但易于被植物吸收并富集,即使在低濃度水平也會在基因、生化以及生理層面對土壤生物的活性和植物的新陳代謝產生非常不利的影響[8],如:抑制細胞和整個植株生長,導致植株矮小、生物產量下降、干物質減輕等[9-12].紅樹林能夠耐受高濃度的有毒金屬[7,13-14],然而富集金屬亦可能會導致亞細胞的生物化學變化[8,15].據報道,紅樹植物秋茄(Kandelia obovata)對Cd具有一定的耐受性,源于細胞壁對Cd的隔離作用[14],根部組織對Cd的吸收和轉運也有一定的緩沖作用[12].白骨壤(Avicennia marina)為我國常見紅樹植物之一,為先鋒樹種,分布廣泛,是組成演替最前階段的紅樹群落重要樹種之一[1].本文主要探討Cd污染脅迫對白骨壤幼苗的生長及生理生態兩方面的影響,為科學預測與評價Cd對紅樹植物的生物效應以及紅樹林濕地的生態環境保護提供科學的依據.
1 材料與方法
1.1 實驗材料
成熟白骨壤種苗采于福建九龍江口紅樹林自然保護區海門島(24°29′N,117°55′E)的白骨壤林.挑選無病蟲害且大小及成熟度相近的種苗用于栽培研究.栽培用砂基經清洗及消毒,等量分裝于同樣規格的盆栽容器中,砂基高度15cm,直徑30cm.培養液用鹽度15的人工海水和CdCl2·2.5H2O配制,設置培養液Cd質量濃度分別為0,0.5,5,25,50,100和150mg/L(記為Cd0,Cd0.5,Cd5,Cd25,Cd50,Cd100和 Cd150),每個盆栽加入培養液1 500mL.每個處理組設40顆種苗,3個重復,每個重復為隨機選擇的12~14顆種苗.所有盆栽放置于玻璃溫室中,在自然透光下栽培90d(2007年10月5日—2008年1月3日),期間每7d更換一次培養液,每天用自來水補足散失的水分.
1.2 分析樣品制備
抗氧化酶促系統粗酶液制備:在栽培45和90d后分別選取葉片(頂芽下第二對葉)與根尖(1cm左右)500mg,剪碎,置于研缽中,分次加入預冷的0.05 mol/L磷酸緩沖液(pH 7.8,含0.02g/mL的聚乙烯吡咯烷酮)和少量石英砂,冰浴下研磨成勻漿,終體積分別為10mL(葉)與5mL(根尖);離心(4℃,2×104g,20min),取上清液為粗酶液,于4℃冰箱保存,用于可溶性蛋白含量測定和過氧化物酶(POD)、超氧化物歧化酶(SOD)等酶活性測定.
抗氧化非酶促系統提取液制備:分別選取葉片(頂芽下第二對葉)與根尖(1cm左右)500mg左右,剪碎,置于研缽中,分次加入預冷的0.05g/mL的三氯乙酸和少量石英砂,冰浴下研磨成勻漿,終體積為5 mL;離心(4 ℃,2×104g,20min),取上清液為提取液,于4℃冰箱保存,用于抗壞血酸(ASA)及丙二醛(MDA)含量測定.
1.3 分析方法
生長形態指標測定:脅迫栽培15與30d,分別統計各處理組的幼苗萌發率(以第一對葉展開為萌發標準),在栽培過程中觀測幼苗的生長狀況,對各處理組受害葉片進行計數,并在脅迫栽培45和90d統計各處理組幼苗的成活率(以地上部分枯萎為死亡標準).在栽培45和90d后用直尺測定每株幼苗主根長(統計40根以上)、莖高、葉長和葉寬,葉面積采用剪紙衡重法[16];生物量測定:分別測量植株根、莖和葉各器官的鮮質量及全株總鮮質量;葉綠素含量的測定:每次取下各處理組幼苗的頂芽下第二對葉,去中脈,剪碎,稱取100mg左右以混合液法進行葉綠素含量的測定[17];MDA含量的測定:采用硫代巴比妥酸(TBA)顯色法進行測定[18];ASA含量的測定參考湯章城[19]的方法;可溶性蛋白含量測定:以牛血清白蛋白為標準蛋白,用考馬斯亮藍G-250染色后,在波長為595 nm處進行比色[20];SOD活性的測定:采用氮藍四唑(NBT)還原法,以抑制NBT光化學還原的50%為一個酶活性單位U[20];POD活性的測定:采用愈創木酚法,以1min內反應液在470nm處吸光值增加0.01為一個酶活性單位U[21].Cd150處理組的幼苗已有近一半死亡,在45d時采集完用于檢測各項指標,因此90d該質量濃度下的各項檢測數據缺失.葉面積每個處理組統計所有未受害的健全的第一對葉,統計數為20;其他測試均為3個實驗重復,各處理組數據間差異顯著性的LSDt檢驗分析由SPSS 20.0完成.
2 結果與分析
2.1 Cd對白骨壤幼苗生長狀況的影響
2.1.1 Cd對白骨壤種苗萌芽及成活率的影響
在Cd脅迫下,白骨壤萌芽僅受一定程度的滯后影響:脅迫栽培15d,不同質量濃度Cd的脅迫使處理組的萌芽率在65%~77.5%之間,顯著低于對照組(92.5%)(p<0.05);脅迫栽培30d,各處理組的萌芽率均達到100%.脅迫栽培45d,Cd50、Cd100和Cd150處理組中出現死亡植株,成活率分別為92.5%,75.0%和60.0%;至脅迫栽培90d,Cd脅迫質量濃度≤25mg/L的處理組植株成活率均為100%,而Cd50和Cd100處理組植株的成活率進一步降低,分別為87.5%和57.5%.
這一結果表明:在Cd脅迫下,白骨壤萌芽有一定程度的延遲,成活率隨著脅迫質量濃度提高而降低.
2.1.2 Cd對白骨壤幼苗葉生長及子葉宿存率的影響
脅迫栽培19d時,在Cd質量濃度≥25mg/L的處理組,白骨壤幼苗的葉片上出現紅褐色近黑色壞死斑點,且葉片受害的數量隨著Cd脅迫質量濃度的上升而增加(25~150mg/L).至脅迫栽培45d統計顯示Cd25、Cd50、Cd100與Cd150處理組的受害葉片總數 分 別 占 葉 片 總 數 的 10.6%,17.5%,35.0%和52.0%.
白骨壤的葉片大小總體上呈現隨Cd脅迫質量濃度的上升而遞減的趨勢,且脅迫栽培45d的趨勢較90 d明顯,即后期較為遲緩.Cd對白骨壤幼苗葉長及葉寬影響不明顯,各處理組與對照組的差異不顯著(p>0.05),在高質量濃度Cd脅迫下,葉形由原來的卵圓盾形逐漸向鐮刀形轉變.白骨壤在生長過程中,最初提供幼苗生長所需物質與能量的兩片子葉會逐漸變黃、萎縮,與莖的結合變松懈,最終凋落與幼苗分離.隨Cd脅迫質量濃度增加,子葉凋落進度加快,且隨時間推移,此趨勢愈發顯著;中高質量濃度(25~100 mg/L)處理組的子葉宿存率均不及對照組的40%.
上述結果表明:在Cd脅迫下,白骨壤幼苗葉片面積減小并出現壞死斑點,子葉提早與幼苗分離,且這一趨勢隨著Cd脅迫質量濃度的增加而加劇.
2.1.3 Cd對白骨壤幼苗莖高與根長的影響
從圖1中可以看出,隨著Cd脅迫質量濃度的升高,白骨壤的莖高遞減,從Cd25處理組開始,與對照組差異顯著(p<0.05),但隨脅迫時間增加,白骨壤幼苗的莖高降幅減小,如Cd100處理組45d時較對照組降低20.8%,90d時則僅降低14.8%.白骨壤根長有隨著Cd脅迫質量濃度的升高而下降的趨勢,但對照組與各脅迫組并無顯著差異(p>0.05).從Cd25處理組開始,白骨壤須根數目減少,主根根尖呈紅褐色,且此現象隨Cd質量濃度的升高而愈發顯著;但在Cd150處理組也未發現主根有明顯死亡的跡象.
這一結果表明:Cd脅迫能抑制白骨壤幼苗莖與主根的生長,該抑制作用對莖的影響較為顯著.
2.1.4 Cd對白骨壤幼苗生物量的影響
從圖2可以看出,不同脅迫時期,Cd脅迫對白骨壤幼苗各器官及全株生物量均有不同程度的抑制作用.白骨壤幼苗各器官及全株生物量表現出類似的規律:脅迫栽培45d,其生物量總體上表現為隨Cd脅迫質量濃度上升而下降;脅迫栽培90d,在0.5mg/L的Cd脅迫下,其生物量相比對照組稍有提高(p>0.05),而后隨Cd脅迫質量濃度的上升而減少.
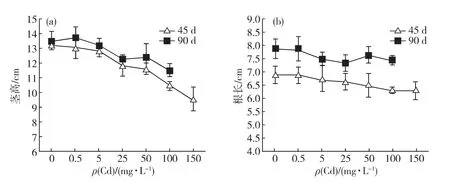
圖1 Cd對白骨壤幼苗莖高(a)與根長(b)的影響Fig.1 Effect of Cd on the height of stem (a)and the length of main root(b)of A.marinaseedlings

圖2 Cd對白骨壤幼苗生物量生長的影響Fig.2 Effect of Cd on the biomass of A.marinaseedlings
根生物量變化與其他稍有不同.脅迫栽培45d,僅在150mg/L的Cd脅迫下,根生物量與對照組差異顯著(p<0.05),相對降低26.6%;而在25~150mg/L的Cd脅迫下,莖、葉及全株的生物量均顯著低于對照組(p<0.05).脅迫栽培90d,當Cd脅迫質量濃度≥5mg/L時,根生物量便有顯著的降低(p<0.05);而此時莖、葉及全株生物量僅在100mg/L的Cd脅迫下有顯著降低(p<0.05).
這一結果表明:不同脅迫時期,Cd對白骨壤各器官生物量均有不同程度的抑制作用.其中,根對Cd的反應在脅迫前期較其他器官遲緩,而到脅迫后期根部所受到的抑制作用較其他器官更為嚴重.
2.2 Cd對白骨壤幼苗生理生態的影響
2.2.1 Cd對白骨壤幼苗葉綠素含量的影響
如圖3所示,脅迫栽培45d,白骨壤幼苗葉片葉綠素a及葉綠素b的含量變化表現基本一致:當Cd脅迫質量濃度≤25mg/L時,葉綠素含量隨Cd脅迫質量濃度上升而升高,當脅迫質量濃度繼續升高,葉綠素含量則呈下降趨勢;而從葉綠素a/b可以看出,葉綠素a與葉綠素b變化幅度相近.脅迫栽培90d,Cd脅迫質量濃度為0.5和5mg/L時,葉綠素a及葉綠素b的含量與對照組相當;Cd脅迫質量濃度≥25mg/L時,葉綠素含量隨脅迫質量濃度上升呈下降趨勢,且從葉綠素a/b可以看出,葉綠素b降幅大于葉綠素a.
上述結果表明:低質量濃度的Cd(≤25mg/L)在脅迫前期對白骨壤葉綠素的合成具有促進作用,而高質量濃度的Cd會抑制白骨壤葉綠素的合成,且對葉綠素b的抑制作用較葉綠素a大.
2.2.2 Cd對白骨壤幼苗根尖與葉片中 MDA與ASA含量的影響
從圖4可以看出,脅迫栽培90d,根尖MDA含量隨脅迫質量濃度上升呈下降趨勢,從Cd5處理組開始極顯著低于對照組(p<0.01).葉的 MDA含量在Cd0.5處理組稍高于對照組,但二者差異并不顯著(p>0.05);而后,隨脅迫質量濃度上升呈下降趨勢且均顯著低于對照組(p<0.05).與根尖相比,葉的MDA含量變化幅度較小.如Cd25處理組葉的MDA含量相比對照組降低22.0%,而根尖的MDA含量相對降低57.4%.

圖3 Cd對白骨壤幼苗葉片葉綠素含量的影響Fig.3 Effect of Cd on the chlorophyll contents in leaves of A.marinaseedlings

圖4 Cd對白骨壤幼苗根尖與葉片中MDA與ASA含量的影響Fig.4 Effect of Cd on the MDA and ASA contents in roots and leaves of A.marinaseedlings
脅迫栽培90d,根尖與葉片的ASA含量總體上隨Cd脅迫質量濃度上升而增加,所有脅迫組均顯著或極顯著高于對照組(p<0.05或0.01).同時根尖的ASA含量變化幅度高于葉片.
上述結果表明:與葉相比,Cd脅迫能較顯著地影響根尖的MDA及ASA含量,在0.5~50mg/L的Cd脅迫范圍內,能顯著減少根尖中MDA含量及提高ASA含量,且此作用與Cd脅迫質量濃度呈一定的正相關.
2.2.3 Cd對白骨壤幼苗根尖與葉片可溶性蛋白的影響
由圖5可以看出,脅迫栽培45d,根尖可溶性蛋白含量在0.5~100mg/L的Cd脅迫質量濃度范圍內,隨著Cd質量濃度增加而上升,顯著高于對照組,且在Cd100處理組達到最高值,較對照組提高98.3%;當Cd脅迫質量濃度達到150mg/L時,含量雖略低于Cd100處理組,但仍極顯著高于對照組(p<0.01).脅迫栽培90d,根尖可溶性蛋白含量在0.5~25mg/L的Cd脅迫范圍內,與對照組相當(p>0.05);當Cd脅迫質量濃度高于25mg/L時,根尖可溶性蛋白含量隨脅迫質量濃度上升而增加,但幅度不大,Cd100處理組較對照組僅提高16.6%.
Cd脅迫對葉片可溶性蛋白含量的影響較弱.脅迫栽培45d,葉可溶性蛋白含量隨Cd脅迫質量濃度的上升先增加后減少,且在Cd脅迫質量濃度為25mg/L時最高;僅Cd5、Cd25及Cd50處理組與對照組存在顯著差異(p<0.05).脅迫栽培90d,葉可溶性蛋白含量除在Cd25處理組有波動外,總體趨勢與45d一致.
上述結果表明:Cd脅迫對根尖可溶性蛋白的影響較葉顯著,隨著Cd脅迫質量濃度的上升,能顯著地提升根尖可溶性蛋白含量,而隨著脅迫時間的推進,該提升作用減弱.
2.2.4 Cd對白骨壤幼苗根尖與葉片抗氧化酶促系統的影響
如圖6所示,脅迫栽培45d,在0~100mg/L的Cd脅迫范圍內,根尖SOD活性隨Cd脅迫質量濃度上升而增強,Cd150處理組根尖的SOD活性雖開始下降,但仍極顯著高于對照組(p<0.01).脅迫栽培90 d,各脅迫組根尖SOD活性雖有所波動,但與對照組無顯著差異(p>0.05).
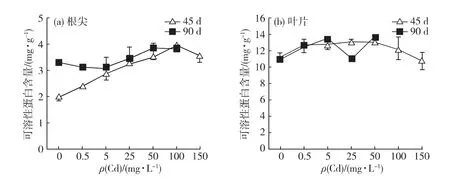
圖5 Cd對白骨壤根尖(a)和葉片(b)可溶性蛋白含量的影響Fig.5 Effect of Cd on the soluble protein content in roots(a)and leaves(b)of A.marinaseedlings
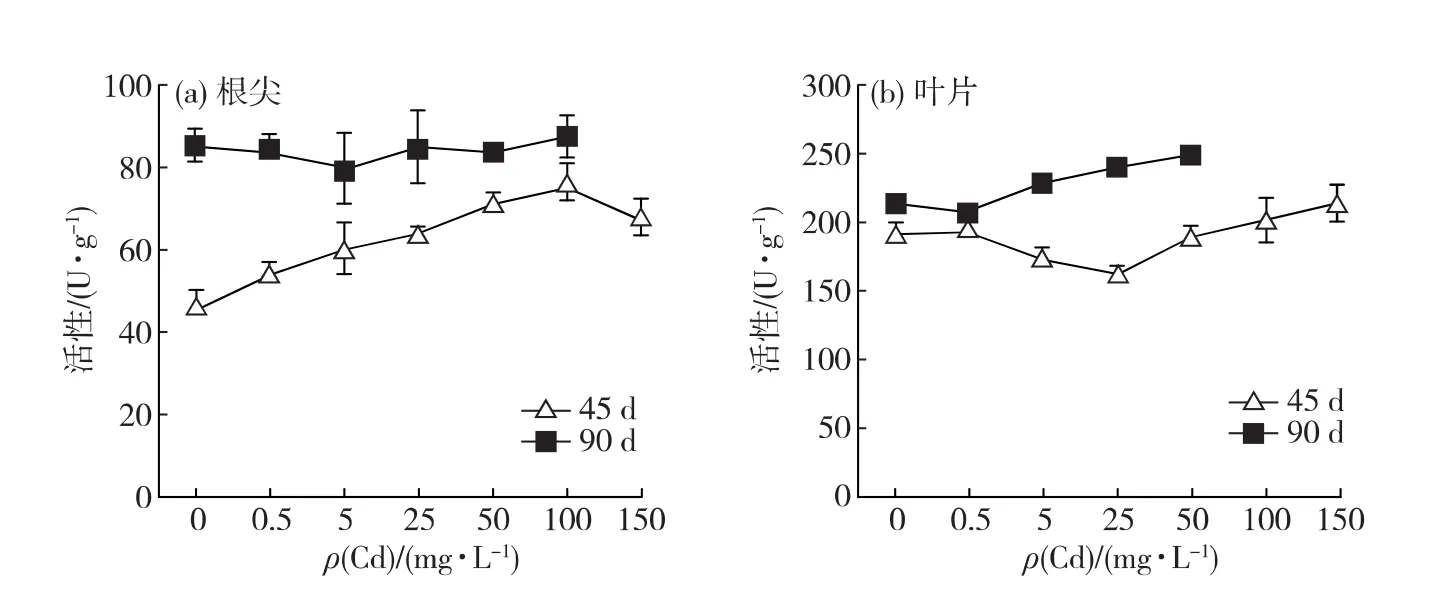
圖6 Cd對白骨壤幼苗根尖(a)與葉片(b)SOD活性的影響Fig.6 Effect of Cd on the SOD activity in roots(a)and leaves(b)of A.marinaseedlings
葉片SOD活性隨Cd脅迫質量濃度上升先減弱后增強,脅迫栽培45d,Cd25處理組的活性最低且與對照組差異顯著(p<0.05).脅迫栽培90d,Cd0.5處理組的葉片SOD活性稍低于對照組,但差異不顯著(p>0.05);而后,葉片SOD活性隨Cd脅迫質量濃度升高而顯著高于對照組并隨之增強(p<0.05).
從圖7可以看出,根尖POD活性總體上表現為隨Cd脅迫質量濃度上升而增強.脅迫栽培45d,根尖POD活性從Cd5處理組開始極顯著高于對照組(p<0.01);脅迫栽培90d,根尖POD活性從Cd25處理組開始極顯著高于對照組(p<0.01).葉片POD活性變化表現隨Cd脅迫質量濃度上升呈先增強后減弱的規律.脅迫栽培45d,葉POD活性在Cd25處理組具最強活性,較對照組增強38.6%,除Cd150處理組與對照組具相當的活性水平外,其余處理組均顯著或極顯著高于對照組(p<0.05或0.01).脅迫栽培90d,最高活性出現在Cd5處理組,其中Cd5、Cd25與Cd50處理組的POD活性極顯著高于對照組(p<0.01).
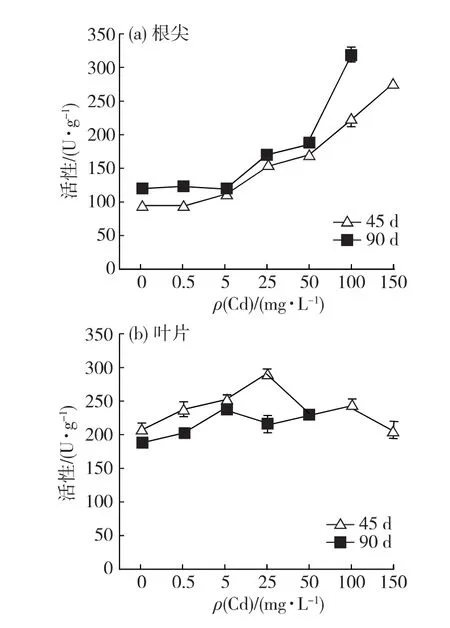
圖7 Cd對白骨壤幼苗根尖(a)與葉片(b)POD活性的影響Fig.7 Effect of Cd on the POD activity in roots(a)and leaves(b)of A.marinaseedlings
上述結果表明:脅迫栽培45d,Cd能顯著提高白骨壤根尖的SOD和POD活性,到脅迫后期,該促進作用減弱;Cd脅迫對白骨壤葉片的SOD和POD活性也有一定程度的促進作用,但相對于根尖而言,變化幅度較小.
3 討 論
通過不同質量濃度Cd的脅迫栽培,本文以45和90d為時間節點,研究白骨壤幼苗生長和生理生態所受到的影響及各指標變化的過程.白骨壤幼苗在≥5 mg/L的Cd脅迫下,根生物量雖開始有顯著降低,但除細根略有減少外,主根的生長并未受到顯著抑制且未出現明顯的受害癥狀,對白骨壤各組分Cd含量進行分析,根尚未有明顯的富集Cd(另文發表).
本研究推測,高質量濃度Cd脅迫下白骨壤幼苗葉形的變化是在葉長及葉寬沒有明顯變化的情況下,葉面積隨脅迫質量濃度上升而減小的主要原因.白骨壤幼苗的死亡主要是由于葉片出現壞死斑點,直至葉片全部壞死脫落.MacFarlane等[22]的研究表明,在Zn和Cu污染下,白骨壤葉片在分泌掉體內多余鹽分的同時,也可將Zn和Cu排除體外,減少重金屬對植物的毒害.本研究在脅迫栽培后期,于中高質量濃度(25~100mg/L)Cd處理組的白骨壤幼苗葉分泌的鹽粒收集液中檢測出Cd,推測白骨壤借由正常的泌鹽活動將Cd排出體外,這尚待進一步研究.
與其他紅樹植物類似[23-24],白骨壤幼苗在 Cd脅迫下也表現出主根生長、莖高受抑制,各器官生物量減少,葉綠素含量降低等現象.生物量分析顯示,Cd脅迫能減緩地上部分生物量的增長,脅迫時間的延長可使抑制作用減弱;相反,Cd脅迫對根生物量的抑制作用隨脅迫時間增加而加強,這可能是由于根吸收Cd后,較少向上運輸而在根部累積[11],導致Cd對其影響隨脅迫時間增加而增強.Cd在根部的含量雖高于其他組分,但未有明顯的受害,這可能是因為Cd在根尖中的生物有效性被降低.細胞壁截留Cd在根部、大液泡的分隔以及與細胞配位體的絡合反應都可能是白骨壤幼苗降低Cd生物有效性的手段[14],從而減低Cd對原生質的毒害.Cd能夠通過抑制葉綠素酸酯還原酶活性、影響氨基-γ-酮戊二酸的合成、直接破壞葉綠素結構及功能并干擾植物對Fe和Zn的吸收和轉移,導致葉綠素含量的下降[25].本研究中,脅迫栽培45d,葉綠素a和葉綠素b的含量隨Cd脅迫質量濃度的上升均呈現先上升后下降的趨勢,這與Cd對桐花樹的處理結果類似[23,26],表明低質量濃度的Cd對白骨壤葉綠素的合成有促進作用;但隨著脅迫時間的延長,促進作用消失,且Cd對葉綠素b含量的抑制作用增強,不同的是Cd對桐花樹葉綠素a的破壞作用更為明顯[26].
重金屬脅迫和其他形式的氧化脅迫相似,能導致大量的活性氧自由基產生,引起膜脂過氧化.MDA則是膜脂過氧化的產物[4],在植物逆境生理研究中,MDA被普遍地作為一種表示傷害的指標.本研究中,在0.5~50mg/L的Cd脅迫范圍內,MDA含量總體上呈下降趨勢,表明植物細胞清除自由基能力有所提高.植物的抗氧化系統由酶促和非酶促抗氧化劑構成[24],其中ASA是植物體內普遍存在的一種非酶促類抗氧化劑,可以直接清除O2-、H2O2和·OH等活性氧自由基,在抵御植物體內活性氧損傷方面具有重要的作用.本研究中,脅迫栽培90d,在0.5~50mg/L的Cd脅迫范圍內,根尖和葉的ASA含量顯著上升,進而提高了白骨壤對Cd脅迫的耐受性.
從可溶性蛋白的分析可以看出,一定質量濃度的Cd脅迫能提高可溶性蛋白在根尖和葉片中的含量,這可能是細胞通過產生植物絡合素(PC)等重金屬結合多肽或蛋白,結合進入細胞的Cd,以降低Cd的生物有效性,也可能通過產生更多的抗氧化酶來減輕脅迫所帶來的自由基對細胞的傷害.SOD和POD就是植物體內活性氧自由基清除系統中重要的保護酶,其活性的提高是一種急性解毒措施,是使細胞免受毒害的調節反應,但其調節能力是臨時和有限的,當細胞長時間受到脅迫,細胞內的活性物質包括酶亦會受到損傷而活性下降[27].本研究中,脅迫栽培45d,在5~150mg/L的Cd脅迫下,根尖SOD、POD活性顯著提高,但隨脅迫時間增加,Cd的促進作用減弱,到脅迫栽培90d,根尖POD活性的變化幅度變小,SOD活性則與對照組相當.Cd脅迫對葉片的SOD、POD活性也有一定促進作用,但相對根尖而言變化幅度較小.
4 結 論
本文通過脅迫栽培,揭示了不同質量濃度的Cd對白骨壤幼苗生長及生理生態的影響,結果表明:Cd脅迫會導致白骨壤幼苗子葉與植株提早分離,葉面積變小,生物量及葉綠素含量減少;白骨壤幼苗對Cd的適宜抗性生長質量濃度范圍在25mg/L以下,中高質量濃度Cd脅迫(25~150mg/L)導致葉出現受害壞死斑點,莖高度生長顯著受抑制,50~150mg/L的Cd脅迫導致植株死亡;脅迫后期,白骨壤根部的特性使其在Cd脅迫下受害程度較低,中低質量濃度(0.5~50mg/L)Cd脅迫下白骨壤根尖及葉的膜脂過氧化作用有不同程度的減弱,這與白骨壤根尖和葉中ASA含量的上升有關,同時Cd脅迫對白骨壤根尖和葉中的可溶性蛋白含量、SOD及POD活性具有不同程度的促進作用,但隨著脅迫時間的增加,促進作用減弱.在自然環境中,污染物往往不是單獨存在的,研究復合污染物的脅迫是下一步的研究方向,同時紅樹植物對重金屬的耐受機理以及重金屬在環境和植物體內的存在形態還須進一步研究.
[1]林鵬.中國紅樹林生態系[M].北京:科學出版社,1997:297-316.
[2]Caregnato F F,Koller C E,MacFarlane G R,et al.The glutathione antioxidant system as a biomarker suite for the assessment of heavy metal exposure and effect in the grey mangrove,Avicennia marina (Forsk.)Vierh[J].Marine Pollution Bulletin,2008,56(6):1119-1127.
[3]Mahdavi E S,Rahimi A E K,Amini H V.Pb and Cd accumulation in Avicennia marinafrom Qeshm Island,Persian Gulf[J].Iranian Journal of Fisheries Sciences,2012,11(4):867-875.
[4]Yan Z,Tam N F Y.Differences in lead tolerance between Kandelia obovata and Acanthus ilicifolius seedlings under varying treatment times[J].Aquatic Toxicology,2013,126:154-162.
[5]Bodin N,N′Gom-KaR,KaS,et al.Assessment of trace metal contamination in mangrove ecosystems from Senegal,West Africa[J].Chemosphere,2013,90(2):150-157.
[6]Usman A R A,Alkredaa R S,Al-Wabel M I.Heavy metal contamination in sediments and mangroves from the coast of Red Sea:Avicennia marina as potential metal bioaccumulator[J].Ecotoxicology and Environmental Safety,2013,97:263-270.
[7]鄭文教,連玉武,鄭逄中,等.廣西英羅灣紅海欖林重金屬元素的累積及動態[J].植物生態學報,1996,20(1):20-27.
[8]Xie X,Weiss D J,Weng B,et al.The short-term effect of cadmium on low molecular weight organic acid and amino acid exudation from mangrove (Kandelia obovata (S.,L.)Yong)roots[J].Environmental Science and Pollution Research,2013,20(2):997-1008.
[9]張金彪,黃維南.鎘對植物的生理生態效應的研究進展[J].生態學報,2000,20(3):514-523.
[10]Zhang F Q,Wang Y S,Lou Z P,et al.Effect of heavy metal stress on antioxidative enzymes and lipid peroxidation in leaves and roots of two mangrove plant seedlings(Kandelia candel and Bruguiera gymnorrhiza)[J].Chemosphere,2007,67(1):44-50.
[11]Huang G Y,Wang Y S.Physiological and biochemical responses in the leaves of two mangrove plant seedlings(Kandelia candel and Bruguiera gymnorrhiza)exposed to multiple heavy metals[J].Journal of Hazardous Materials,2010,182(1):848-854.
[12]Du J,Yan C,Li Z.Formation of iron plaque on mangrove Kandalar obovata (S.,L.)root surfaces and its role in cadmium uptake and translocation[J].Marine Pollution Bulletin,2013,74(1):105-109.
[13]Ye J,Yan C,Liu J,et al.Effects of silicon on the distribution of cadmium compartmentation in root tips of Kandelia obovata(S.,L.)Yong[J].Environmental Pollution,2012,162:369-373.
[14]Weng B,Xie X,Weiss D J,et al.Kandelia obovata(S.,L.)Yong tolerance mechanisms to cadmium:subcellular distribution,chemical forms and thiol pools[J].Marine Pollution Bulletin,2012,64(11):2453-2460.
[15]程皓,陳桂珠,葉志鴻.紅樹林重金屬污染生態學研究進展[J].生態學報,2009,29(7):3893-3900.
[16]喬富廉.植物生理學實驗分析測定技術[M].北京:中國農業科學技術出版社,2002:78-83.
[17]陳福明,陳順偉.混合液法測定葉綠素含量的研究[J].林業科技通訊,1984(2):4-8.
[18]劉祖祺,張石城.植物抗性生理學[M].北京:中國農業出版社,1994:371-372.
[19]湯章城.現代植物生理學實驗指南[M].北京:科學出版社,1999:356-358.
[20]李合生.植物生理生化實驗原理和技術[M].北京:高等教育出版社,2000:167-185.
[21]張志良,瞿偉菁.植物生理學實驗指導[M].北京:高等教育出版社,2003:121-124.
[22]MacFarlane G R,Burchett M D.Znic distribution and excretion in the leaves of the grey mangrove,Avicennia marina (Forsk.)Vierh[J].Environmental and Experimental Botany,1999,41(2):167-175.
[23]石貴玉,康浩,段文芳.重金屬鎘對紅樹植物白骨壤和桐花樹幼苗生理特性的影響[J].廣西植物,2009,29(5):644-647.
[24]Weng Z X,Wang L X,Tan F,et al.Proteomic and physiological analyses reveal detoxification and antioxidation induced by Cd stress in Kandelia candel roots[J].Trees,2013,27(3):583-595.
[25]陶毅明,陳燕珍,梁士楚,等.鎘脅迫下紅樹植物木欖幼苗的生理生化特性[J].生態學雜志,2008,27(5):762-766.
[26]楊盛昌,吳琦.Cd對桐花樹幼苗生長及某些生理特性的影響[J].海洋環境科學,2003,22(1):38-42.
[27]張利紅,李培軍,李雪梅.鎘脅迫對小麥幼苗生長及生理特性的影響 [J].生態學雜志,2005,24(4):458-460.

