HIV-1感染者PBMC中SAMHD1 mRNA表達變化及其與血漿IFN-α水平的相關性
饒和平,金祥寧,盧偉力,彭曉蓉,靳昌忠
(1衢州職業技術學院醫學院,浙江 衢州 324000;2金華職業技術學院醫學院;3衢州市人民醫院;4浙江大學醫學院附屬第一醫院)
不育-α-基序結構域和組氨酸/天冬氨酸殘基雙聯體結構域包涵蛋白1(SAMHD1)是一種最新發現的HIV-1宿主限制因子,它高表達于髓系細胞,如樹突狀細胞、單核細胞和巨噬細胞等,而在HIV-1容易感染的CD+4T 細胞中的表達卻較低[1,2]。SAMHD1 是一種dGTP依賴的磷酸水解酶,能夠將dNTPs水解成脫氧核苷和無機的三磷酸,從而降低細胞中dNTP水平,起到清除細胞內過剩的dNTPs的作用[3]。HIV-1感染細胞后,病毒RNA在逆轉錄酶的作用下形成病毒DNA,這時需要大量的dNTP,SAMHD1通過耗竭細胞內的dNTP使病毒的逆轉錄過程受阻,從而限制病毒的感染[4]。同時,SAMHD1也是目前已知惟一的HIV-1無法對抗的宿主限制因子。因此,SAMHD1的表達對HIV-1的感染及潛伏的形成十分重要。體外實驗表明,SAMHD1的表達受干擾素 (IFN-α)調控,干擾素可以顯著促進SAMHD1的表達[5]。HIV-1感染可以產生一系列的炎癥反應和細胞因子的分泌,包括 IFN-α 水平的升高[6]。HIV-1 感染者 SAMHD1 mRNA的變化及其與IFN-α水平的關系目前尚未見報道。本研究觀察了HIV-1感染者外周血單個核細胞(PBMC)中SAMHD1 mRNA,并分析了其與血漿IFN-α水平的關系。
1 資料與方法
1.1 臨床資料 選擇2014年5~10月于浙江大學附屬第一醫院就診的HIV-1感染者78例,其中32例未接受抗病毒治療,男22例,女10例;年齡(37.8±7.6)歲;46例接受高效抗逆轉錄病毒治療(HAART)1 a以上,男33例、女13例,年齡(35.93±11.57)歲,治療時間(3.1 ±1.2)a;所有 HIV-1 感染者均經初篩和確認試驗HIV-1抗體陽性,近期無機會性感染或腫瘤以及HBV/HCV合并感染。另外招募正常對照者 28例,男21例、女7例,年齡(38.29±12.51)歲。各組一般資料無統計學差異,具有可比性。本研究得到浙江大學附屬第一醫院倫理委員會批準,所有研究方案均告知患者本人,并簽訂知情同意書。
1.2 PBMC中SAMHD1 mRNA檢測 每位受試對象抽取EDTA抗凝血5 mL,用于PBMC分離、流式細胞術和病毒載量檢測。采用密度梯度離心法(Ficoll淋巴細胞分離液)分離上述抗凝血,得到PBMC。用TRIzol溶液溶解上述細胞,按照說明書,提取總體RNA。取1 μL RNA,利用 PrimeSciptTM逆轉試劑盒逆轉錄為cDNA。采用20 μL反應體系,取1 μL cDNA反應產物,加入SYBR定量檢測混合試劑中,利用Light Cycler2.0定量PCR儀擴增、檢測。反應條件:先在95℃反應30 s,再在95℃、5 s和60℃、20 s條件下反應40循環。利用2-ΔΔCt相對定量法計算SAMHD1 mRNA。
1.3 血漿 IFN-α 水平檢測 采用人 IFN-α ELISA檢測試劑盒檢測血漿IFN-α水平,操作按照說明書所述步驟進行。
1.4 血漿HIV病毒載量檢測 采用HIV-1 Monitor 1.5(Roche)商品化試劑盒,在COBAS Amplisemsor-PCR儀上對血漿樣品的HIV-RNA作定量分析,操作嚴格按照試劑盒說明進行,結果以每毫升血漿含病毒拷貝數表示,最低檢測限50拷貝/mL。
1.5 外周血CD+4、CD+8T細胞數檢測 采用流式細胞儀和CD3/CD4/CD8三色標記單抗絕對定量試劑盒進行檢測,取全血50 μL,用20 μL單克隆抗體混合物孵育1 h,用紅細胞裂解液裂解紅細胞之后上機檢測。用System U軟件進行分析。
1.6 統計學方法 采用SPSS15.0統計軟件。計量資料以±s表示,組間比較采用t檢驗,采用單因素方差分析對多組數據進行統計學分析,其中兩兩比較采用LSD法。相關性分析采用Pearson相關分析法。P<0.05為差異有統計學意義。
2 結果
2.1 各組PBMC中 SAMHD1 mRNA及血漿 IFN-α水平比較 結果見表1。
表1 各組PBMC中SAMHD1 mRNA及血漿IFN-α水平比較( ± s)
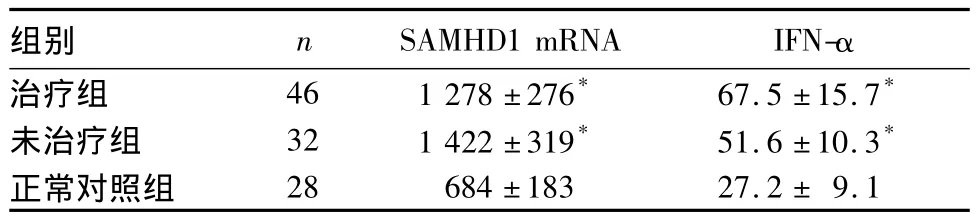
表1 各組PBMC中SAMHD1 mRNA及血漿IFN-α水平比較( ± s)
注:與正常對照組比較,*P <0.01。
組別 n SAMHD1 mRNA IFN-α治療組 46 1 278±276* 67.5±15.7*未治療組 32 1 422±319* 51.6±10.3*正常對照組28 684±183 27.2± 9.1
2.2 各組血漿HIV病毒載量及外周血CD+4T細胞、CD+8T細胞數比較 結果見表2。
表2 各組血漿HIV病毒載量及外周血CD4+T細胞、CD8+T 細胞數比較(±s)

表2 各組血漿HIV病毒載量及外周血CD4+T細胞、CD8+T 細胞數比較(±s)
注:與未治療組比較,*P <0.05;與正常對照組比較,△P <0.05。
組別 n 病毒載量(log10)CD+4T細胞數CD+8T細胞數(個/μL)(個/μL)治療組 46 0.81 ±1.25* 452.05 ±161.20*△835.88 ±370.36未治療組 32 4.44 ±0.93 325.17±188.83△ 1 056.81±523.02正常對照組28 - 693.52 ±148.26 983.46 ±508.94
2.3 相關性分析 HIV-1感染者PBMC中SAMHD1 mRNA與病毒載量、CD+4T細胞數量無相關性(r分別為 -0.306、0.064,P均 > 0.05),與血漿IFN-α 水平呈正相關(r=0.324,P<0.05)。
3 討論
固有免疫和獲得性免疫在抗HIV-1及其機會性感染中發揮了重要作用,特別是固有免疫,是近年來抗HIV-1感染免疫研究的熱點。SAMHD1在固有免疫系統中扮演重要角色。SAMHD1功能的缺失可以造成細胞內dNTPs的大量積聚,從而引發強烈的免疫活化和大量的 Ⅰ 型干擾素分泌[7,8]。因此,SAMHD1這種通過清除過剩的dNTPs來減少核酸代謝引起的免疫活化的能力,使它與固有免疫反應緊密地聯系起來,又被形象地稱為“IFN反應的負性調節器”[7,9]。SAMHD1 對固有免疫應答的調控在HIV-1感染中的作用尚不清楚。一方面,SAMHD1對Ⅰ型干擾素分泌的抑制作用可能促進HIV-1的感染;另一方面,SAMHD1通過避免免疫系統過度活化以減少CD+4T細胞的活化和HIV-1的感染。此外,SAMHD1還是HIV-1感染的重要宿主限制因子。HIV-1難以有效感染DC、單核細胞、巨噬細胞等髓系細胞的主要原因是這些髓系細胞高表達SAMHD1[4,10]。敲除 SAMHD1 基因后,這些髓系細胞就喪失了對HIV-1感染的抵抗性,可以被HIV-1大量感染[11]。SAMHD1對HIV-1感染的限制是通過降低HIV-1逆轉錄所需的原料dNTPs的濃度來實現的[12]。SAMHD1基因缺陷的AGS患者的單核細胞更容易感染HIV-1,進一步在人體原代細胞上驗證了 SAMHD1 的 HIV-1 感染限制功能[13,14]。
SAMHD1在固有免疫調控及HIV-1感染中的重要作用。本研究顯示,HIV-1感染者PBMC中SAMHD1表達及 IFN-α水平升高,SAMHD1表達與IFN-α水平呈正相關,而與CD+4T細胞數量和病毒載量無關。SAMHD1在抑制Ⅰ型干擾素過度分泌的同時,其自身的表達又受干擾素的調控。SAMHD1最初是作為一種IFN-γ誘導的蛋白被發現的[15]。此外,有報道[16]IFN-α 也可以誘導 SAMHD1的表達。我們在前期研究中發現,IFN-γ可以在 THP-1和Jurkat細胞上誘導SAMHD1的表達[17]。這樣,SAMHD1與干擾素形成了一個互相調控的復雜網絡。Buitendijk等在研究Toll樣受體(TLRs)的免疫應答時發現,TLR9活化時伴有SAMHD1表達的升高。結合TLRs在病毒感染免疫應答中的重要作用,HIV-1感染是否可以通過TLRs通路調控SAMHD1?本研究結果提示,HIV-1感染上調SAMHD1表達的機制可能是通過IFN-α的調節實現的。HIV-1感染靶細胞后,可以通過與Toll樣受體結合,促進IFN-α以及多種促炎因子的表達,而IFN-α水平的升高又可以上調SAMHD1的表達,來抑制免疫系統的過度激活,同時抑制HIV-1感染新的靶細胞。
[1]St Gelais C,Wu L.SAMHD1:a new insight into HIV-1 restriction in myeloid cells[J].Retrovirology,2011,(8):55.
[2]Jermy A.Viral infection:SAMHD1 cuts the power to HIV-1[J].Nat Rev Microbiol,2012,10(4):237.
[3] Powell RD,Holland PJ,Hollis T,et al.Aicardi-Goutieres syndrome gene and HIV-1 restriction factor SAMHD1 is a dGTP-regulated deoxynucleotide triphosphohydrolase[J].J Biol Chem,2011,286(51):43596-43600.
[4]Lahouassa H,Daddacha W,Hofmann H,et al.SAMHD1 restricts the replication of human immunodeficiency virus type 1 by depleting the intracellular pool of deoxynucleoside triphosphates[J].Nat Immunol,2012,13(3):223-228.
[5]Goujon C,Schaller T,Gal?o RP,et al.Evidence for IFN-α-induced,SAMHD1-independent inhibitors of early HIV-1 infection[J].Retrovirology,2013,(10):23.
[6]Tremblay MJ.HIV-1 and pattern-recognition receptors:a marriage of convenience[J].Nat Immunol,2010,11(5):363-365.
[7]Rice GI,Bond J,Asipu A,et al.Mutations involved in aicardigoutières syndrome implicate SAMHD1 as regulator of the innate immune response[J].Nat Genet,2009,41(7):829-832.
[8] Goldstone DC,Ennis-Adeniran V,Hedden JJ,et al.HIV-1 restriction factor SAMHD1 is a deoxynucleoside triphosphate triphosphohydrolase[J].Nature,2011,480(7377):379-382.
[9]Laguette N,Benkirane M.How SAMHD1 changes our view of viral restriction[J].Trends Immunol,2012,33(1):26-33.
[10]Jamburuthugoda VK,Chugh P,Kim B.Modification of human immunodeficiency virus type 1 reverse transcriptase to target cells with elevated cellular dNTP concentrations[J].J Biol Chem,2006,281(19):13388-13395.
[11]Laguette N,Sobhian B,Casartelli N,et al.SAMHD1 is the dendritic and myeloid-cell-specific HIV-1 restriction factor counteracted by Vpx[J].Nature,2011,474(7353):654-657.
[12]Amie SM,Noble E,Kim B.Intracellular nucleotide levels and the control of retroviral infections[J].Virology,2013,436(2):247-254.
[13]Berger A,Sommer AF,Zwarg J,et al.SAMHD1-deficient CD+14cells from individuals with aicardi-goutieres syndrome are highly susceptible to HIV-1 infection[J].PLoS Pathog,2011,7(12):e1002425.
[14]Goncalves A,Karayel E,Rice GI,et al.SAMHD1 is a nucleicacid binding protein that is mislocalized due to aicardi-goutières syndrome-associated mutations[J].Hum Mutat,2012,33(7):1116-1122.
[15]Li N,Zhang W,Cao X.Identification of human homologue of mouse IFN-gamma induced protein from human dendritic cells[J].Immunol Lett,2000,74(3):221-224.
[16] Su B,Biedma M,Lederle A,et al.Dendritic cell-lymphocyte cross talk downregulates host restriction factor SAMHD1 and stimulates HIV-1 replication in dendritic cells[J].J Virol,2014,88(9):5109-5121.
[17]Jin C,Peng X,Liu F,et al.MiR-181 expression regulates specific post-transcriptional level of SAMHD1 expression in vitro[J].Biochem Biophys Res Commun,2014,452(3):760-767.

