水飛薊素膠囊對早期糖尿病腎病微量白蛋白尿的影響
李莉,萬青松,謝紅萍,楊波
(1.湖南環境生物職業技術學院護理學院,湖南 衡陽 421005;2.南華大學附屬第一醫院腎內科,湖南 衡陽 421001)
·臨床論著·
水飛薊素膠囊對早期糖尿病腎病微量白蛋白尿的影響
李莉1,萬青松2,謝紅萍2,楊波2
(1.湖南環境生物職業技術學院護理學院,湖南 衡陽 421005;2.南華大學附屬第一醫院腎內科,湖南 衡陽 421001)
目的探討水飛薊素膠囊對早期糖尿病腎病(DN)微量白蛋白尿的影響及作用機制。方法早期DN患者隨機分為水飛薊素組和安慰劑組,每組30例,分別予以水飛薊素膠囊和安慰劑治療,實驗前后測量患者血和尿丙二醛(MDA)、腫瘤壞死因子-α(TNF-α)、轉化生長因子-β1(TGF-β1)、尿白蛋白排泄率(UAER)、血壓及生化指標。結果12周后,兩組患者血壓及生化指標無明顯變化;與安慰劑組比較,水飛薊素組UAER顯著下降,血和尿TNF-α、MDA顯著降低,而血和尿TGF-β1比較差異無統計學意義。結論水飛薊素膠囊可以通過抑制MDA、TNF-α,降低早期DN的UAER,是一種治療早期DN的新藥物。
水飛薊素;糖尿病腎病;炎癥;氧化應激;微量白蛋白尿
微量白蛋白尿是早期糖尿病腎病(diabetic nephropathy,DN)的主要特征之一。激活的腎素-血管緊張素系統(renin-angiotensin system,RAS)是早期DN的主要發病機制,RAS系統阻滯是當前早期DN的主要治療方法。盡管RAS被抑制,但仍然有大量早期DN患者進展至臨床蛋白尿,意味著除RAS系統外,還有早期DN的其他發病機制。氧化應激和炎癥也被認為是早期DN的主要發病機制之一[1]。DN動物模型中,具有強大的抗氧化、抗炎及抗纖維化作用的水飛薊素可以緩解蛋白尿和DN的進展[2]。目前水飛薊素對早期DN患者微量白蛋白的影響鮮見報道,本實驗研究水飛薊素是否對早期DN患者微量白蛋白尿具有抑制作用,并探討其機制。
1 資料與方法
1.1 一般資料
選取2013年10月-2014年10月在南華大學附屬第一醫院住院或定期門診隨訪的DNⅢ期患者60例,尿白蛋白排泄率(urinary albumin excretion rate,UAER)持續20~200μg/min,血壓、血糖及血脂控制理想。排除標準:①存在非DN的腎臟疾病依據;②正在使用RAS系統阻滯劑治療;③難以控制的糖尿病,糖化血紅蛋白(hemoglobin A1c,HbA1c)>10%;④難以控制的高血壓,收縮壓>160 mmHg,或舒張壓>100 mmHg;⑤妊娠、吸煙及嗜酒;⑥使用其他抗氧化的藥物,如維生素C、維生素E;⑦存在嚴重心腦血管疾病或其他嚴重疾病。本實驗經本院倫理委員會通過,所有患者簽署知情同意書。
1.2 方法
60例2型DN患者維持以前藥物治療不變,采用隨機雙盲安慰劑對照方法,計算機隨機分為水飛薊素組和安慰劑組,每組30例,兩組患者年齡、性別、糖尿病病程、體重指數(body mass index,BMI)、血糖控制程度、高血壓、血脂等方面比較,差異無統計學意義,有可比性。水飛薊素組患者予以水飛薊素膠囊140 mg,3次/d;安慰劑組患者接受同等劑量的安慰劑治療。實驗進行12周,在實驗開始及結束時分別監測患者血壓、血和尿丙二醛(Malondialdehyde,MDA)、血和尿腫瘤壞死因子-α(tumor necrosis factor-α,TNF-α)、血和尿轉化生長因子-β1(transforminggrowthfactorβ1,TGF-β1)、UAER及相關生化指標。
1.3 檢測指標
空腹血糖(fasting plasma glucose,FPG)、低密度脂蛋白(low densith lipoprotein,LDL)、高密度脂蛋白(high density lipoprotein,HDL)及三酰甘油(triglyc eride,TG)用BECK全自動生化儀測定,HbA1c用高分辨層析柱法,尿白蛋白排泄率用化學發光法檢測,血和尿TNF-α、TGF-β1用酶聯免疫吸附法(enzyme-linked immunosorbent assay,ELISA)檢測(美國R&D公司試劑盒),血和尿MDA按試劑盒說明書檢測(購于南京建成生物工程研究所),標準袖帶血壓計測量患者清晨血壓3次,取均值。
1.4 統計學方法
采用SPSS 13.0統計軟件進行數據分析,計量資料以均數±標準差(±s)表示,用t檢驗,P<0.05為差異有統計學意義。
2 結果
2.1 兩組患者實驗前后的血糖、血脂、血壓及BMI比較
所有患者未出現不良反應,均完成實驗。實驗前后,水飛薊素組FPG、HbA1c、LDL、HDL、TG、收縮壓、舒張壓及BMI與安慰劑組比較,差異無統計學意義。實驗前后,水飛薊素組上述各項指標比較差異無統計學意義。實驗前后,安慰劑組上述各項指標比較差異無統計學意義。見表1~3。
表1 兩組患者實驗前后的血糖比較(±s)

表1 兩組患者實驗前后的血糖比較(±s)
組別FPG/(mmol/L)HbA1c/(%)實驗前實驗后實驗前實驗后P值水飛薊素組6.56±1.446.48±1.370.3267.41±1.1 77.46±1.080.411安慰劑組6.49±1.396.51±1.410.4217.39±1.027.28±1.1 40.398 P值0.8350.8140.8640.852 P值
2.2 兩組患者實驗前后的氧化應激、炎癥、纖維化指標及UAER比較
實驗前,兩組血和尿MDA、血和尿TNF-α、血和尿TGF-β1及UAER比較,差異無統計學意義。實驗后,水飛薊素組血和尿MDA、血和尿TNF-α及UAER較實驗前明顯減少,血和尿TGF-β1較實驗前減少,但差異無統計學意義;安慰劑組血和尿MDA、血和尿TNF-α、血和尿TGF-β1及UAER較實驗前比較,差異無統計學意義。實驗后水飛薊素組與安慰劑組比較,血和尿MDA、血和尿TNF-α及UAER顯著下降。見表4~6。
表2 兩組患者實驗前后的血脂比較(mmol/L±s)
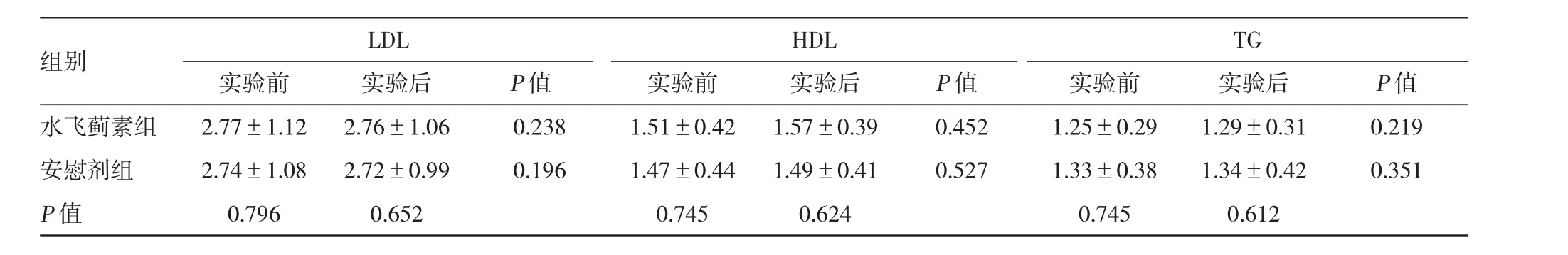
表2 兩組患者實驗前后的血脂比較(mmol/L±s)
組別LDLHDLTG實驗前實驗后實驗前實驗后實驗前實驗后P值水飛薊素組2.77±1.1 22.76±1.060.2381.51±0.421.57±0.390.4521.25±0.291.29±0.310.219安慰劑組2.74±1.082.72±0.990.1961.47±0.441.49±0.410.5271.33±0.381.34±0.420.351 P值0.7960.6520.7450.6240.7450.612 P值P值
表3 兩組患者實驗前后的血壓和BMI比較(±s)

表3 兩組患者實驗前后的血壓和BMI比較(±s)
組別收縮壓/mmHg舒張壓/mmHgBMI/(kg/m2)實驗前實驗后實驗前實驗后實驗前實驗后P值水飛薊素組137.5±13.2139.2±11.60.30184.2±8.384.0±7.926.6±5.026.4±4.80.165安慰劑組134.2±15.1139.5±18.30.15283.7±8.682.9±8.926.4±3.926.4±4.10.254 P值0.8320.8140.8050.8960.6510.716 P值P值
表4 兩組患者實驗前后的氧化應激指標比較(±s)
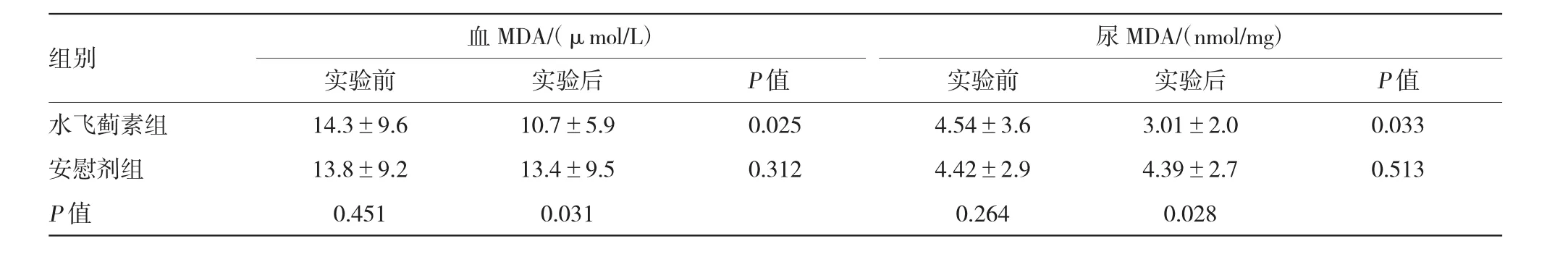
表4 兩組患者實驗前后的氧化應激指標比較(±s)
組別血MDA/(μmol/L)尿MDA/(nmol/mg)實驗前實驗后實驗前實驗后P值水飛薊素組14.3±9.610.7±5.90.0254.54±3.63.01±2.00.033安慰劑組13.8±9.213.4±9.50.3124.42±2.94.39±2.70.513 P值0.4510.0310.2640.028 P值
表5 兩組患者實驗前后的炎癥指標比較(pg/mgs)

表5 兩組患者實驗前后的炎癥指標比較(pg/mgs)
組別血TNF-α尿TNF-α實驗前實驗后實驗前實驗后P值水飛薊素組5.44±2.212.05±0.470.00810.1±7.406.70±3.120.005安慰劑組4.85±2.1 64.87±2.1 90.2279.42±6.759.38±6.670.211 P值0.3150.0020.4810.003 P值
表6 兩組患者實驗前后的纖維化指標和UAER比較(±s)

表6 兩組患者實驗前后的纖維化指標和UAER比較(±s)
組別血TGF-β1/(ng/mL)尿TGF-β1/(pg/mg)UAER/(mg/24 h)實驗前實驗后實驗前實驗后實驗前實驗后P值水飛薊素組19.8±7.719.2±7.10.08215.5±10.212.6±9.40.075138.14±67.1969.37±37.920.001安慰劑組18.7±6.719.3±7.20.31516.1±9.714.8±8.40.298132.81±65.24134.89±68.170.204 P值0.5370.6120.4610.3540.2830.002 P值P值
3 討論
水飛薊素是水飛薊或奶薊種子中的主要活性成分,是包含3種同分異構體(水飛薊賓、異水飛薊素和水飛薊亭)的親脂性提取物。其中水飛薊賓活性最高,占水飛薊素的50%~60%。從古代起,水飛薊素就發揮其強大的抗氧化、抗炎及抗纖維化特性,并應用于一些疾病的治療,尤其是肝病的治療[3]。本研究中,實驗前水飛薊素組與安慰劑組FPG、HbA1c、LDL、HDL、TG、收縮壓、舒張壓及BMI比較,差異無統計學意義;實驗前后兩組患者上述指標組內比較,差異無統計學意義。水飛薊素組與安慰劑組相比,UAER顯著下降,表明其不是由更好的血流動力學及代謝控制。兩組患者年齡、性別、糖尿病病程等指標比較,差異無統計學意義,可以排除該類因素對實驗結果的影響。兩組患者未使用維生素C、維生素E等抗氧化劑及RAS系統抑制劑,可以排除該藥物對實驗結果的干預。
DN的發病機制非常復雜,目前尚未完全闡明。血流動力學與代謝的紊亂,包括慢性高血糖、過多糖基化終產物誘導腎內反應性氧自由基及炎癥介質產生,抑制抗氧化防御機制,造成腎損傷,最終腎纖維化[4]。TNF-α是介導DN發病機制中的重要炎癥細胞因子之一[4]。已證實DN患者血和尿TNF-α水平較健康對照者或糖尿病非腎病患者明顯升高,且DN患者血和尿TNF-α水平與蛋白尿水平及DN病程密切相關[5]。在動物和人的體外實驗中,水飛薊素可以抑制腎組織TNF-α的產生,并且該抑制作用是通過抑制NF-ΚB途徑來實現[6]。本實驗中,水飛薊素組實驗后血和尿TNF-α較實驗前明顯下降,實驗后UAER較實驗前明顯降低,證明水飛薊素膠囊通過抑制血和尿TNF-α降低UAER。
氧化應激被認為是DN的重要發病機制,氧化應激紊亂促進腎細胞凋亡、老化,鈍化腎細胞再生能力,產生蛋白尿。大多數研究表明,抗氧化治療可抑制DN患者的氧化應激作用而降低蛋白尿,改善腎功能[7]。DN動物模型中,各種氧化應激標志物明顯升高,如DNA氧化破壞的標志物——8-羥脫氧鳥苷,脂質過氧化的標志物——MDA。據報道,DN患者的血和尿MDA較健康者或糖尿病非腎病患者明顯升高,并且與DN患者腎小球硬化和蛋白尿程度關系密切,呈正相關[8]。對于糖尿病并肝硬化患者,水飛薊素可以顯著降低血MDA水平[9]。在糖尿病動物模型中,水飛薊素可通過降低氧化應激標志物及恢復抗氧化酶的活性,阻止DN的進展[10],而且水飛薊素可以抑制糖基化終產物在糖尿病大鼠腎臟的形成及沉積[6]。本實驗發現,水飛薊素膠囊顯著地降低早期DN患者血和尿MDA水平并明顯減少UAER,表明抑制氧化應激誘導的腎臟損害可能是水飛薊素緩解早期DN患者蛋白尿的另一重要機制。
TGF-β1是細胞外基質的強力誘導者,通常被認為是DN發病機制中的中樞調節者,其主要介導腎小球硬化及腎間質纖維化[11]。有證據表明,DN患者血和尿TGF-β1水平明顯升高與蛋白尿程度及DN病程呈正相關[12]。據報道,一些新的治療降低DN患者蛋白尿水平的同時,也降低TGF-β1的水平[13],DN患者蛋白尿水平的下降幅度與TGF-β1降低程度呈正相關。本實驗發現,水飛薊素組血和尿TGF-β1水平較實驗前降低,但差異無統計學意義。由于本實驗樣本量小,觀察周期較短,水飛薊素膠囊對于早期DN患者血和尿TGF-β1的影響還需大樣本、較長周期的進一步研究。
[1]SINGH DK,WINOCOUR P,FARRINGTON K.Oxidative stress in early diabetic nephropathy:fueling the fire[J].Nat Rev Endocrinol,2011,7(3):176-184.
[2]KAUR G,ATHAR M,ALAM MS.Diatary supplementation of silymarin protects against chemically induced nephrotoxicity,inflammation and renal tumor promotion response[J].Invest New Drugs,2010,28(5):703-713.
[3]ABENAVOLI L,CAPASSO R,MILIC N,et al.Milk thistle in liver diseases:past,present,future[J].Phytother Res,2010,24(10): 1423-1432.
[4]NAVARRO-GONZALEZJF,MORA-FERNANDEZC,DE FUENTES MM,et al.Inflammatory molecules and pathways in the pathogenesis of diabetic nephropathy[J].Nat Rev Nephrol, 2011,7(6):327-340.
[5]FALLAHZADEN MK,DORMANESH B,SAQHEB MM,et al. Effect of addition of silymarin to renin-angiotens in system inhibitors on proteinuria in type 2 diabetic patients with overt nephropathy:a randomized,double-blind,placebo-controlled trial [J].Am J Kidney Dis,2012,60(6):896-903.
[6]WU CH,HUANG SM,YEN GC.Silymarin:a novel antioxidant with antiglycation and antiinflammatory properties in vitro and in vivo[J].Antioxid Redox Signal,2011,14(3):353-366.
[7]SMALL DM,COOMBES JS,BENNETT N,et al.Oxidative strss, anti-oxidant therapies and chronic kidney disease[J].Nephrology, 2012,17(4):311-321.
[8]RASHIDI A,NAKHJAVANI M,ESTEGHAMATI A,et al.Association between oxidant/antioxidantmarkers andproteinuria in type 2 diabetes:results in 142 patients[J].J Nephrol,2009,22(6): 733-738.
[9]FEHER P,UIHELVI Z,VECSERNYES M,et al.Hepatoprotective effects of a self-micro emulsifying drug delivery system containing Silybum marianum native seed oil against experimentally induced liver injury[J].Pharmazie,2015,70(4):231-238.
[10]SOTO C,PEREZ J,GARCIA V,et al.Effect of silymarin on kidney of rats suffering from alloxan-induced diabetes mellitus[J]. Phytomedicine,2010,17(14):1090-1094.
[11]TURGUT F,BOLTON WK.Potential new therapeutic agents for diabetic kidney disease[J].Am J Kidney Dis,2010,55(5):928-940.
[12]XIE S,LU K,ZHANG Y,et al.Effects of Jiangya xiaoke prescription on TGF-β1in diabetic nephropathy rats with hypertension and its mechanisms[J].Int J Clin Expmed,2015,8(4): 1519-1536.
[13]KHAJEHDEHI P,PAKFETRAT M,JAVIDNIA K,et al.Oral supplementation of turmeric attenuates proteinuria,transforming growth factor-β and interleukin-8 levels in patients with overt type 2 diabetic nephropathy:a randomized,double-blind and placebo-controlled study[J].Scand J Urol Nephrol,2011,45(5): 365-370.
(申海菊 編輯)
Effect of Silymarin capsules on microalbuminuria of early diabetic nephropathy
Li LI1,Qing-song WAN2,Hong-ping XIE2,Bo YANG2
(1.Department of Nursing,Hunan Environment-Biological Polytechnic,Hengyang,Hunan 421005,P.R.China;2.Department of Nephrology,the First Affiliated Hospital, University of South China,Hengyang,Hunan 421001,P.R.China)
【Objective】To investigate the effect of Silymarin capsules on microalbuminuria of early diabetic nephropathy and the mechanism.【Methods】Sixty early diabetic patients with nephropathy were randomly devided into Silymarin group and placebo group,which were treated with Silymarin capsules and matched placebo respectively.Serum and urinary levels of tumor necrosis factor-α(TNF-α),malondialdehyde (MDA),transforming growth factor-β1(TGF-β1),urinary albumin execretion rate(UAER),blood pressure and biochemical parameters were measured from baseline to the end of the treatment phase.【Results】After twelve weeks,there were no distinct changes in blood pressure or biochemical parameters in either group. UAER and serum and urinary levels of TNF-α and MDA significantly decreased in the Silymarin group compared with the placebo group;while there were no distinct differences in urinary and serum levels of TGF-β1between both groups.【Conclusion】Silymarin capsules reduce UAER by inhibiting MDA and TNF-α and may be considered as a novel drug in patients with early diabetic nephropathy.
Silymarin;diabetic nephropathy;inflammation;oxidative stress;microalbuminuria
R587.2
A
1005-8982(2015)29-0059-004
2015-05-04

