鹽酸右美托咪啶對腦膜瘤患者圍術期的腦保護效應
范偉衛(wèi)
河北保定市第三醫(yī)院麻醉科 保定 071000
腦膜瘤是常見的顱內良性腫瘤之一,發(fā)病率占顱內原發(fā)性腫瘤的15%,主要采用手術切除治療。開顱行腦膜瘤切除術時,由于清除病灶的同時對周圍相應區(qū)域的腦組織造成局部損傷,引起水腫、炎癥等引起局部腦組織的代謝異常,加重腦組織的缺血、缺氧性損傷[1]。鹽酸右美托咪啶(DEX)是一種新型的α2腎上腺素能受體激動劑,能抑制交感神經興奮,產生有效鎮(zhèn)痛、鎮(zhèn)靜作用,廣泛應用于臨床麻醉輔助用藥[2]。在手術麻醉輔助用藥中DEX的有效性和安全性較高,可通過多種生化途徑發(fā)揮腦保護作用。本研究采用DEX作為腦膜瘤手術患者的麻醉用藥,通過監(jiān)測其IL-6和NSE水平變化探討DEX對腦膜瘤圍術期的腦保護作用。現(xiàn)報道如下。
1 資料與方法
1.1 一般資料 經我院倫理委員會批準,選取2012-06—2013-06我院就診的擇期行腦膜瘤切除術患者50例為研究對象,所有患者均簽署知情同意書,均經CT、MRI或腦血管造影術確診,且生命體征均平穩(wěn),無其他心、肝、肺、腎等基礎疾病史。男28例,女22例;年齡36~65歲,平均(47.8±4.5)歲。采用隨機數(shù)字法將50例患者分成對照組和DEX組,每組25例,2組性別、年齡、體質等方面差異無統(tǒng)計學意義(P>0.05),具有可比性。
1.2 麻醉方法 所有患者術前8h禁食、4h禁水,術前30 min予阿托品0.5mg肌內注射。進入手術室后行右頸內靜脈穿刺置管采血,連續(xù)監(jiān)測心電圖、中心靜脈壓、平均動脈血壓、脈搏、血氧飽和度。研究組:手術開始前靜脈泵入右美托咪啶0.5μg/kg,以0.5μg/(kg·h)維持至手術結束。對照組:僅予同樣劑量生理鹽水泵入并維持至手術結束。2組手術開始前麻醉誘導一致:靜脈注射芬太尼3μg/kg、丙泊酚1.5mg/kg,依托咪酯0.3mg/kg,阿曲庫銨0.2mg/kg。麻醉誘導結束后5min行氣管插管機械通氣,設定潮氣量為8 mL/kg,呼吸頻率為12次/min,吸∶呼比為1∶2。手術結束后,患者意識清楚、呼吸恢復、呼吸頻率>10次/min后拔除氣管導管,予面罩吸氧并進行常規(guī)監(jiān)測。
1.3 標本采集及檢測方法 收集2組手術前24h(T1)、切開硬腦膜后(T2)、手術結束時(T3)和手術后24h(T4)4個時間點的靜脈血5min,靜置30min后,離心3 000r×10min,吸取上清存于EP管,并置于-80℃冰箱備測。采用電化學發(fā)光法對收集的血清樣品進行神經元特異性烯醇化酶(NSE)檢測,采用放射免疫法對血清樣品中的白介素-6(IL-6)水平進行檢測。
1.4 統(tǒng)計學處理 數(shù)據(jù)采用SPSS 15.0軟件進行統(tǒng)計學處理,計量資料用±s表示,比較采用t檢驗,組內均數(shù)比較采用方差分析,P<0.05為差異有統(tǒng)計學意義。
2 結果
2.1 2組不同時間點血清NSE水平比較 采用電化學發(fā)光法對2組不同時間點的血清NSE水平進行檢測,其中對照組在T2、T3、T4時刻NSE水平均較T1的血清水平升高(P均<0.05);DEX組在T3、T4的NSE水平較T1升高,差異有統(tǒng)計學意義(P均<0.05)。DEX組血清NSE水平在T1與對照組相比無顯著性差異(P>0.05),在T2、T3、T4時刻的NSE水平均明顯低于對照組,差異有統(tǒng)計學意義(P<0.05)。見表1。
表1 2組不同時間點血清NSE水平比較 (±s,μg/L)
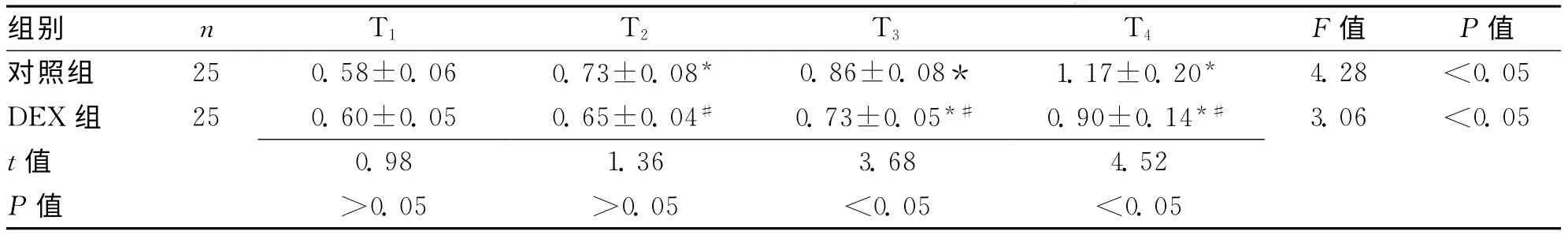
表1 2組不同時間點血清NSE水平比較 (±s,μg/L)
注:與T1比較,*P<0.05;與對照組比較,#P<0.05
組別 n T1 T2 T3 T4 F值 P值對照組 25 0.58±0.06 0.73±0.08* 0.86±0.08* 1.17±0.20* 4.28 <0.05 DEX組 25 0.60±0.05 0.65±0.04# 0.73±0.05*# 0.90±0.14*# 3.06 <0.05 t 值0.98 1.36 3.68 4.52 P值 >0.05 >0.05 <0.05 <0.05
2.2 2組不同時間點血清IL-6水平比較 采用放射免疫法對血清IL-6水平進行檢測,對照組血清IL-6水平隨著手術的進行明顯升高,T3時最高,且T2、T3、T4時刻的血清水平均明顯高于T1,差異有統(tǒng)計學意義(P均<0.05);DEX組IL-6水平亦隨著手術的進行逐漸升高,T3最高,T2、T4的水平較T1無顯著性差異(P>0.05),但明顯低于對照組(P均<0.05)。見表2。
表2 2組在不同時間點血清IL-6水平比較 (±s,μg/L)

表2 2組在不同時間點血清IL-6水平比較 (±s,μg/L)
注:與T1比較,*P<0.05;與對照組比較,#P<0.05
組別 n T1 T2 T3 T4 F值 P值對照組 25 67.15±30.15 128.03±34.26*401.45 ±188.33*272.85 ±143.66* 8.46 <0.05 DEX組 25 76.17±22.63 89.17±36.77#167.36 ±53.03*#92.45 ±15.85# 4.54 <0.05 t 值1.84 5.68 7.46 6.58 P值 >0.05 <0.05 <0.05 <0.05
3 討論
右美托咪啶作為一種高選擇性的α2腎上腺素能受體激動劑,藥代動力學特性穩(wěn)定,不僅具有鎮(zhèn)痛、鎮(zhèn)靜、催眠、抗交感興奮作用,且多項研究表明DEX具有重要的腦保護作用。Sanders等[3]發(fā)現(xiàn),DEX能抑制大鼠大腦缺血-再灌注損傷中神經元的凋亡。Maiert等[4]研究證實,DEX能明顯減輕短暫腦缺血兔模型中的腦皮質損傷。在Goyagi的短暫性腦缺血模型中發(fā)現(xiàn)DEX能減小腦梗死面積[5]。DEX的腦保護作用在分子水平的變化尚待進一步研究。
本次研究結果表明,DEX組的血清NSE及IL-6水平在T2、T3、T4時均明顯低于對照組,可能與其腦保護作用相關。腦膜瘤手術時造成的腦組織損傷誘發(fā)機體強烈的炎癥反應[6]。炎癥反應是機體的重要防御機制,適度的炎癥反應能有效保護機體的正常生理功能,過量的炎癥反應是繼發(fā)性腦損傷的重要機制[7]。DEX具有強大的抗炎作用,能夠有效抑制炎癥因子的釋放,降低其血清水平,其中IL-6是重要的炎癥因子之一。本次研究結果表明,DEX組的血清IL-6水平均低于對照組,其機制可能與DEX通過抑制去甲腎上腺素能神經元的興奮性,抑制兒茶酚胺的釋放相關[8]。NSE是糖酵解途徑中的關鍵酶,正常情況下血清NSE水平較低,當出現(xiàn)顱腦損傷時,神經元細胞水腫、損傷及軸索神經元被破壞,大量NSE釋放入血[9]。Cooper等[10]試驗證明NSE是判斷神經元細胞死亡數(shù)量的有效參考指標,不僅特異性高,而且敏感性好。DEX通過抑制炎癥因子的釋放,減輕炎癥反應對神經元細胞的損傷,發(fā)揮腦保護作用。
綜上所述,右美托咪啶對于腦膜瘤圍術期患者具有一定的腦保護作用,可能與抑制炎癥因子的釋放、減輕神經元細胞損傷相關,但具體作用機制尚待進一步研究。
[1]Luh C,Gierth K,Timaru-Kast R,et al.Influence of a brief episode of anesthesia during the induction of experimental brain trauma on secondary brain damage and inflammation[J].PLoS One,2011,6(5):e19 948.
[2]Nasrallah FA,Lew SK,Low AS,et al.Neural correlate of resting-state functional connectivity under alpha2adrenergic receptor agonist,medetomidine[J].Neuroimage,2014,84(2):27-34.
[3]Williams KA,Magnuson M,Majeed W,et al.Comparison of alpha-chloralose,medetomidine and isoflurane anesthesia for functional connectivity mapping in the rat[J].Magn Reson Imaging,2010,28(7):995-1 003.
[4]Duque FJ,Dominguez-Roldan JM,Martinez-Taboada F,et al.Effects of medetomidine and medetomidine-butorphanol on transcranial color-coded duplex ultrasonography in healthy dogs[J].Res Vet Sci,2013(2):95:648-653.
[5]Waelbers T,Peremans K,Vermeire S,et al.Effects of medetomidine and ketamine on the regional cerebral blood flow in cats:a SPECT study[J].Vet J,2012,192(1):81-88.
[6]Waelbers T,Peremans K,Vermeire S,et al.The effect of medetomidine on the regional cerebral blood flow in dogs measured using Technetium-99m-Ethyl Cysteinate Dimer SPECT[J].Res Vet Sci,2011,91(1):138-143.
[7]Ciobanu L,Reynaud O,Uhrig L,et al.Effects of anesthetic agents on brain blood oxygenation level revealed with ultra-high field MRI[J].PLoS One,2012,7(3):e32 645.
[8]Pawela CP,Biswal BB,Hudetz AG,et al.A protocol for use of medetomidine anesthesia in rats for extended studies using task-induced BOLD contrast and resting-state functional connectivity[J].Neuroimage,2009,46(4):1 137-1 147.
[9]Nasrallah FA,Tay HC,Chuang KH.Detection of functional connectivity in the resting mouse brain[J].Neuroimage,2014,86(3):417-424.
[10]Kalthoff D,Po C,Wiedermann D,et al.Reliability and spatial specificity of rat brain sensorimotor functional connectivity networks are superior under sedation compared with general anesthesia[J].NMR Biomed,2013,26(6):638-650.

