解淀粉芽孢桿菌黃曲霉毒素B1裂解酶的分離純化及鑒定*
蔡國林,徐銘乾,李秋,王珊珊,杜祖波,陸健
1(江南大學工業生物技術教育部重點實驗室,江蘇無錫,214122)
2(江南大學糧食發酵工藝與技術國家工程實驗室,江蘇無錫,214122)
3(江南大學 生物工程學院,江蘇 無錫,214122)4(山東魯花集團有限公司,山東萊陽,265200)
黃曲霉毒素是一類主要由黃曲霉(Aspergillus flavus)和寄生曲霉(Aspergillus parasiticus)產生的帶有一個氧雜萘鄰酮和一個雙呋喃環的強毒性次級代謝產物[1]。目前已經鑒定出的黃曲霉毒素有20多種,而黃曲霉毒素B1(Aflatoxin B1,AFB1)是糧食中最常見的,也是毒性最大的,被世界衛生組織定為1A類致癌物質[2]。
AFB1在糧食中的存在嚴重威脅著動物以及人體的健康,研究高效、安全降解AFB1已成為當前關注的熱點。在各種AFB1去除方法中,由于物理法和化學法存在破壞糧食的營養物質成分或造成化學物質殘留和影響適口性等不足,目前生物脫毒普遍被認為是最有前途的方法[3-4]。生物脫毒是指毒素分子上的毒性基團被微生物或是其代謝產物分解破壞,同時產生無毒降解產物的過程[5]。在自然界已經發現包括細菌,真菌(含酵母)在內的多種微生物能夠吸附真菌毒素或是分泌降解真菌毒素的物質,這些微生物的脫毒機理主要有:菌體細胞對毒素的吸附作用和發酵產生的酶對毒素的降解作用。
在前期研究中,我們篩選到1株不但能明顯抑制黃曲霉生長,且能高效降解AFB1的安全菌株,目前已保藏至中國普通微生物菌種保藏管理中心,命名為解淀粉芽孢桿菌CGMCC-9021。對解淀粉芽孢桿菌CGMCC-9021降解AFB1的特性研究發現,AFB1的降解不是依賴菌體吸附,而是由于其代謝產生的胞外活性物質,這種活性物質是一種蛋白質[6]。本研究將通過硫酸銨沉淀、陰離子交換色譜和凝膠過濾色譜分離純化該活性物質,并通過質譜對其進行鑒定,為今后的高效生產提供理論依據。同時,采用熒光色譜技術初步分析裂解酶對AFB1的降解機理。
1 材料與方法
1.1 菌種
解淀粉芽孢桿菌CGMCC-9021由江南大學糧食發酵工藝與技術國家工程實驗室分離,并保藏至中國普通微生物菌種保藏管理中心。
1.2 培養基
牛肉膏 5 g/L,蛋白胨 10 g/L,NaCl 5 g/L,葡萄糖 10 g/L,pH 7.0。
1.3 發酵液制備及硫酸銨沉淀
解淀粉芽孢桿菌CGMCC-9021經活化后,接種至培養基中,37℃,200 r/min振蕩培養48 h。發酵液經5 000 r/min離心10 min后,取上清液進行硫酸銨分級沉淀。4℃,10 000 r/min離心10 min,將各個部分沉淀蛋白用20 mmol/L磷酸鹽緩沖液(pH 7.0)復溶,透析過夜,之后加入4 μg/mL的 AFB1,使其最終含量為100 ng,最終質量濃度達到20 μg/L。37℃,200 r/min振蕩反應72 h,測定各個部分沉淀蛋白對AFB1的降解效果,選取降解效果最明顯的部分作為活性物質的蛋白粗提液。
1.4 陰離子交換色譜
透析后的蛋白粗提液通過0.22 μm微孔濾膜過濾。將過濾后的蛋白溶液,上樣于HiPrep 16/10 DEAE FF離子交換柱(預裝柱),用磷酸鹽緩沖液(20 mmol/L、pH 7.0)沖洗,然后用含1 mol/L NaCl的磷酸鹽緩沖液(20 mmol/L、pH 7.0)進行恒梯度洗脫,流速5 mL/min,每管收集2 mL。以洗脫體積為橫坐標,以280 nm吸收值為縱坐標繪圖。并收集主要吸收峰對應的蛋白質溶液,測定其對AFB1的降解效果。
1.5 凝膠過濾色譜
收集陰離子交換色譜后檢測有AFB1降解能力的蛋白質溶液,上樣于Superdux 75 10/300GL凝膠過濾層析柱(預裝柱),用磷酸鹽緩沖液(20 mmol/L、pH 7.0)進行沖洗,流速0.5 mL/min,每管收集1 mL。以洗脫體積為橫坐標,以280 nm吸收值為縱坐標繪圖。并收集主要吸收峰對應的蛋白質溶液,測定其對AFB1的降解效果。最后,收集具有降解AFB1活性的部分,進行Tricine-SDS-PAGE鑒定和質譜分析。
1.6 蛋白含量測定
采用考馬斯亮藍G250法測定蛋白質濃度,以牛血清蛋白標準液制作標準曲線。
1.7 Tricine-SDS-PAGE
Tricine-SDS-PAGE 檢測方法參照孫雪文等[7],凝膠制作采用3層不連續膠的系統,先灌下邊的分離膠和夾層膠,然后鋪水層,膠凝固后,除去水層,灌制上面的濃縮膠,小心插入梳子,靜置。內槽加入負極電泳緩沖液,外槽加入正極電泳緩沖液,開始時電壓為40 V,待樣品完全離開樣品孔后,70 V恒壓電泳至結束。將膠放入固定液(50%甲醇,10%乙酸)中固定30 min后染色1.5 h,脫色過夜。
1.8 質譜鑒定(MALDI-TOF/TOF)
取Tricine-SDS-PAGE膠上目標條帶,進行手動切膠,將挖取的蛋白點凝膠轉移至EP管中,加入200 μL脫色液(30%乙腈/0.1%TFA的碳酸氫銨溶液),振蕩脫色至膠粒呈無色。棄掉脫色液,膠粒用50 μL的乙腈脫水2次,得到白色膠粒。每個脫水后的膠粒加入5 μL胰蛋白酶溶液,置于4℃吸收30~60 min,使膠粒充分吸脹,結束后吸出未被吸收的酶液,加入20 μL、25 mmol/L碳酸氫銨溶液覆蓋膠粒,37℃水浴酶解20 h。酶解液吸出后加到新的EP管中,原管中加入20 μL、60%乙腈/0.1%TFA 萃取液,超聲15 min,凍干備用。
凍干的酶解樣品用 3 μL、0.1%TFA復溶,將0.7 μL CHCA基質溶液與0.7 μL酶解液先后點在Anchorchip靶板中心的疏水區。再用2 μL,0.1%TFA進行脫鹽。一級質譜采用正離子模式,二級質譜分析幾個強度較高的一級圖譜峰,用Mascot軟件(http://www.matrixscience.com)在NCBInr數據庫中對蛋白質的質譜數據進行搜索匹配,Mascot分值大于59即可認定物質鑒定有效[8]。
1.9 AFB1降解產物的熒光光譜分析
將 25 μL AFB1標準溶液,975 μL 無菌的降解AFB1的活性物質溶液加入棕色反應瓶中,使得混合溶液中AFB1的質量濃度為1 000 ng/mL,37℃避光反應0,1,3 d。3倍體積于反應液的三氯甲烷進行液相萃取AFB1,之后加入1.5 mL 50%的甲醇水溶液振蕩溶解,在365 nm的激發波長下測定不同反應條件下的 AFB1熒光強度[9]。
2 結果與討論
2.1 硫酸銨沉淀
取100 mL 發酵液分別進行以下梯度的硫酸銨分級沉淀:0% ~20%,20% ~40%,40% ~60%,60% ~80%和80%~完全飽和,測定各個部分沉淀蛋白對AFB1的降解效果,結果見圖1。
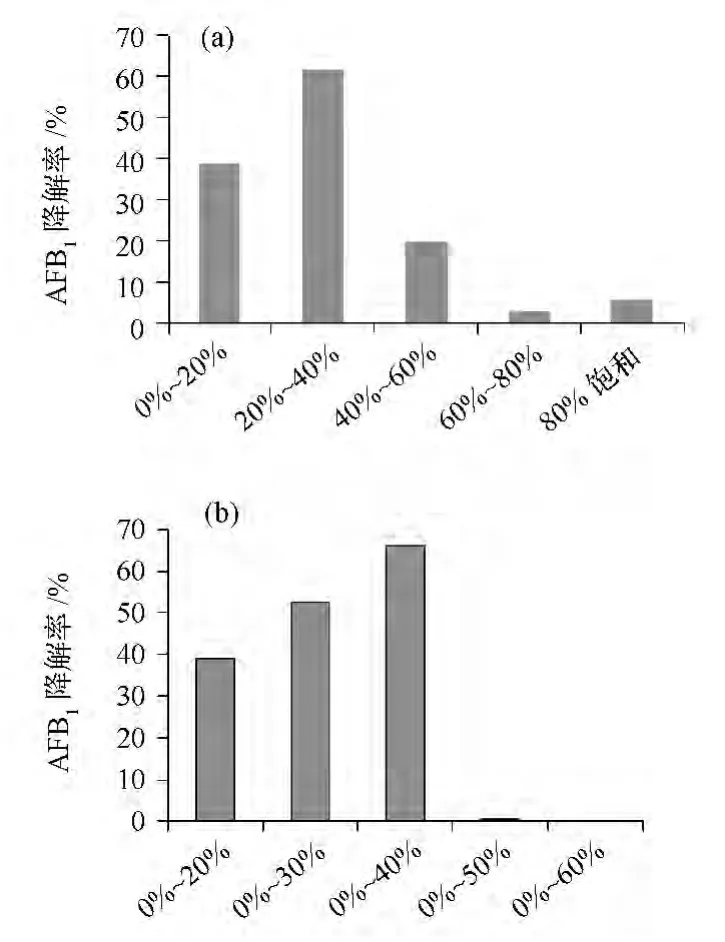
圖1 硫酸銨分級沉淀各部分對AFB1的降解作用Fig.1 Ammonium sulfate precipitation classification effect on degrading AFB1
從圖1(a)中可以發現0% ~20%,20% ~40%,40%~60%沉淀區間蛋白溶液都具有較高的降解AFB1活性,說明降解AFB1的活性物質在0% ~60%的沉淀區間內,由于沉淀區間過寬會造成雜蛋白的過多帶入,所以需要對該區間進一步的分級,以求獲得最優化的沉淀區間。對0%~60%的沉淀區間進一步分級沉淀,測定各個部分沉淀蛋白對AFB1的降解效果,結果如圖1(b)所示。從圖1(b)中可以發現0%~40%硫酸銨沉淀區間的蛋白溶液具有更強的降解AFB1能力,說明活性物質在該區間得到更好的分離。而且隨著硫酸銨沉淀度的不斷增加,0% ~50%、0%~60%沉淀區間蛋白對AFB1的降解活性急劇下降,幾乎檢測不到相應活性,說明降解AFB1的活性物質不能夠耐受高濃度的鹽溶液,在該環境下使其失去降解AFB1的活性。
2.2 陰離子交換色譜
將40%硫酸銨沉淀的蛋白粗提液通過0.22 μm微孔濾膜后,采用HiPrep 16/10 DEAE FF色譜柱(柱體積為20 mL,上樣量為30 mL)進行分離純化,用磷酸鹽緩沖液(20 mmol/L,pH 7.0)沖洗,然后用含1 mol/L NaCl的磷酸鹽緩沖液(20 mmol/L,pH 7.0)進行恒梯度洗脫,設定流速為5 mL/min,每管收集2 mL,繪制對應的OD280圖譜如圖2所示。
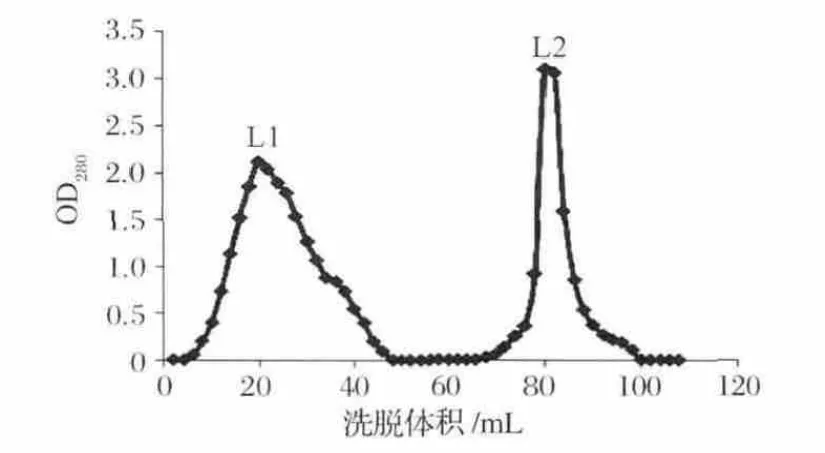
圖2 HiPrep 16/10 DEAE FF色譜柱色譜洗脫圖譜Fig.2 Chromatography of active substance on HiPrep 16/10 DEAE FF
從圖2可以看出蛋白粗提液經離子交換色譜層析后得到2個色譜峰,且獲得了較好的分離效果。收集離子交換色譜峰1、2對應的蛋白質溶液,分別命名為L1、L2。分別加入 4 μg/mL 的 AFB1,使其最終含量為100 ng,37 ℃,200 r/min振蕩反應 72 h,測定L1、L2對AFB1的降解情況。其中,L2具有較高的降解AFB1的活性,其降解率為80.3%,L1的降解率為17.0%。因此,降解AFB1的活性物質主要集中于第2個色譜峰,收集第2個色譜峰,并對其蛋白濃度、體積進行測定,儲存于4℃以備用。
2.3 凝膠過濾色譜分析
將離子交換色譜的L2(第2個色譜峰)所收集的蛋白溶液通過0.22 μm微孔濾膜后,采用Superdux 75 10/300GL(柱體積為25 mL,上樣量為0.5 mL),用磷酸鹽緩沖液(20 mmol/L,pH 7.0)進行沖洗,設定流速為0.5 mL/min,每管收集1 mL,以洗脫體積為橫坐標,以280 nm吸收值為縱坐標繪圖,得到對應的OD280圖譜如圖3所示。通過凝膠過濾色譜的進一步分離純化將原有的L2色譜峰分離為4個色譜峰,且獲得了較好的分離效果。收集凝膠過濾色譜峰1、2、3、4 對應的蛋白質溶液,分別命名為 N1、N2、N3、N4。分別加入4 μg/mL的 AFB1,使其最終含量為100 ng,37 ℃,200 r/min振蕩反應 72 h,測定其對AFB1的降解效果,其中N3具有明顯降解AFB1的活性,其降解率為32.4%。收集第3個色譜峰,并對其蛋白濃度、體積進行測定,儲存于4℃以備用。
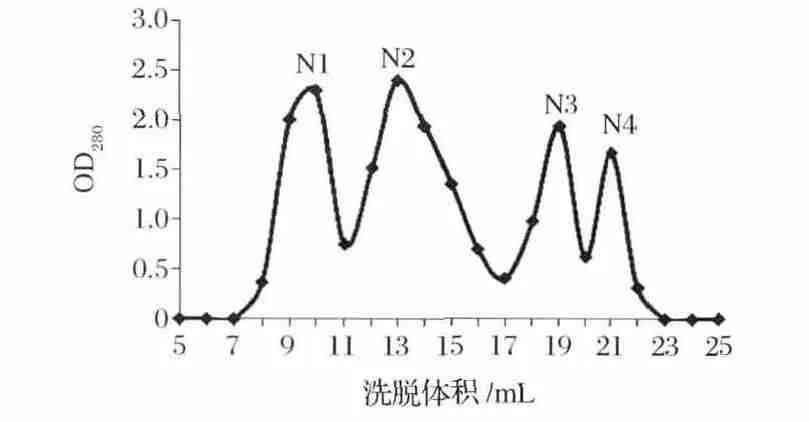
圖3 Superdux 75 10/300GL色譜柱色譜洗脫圖譜Fig.3 Chromatography of active substance on Superdux 7510/300GL
2.4 Tricine-SDS-PAGE分析
收集分離純化的各個步驟中具有降解AFB1活性的成分進行Tricine-SDS-PAGE分析,電泳結果如圖4所示。
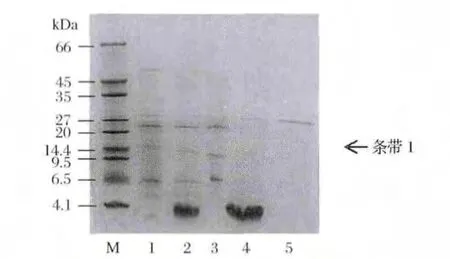
圖4 Tricine-SDS-PAGE圖譜Fig.4 The map of Tricine-SDS-PAGE
從Tricine-SDS-PAGE圖譜上可以看出5個泳道中均具有1條共有的條帶,而且N3只有該條帶本身,說明其可能為降解AFB1的活性物質,且分子質量為27 ku左右。
2.5 降解AFB1活性物質的質譜鑒定
對Tricine-SDS-PAGE泳道5中的蛋白條帶1挖點后進行酶切,然后將其進行串聯質譜(MALDITOF/TOF)分析和蛋白數據庫(NCBInr)檢索,匹配結果見表1,質譜分析見圖5。該蛋白點鑒定結果為lytic enzyme L27[Bacillus subtilis](登錄號為 gi|3986320),其匹配總得分為494,蛋白質分子質量(Mr)為27 479,蛋白質等電點(pI)為6.65。劉玉嶺[10]對具有抗菌能力的解淀粉芽孢桿菌的活性物質進行蛋白質分離純化,獲得lytic enzyme L27和beat-1,3-1,4-glucanase兩種均具有抗菌活性的蛋白。裂解酶主要作用于肽聚糖上的糖苷鍵和肽鍵,其中酰胺酶和肽鏈內切酶水解肽側鏈和交聯橋之間的氨基或肽鍵連接,同時因為肽聚糖的酰胺連接和氨基糖之間的β-1,4糖苷鍵連接在細菌種間往往是保守的,所以其相應的裂解酶就具有更廣的裂解譜[11]。目前關于裂解酶的研究主要是集中于抗菌的研究中,該酶對于AFB1等毒素裂解作用的研究未見報道。
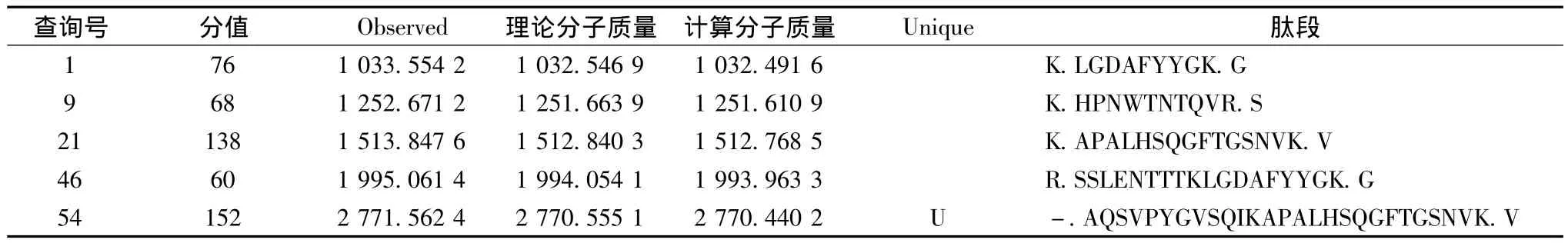
表1 質譜分析中匹配的肽段序列信息Table 1 The information of match peptide sequence by mass spectrometry analysis
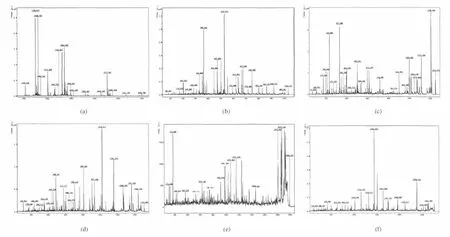
圖5 蛋白質的質譜分析結果Fig.5 The analysis maps of mass spectrometry
2.6 解淀粉芽孢桿菌裂解酶降解AFB1的可能機理
AFB1本身具有熒光特性,在紫外光照射下可發出藍色或紫色熒光。而其熒光特性與其化學結構相關。AFB1經過解淀粉芽孢桿菌裂解酶的不同時間處理后,其熒光特性發生了明顯的改變,隨著反應時間的增加,AFB1的熒光特性不斷降低,也即其降解產物的化學結構發生了改變,熒光特性消失,如圖6所示。Lee等[12]發現改變AFB1的戊酮環、呋喃環及內酯環上取代基的結構,不會影響AFB1熒光特性,而內酯環結構打開后,AFB1熒光特性消失;另外對AFB1以及失去內酯環結構后的AFD1的致突變性和毒性進行對比研究,通過Ames實驗發現AFD1的致突變能力幾乎消失,比AFB1降低450倍,而雞胚的毒性試驗發現AFD1的毒性降低18倍,所以內酯環為AFB1的主要毒性結構,其結構的改變也使得AFB1的毒性和致突變能力大大降低。另外,篩選降解AFB1的解淀粉芽孢桿菌CGMCC-9021時采用的培養基是以香豆素為唯一碳源,香豆素是所有黃曲霉毒素的基本分子結構,能夠利用香豆素生長的微生物也能分解AFB1,而內酯環結構是香豆素與AFB1共有的可能改變的結構。因此解淀粉芽孢桿菌裂解酶對AFB1的作用位點可能是內酯環結構,如圖7所示,需要進一步實驗證實。
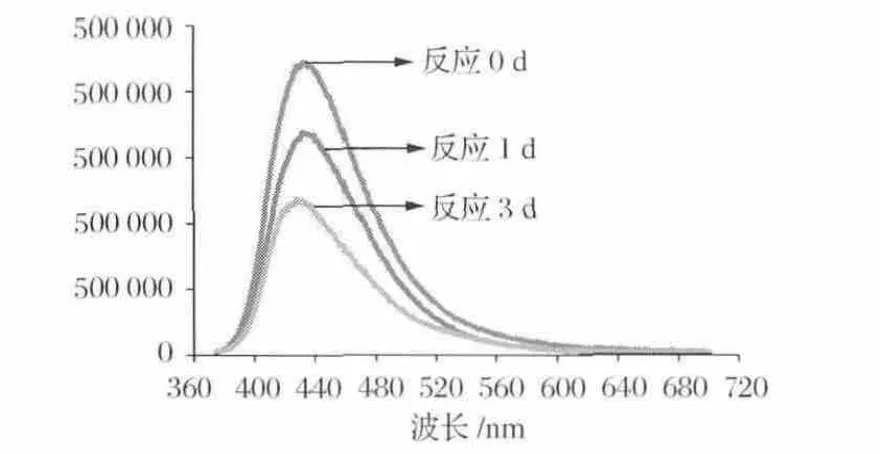
圖6 解淀粉芽孢桿菌裂解酶對AFB1熒光特性的影響Fig.6 Effect of lytic enzyme on emission spectra of AFB1
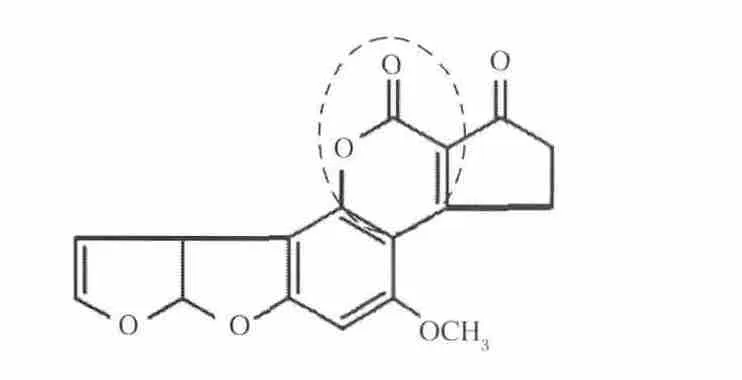
圖7 解淀粉芽孢桿菌裂解酶對AFB1的可能作用位點Fig.7 Possible action site of lytic enzyme on AFB1biodegradation
3 結論
通過硫酸銨分級沉淀、DEAE FF陰離子交換層析和Superdux 75凝膠過濾層析等一系列的蛋白質分離純化以及Tricine-SDS-PAGE和質譜鑒定獲得降解AFB1的活性物質為一種分子質量(Mr)約為27ku,蛋白質等電點(pI)為6.65的解淀粉芽孢桿菌裂解酶(lytic enzyme)。通過熒光光譜對經過解淀粉芽孢桿菌裂解酶不同時間處理后AFB1進行分析,發現隨著反應時間的增加,AFB1的熒光強度不斷降低,也即改變了AFB1原有結構中的內酯環,熒光特性消失,與此同時其毒性消失,實現了對AFB1的真正降解。
[1] Mishra H N,Das C.A review on biological control and metabolism of Aflatoxin[J].Critical Reviews in Food Science and Nutrition,2003,43(3):245-264.
[2] 計成.霉菌毒素與飼料食品安全[M].北京:化學工業出版社,2007.
[3] 李超波,李文明,楊文華,等.降解黃曲霉毒素微生物篩選中降解與吸附結合作用的區分[J].食品與發酵工業,2012,38(5):17-21.
[4] 孫豐芹,金青哲,王興國,等.去除黃曲霉毒素B1的菌株篩選[J].食品與生物技術學報,2011,30(2):273-277.
[5] 孫玲玉,柴同杰.黃曲霉毒素生物降解的研究進展[J].山東農業大學學報(自然科學版),2012,43(4):645-647.
[6] 徐銘乾,蔡國林,朱德偉,等.黃曲霉毒素B1脫毒菌株的分離鑒定及在花生粕中的應用[J].中國油脂,2015,40(3):20-24.
[7] 孫雪文,周金燕,鄧洪淵,等.有效分離1 kDa分子量環脂肽的電泳方法[J].生物技術,2005(6):47-49.
[8] 孫鵬飛.醬油二次沉淀中蛋白質的初步分離[D].無錫:江南大學,2014.
[9] 徐丹.釀造醬油中黃曲霉毒素B1的產生及其控制研究[D]:無錫:江南大學,2012.
[10] 劉玉嶺.芽孢桿菌抗菌蛋白lytic enzyme L27和B-1,3-1,4-glucanase抗菌協同作用研究[D].重慶:西南大學,2007.
[11] 王琰,陸承平.噬菌體裂解酶的抗菌特性[J].微生物學報,2009(10):1 277-1 281.
[12] Lee L S,Dunn J J,DeLucca A J,et a1.Role of lactone ring of aflatoxin B1in toxicity and mutagenicity[J].Cellular and Molecular Life Sciences,1981,37(1):16-17.

