絲狀真菌三孢布拉霉產番茄紅素發酵條件優化*
羅瑋,周雅,鞏尊洋,杜瑤,顧秋亞,余曉斌
(江南大學生物工程學院糖化學與生物技術教育部重點實驗室,江蘇無錫,214122)
番茄紅素是是一種脂溶性的不飽和碳氫化合物,性質非常活潑,具有極強的抗氧化和清除自由基能力,被廣泛應用于食品、醫藥和化妝品領域[1-2]。在自然界中含有番茄紅素量比較高的有番茄、番石榴、西瓜、紅色的葡萄柚等紅色水果,尤其番茄中的番茄紅素占其類胡蘿卜素總量的80%左右。除此以外,許多絲狀真菌如布拉克須霉[3]、卷枝毛霉[4]和三孢布拉霉[5]中也含有大量的番茄紅素,其含量遠超過植物中番茄紅素含量水平。且微生物的生長和代謝不受氣候和土地等資源制約,可以大規模培養。目前已經在三孢布拉霉中實現了β-胡蘿卜素的工業化生產,因此通過絲狀真菌的規模化培養有望實現番茄紅素的大規模生產。
三孢布拉霉是一種絲狀真菌,屬于霜霉目、藻狀菌綱、白銹科,拉丁名是 Blakeslea trispora,是一種雌雄異體的接合菌。三孢布拉霉對營養要求簡單、生長速度快且類胡蘿卜素含量高,使其成為生產番茄紅素的理想菌株[6-7]。三孢布拉霉有正負菌之分,負菌是番茄紅素的主要生產者。番茄紅素是三孢布拉霉合成β-胡蘿卜素的一種中間代謝產物,要實現番茄紅素在胞內累積,必須添加番茄紅素環化酶抑制劑阻斷番茄紅素被進一步轉化成β-胡蘿卜素。
本研究以本實驗室選育獲得的一株番茄紅素高產突變株為對象,通過優化發酵培養基和其他關鍵參數,以期進一步提高其番茄紅素產量,為工業化生產番茄紅素奠定良好基礎。
1 材料與方法
1.1 儀器和試劑
儀器:恒溫培養箱、可見光分光光度計、恒溫搖床、pH儀、離心機、抽濾機、高壓蒸汽滅菌鍋、旋轉真空干燥器等。
試劑:番茄紅素標準品購于Sigma公司,磷酸二氫鉀、七水硫酸鎂、棉籽油、二甲基咪唑、石油醚、二氯甲烷均為分析純。
1.2 菌種和培養基
三孢布拉霉菌(B.trispora)高產突變株ZY通過常壓室溫等離子誘變系統選育獲得,由本實驗室保藏。
各種培養基如下:
固體培養基:麥汁4°,瓊脂粉20 g/L。
種子培養基:玉米粉25 g/L,黃豆粉50 g/L,KH2PO41.5 g/L,MgSO4·7H2O 0.5 g/L,pH 6.3,121 ℃滅菌20 min。
發酵培養基:玉米粉50 g/L,黃豆粉25 g/L,KH2PO41.5 g/L,MgSO4·7H2O 0.5 g/L,pH 6.3,棉籽油30 g/L,121℃滅菌20 min。
1.3 培養方法
種子培養:在無菌條件下,將三孢布拉霉正負孢子(正菌104個孢子/mL,負菌105個孢子/mL)分別接入種子培養基,在25℃,180 r/min的條件下,培養48 h。
發酵培養:將生長旺盛的正負菌種子液按1∶5的比例在無菌的條件下混合,再以20%的接種量接入發酵培養基,在25℃,180 rpm的條件下,培養120 h,在培養48 h時添加0.1 g/L 2-甲基咪唑。
1.4 分析方法
發酵120 h之后,收集菌絲體用蒸餾水洗滌后紗布過濾,40℃真空干燥過夜。干燥后在天平上準確稱量。取適量干菌絲體加石英砂研磨破碎菌絲體,用石油醚抽提至菌體無色,合并抽提液,適當稀釋后于502 nm下測定吸光值,根據標準曲線計算番茄紅素含量。
1.5 正交試驗設計方法
本研究設計了4因素3水平的正交試驗,其因素及水平安排如表1所示。
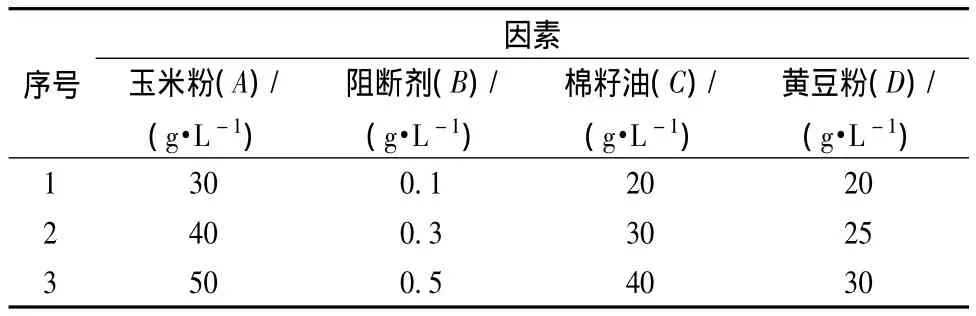
表1 各個因素梯度設計Table 1 The design of factors and level
2 結果與討論
2.1 培養基中碳源的影響
碳源對微生物生長代謝以及產物合成至關重要,不同微生物對碳源的利用度和代謝能力也不盡相同。本實驗選擇了幾種常見的單糖、二糖、寡糖以及多糖(葡萄糖、蔗糖、低聚麥芽糖、玉米粉、可溶性淀粉)作為代表,分別添加至發酵培養基中,保持培養基其他成份相同,對三孢布拉霉分別利用這5種碳源合成番茄紅素的能力進行了比較。由該圖2所示,多糖比單糖在促進菌體生長和番茄紅素含量上效果要好。絲狀真菌大多合成含量豐富的淀粉酶類,能夠高效利用淀粉類碳源。同時,從圖1中可以看出添加玉米粉的發酵效果要優于可溶性淀粉。這是因為三孢布拉霉是一種高度嗜黏微生物,因此培養基中添加玉米粉等固形物有利于菌絲體附著和生長以及番茄紅素累積。Papaioannou等[8]也對三孢布拉霉的底物進行了研究,他們選擇葡萄糖、乳糖和淀粉作為代表,發現三孢布拉霉能更有效利用淀粉和乳糖合成類胡蘿卜素,尤其是采用淀粉作為碳源能夠有效增加細胞干重和番茄紅素生產強度,其作用機理可能在于淀粉是一種緩釋性碳源,其在三孢布拉霉胞內多種淀粉酶作用下緩慢釋放出單糖避免了分解代謝組阻遏效應。
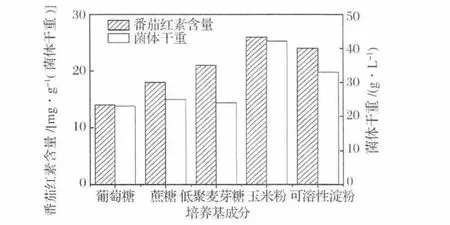
圖1 不同碳源對發酵的影響Fig.1 Effect of different carbon sources on lycopene fermentation
2.2 培養基中氮源影響
本實驗同時考查了幾種氮源(玉米漿、黃豆粉、酵母膏、NaNO3和(NH4)2SO4對三孢布拉霉合成番茄紅素含量及生物量的影響。從圖2可以看出,有機氮源對菌體生長和番茄紅素合成效果要優于無機氮源,其中黃豆粉效果最好,其生物量及番茄紅素的產量均比其他4種氮源更高。因此選擇黃豆粉作為番茄紅素發酵培養基的氮源。
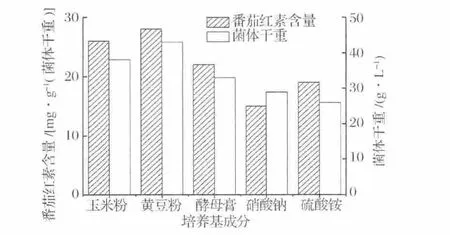
圖2 不同氮源對發酵的影響Fig.2 Effect of different nitrogen sources on lycopene fermentation
2.3 不同油對番茄紅素產量的影響
分別考察了花生油、棉籽油、葵花籽油、大豆油以及菜籽油對三孢布拉霉發酵的影響。從圖3可以看出,油類均能有效促進生物量和番茄紅素產量累積,其中棉籽油效果最好。Mantzouridou等[9]發現添加粗橄欖油和大豆油到葡萄糖為碳源的培養基中,能大幅提高三孢布拉霉類胡蘿卜素含量。Vereschagina等[10]也研究發現添加亞油酸特別是亞麻酸含量豐富的油類能顯著提高三孢布拉霉發酵產番茄紅素水平,其作用機理可能是外源油脂添加使絲狀真菌三酰甘油中多不飽和脂肪酸比例增加,從而增加了番茄紅素在其脂質體中的溶解度而促進其大量累積。棉籽油和葵花籽油中的多不飽和脂肪酸含量要比其他油類更為豐富,在本實驗中這2種油促進番茄紅素合成效果最好,這與上述研究結果一致。
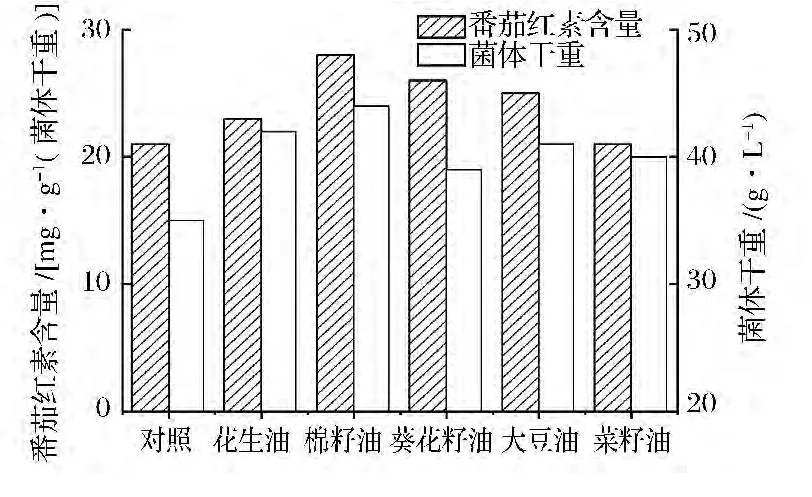
圖3 不同油對發酵的影響Fig.3 Effect of different oils on lycopene fermentation
2.4 接種量和正負菌比例對番茄紅素產量的影響
本實驗對三孢布拉霉在發酵培養基中的接種量以其正負菌比例對發酵的影響作了分析,從圖4a中可以看出當接種量為10%時,番茄紅素的含量最高。因此在發酵時應該選擇10%的接種量進行發酵。另外,從圖4b中可以發現當正菌量少于負菌量,即兩者比例小于1時更有利于番茄紅素的合成,這是因為三孢布拉霉的負菌為番茄紅素的主要生產者,正菌主要起刺激性激素三孢酸合成的作用,三孢酸則在三孢布拉霉合成類胡蘿卜素過程中起重要作用[11]。同時,當正負菌比例為 1∶5時,番茄紅素的含量最高。Varzakakou等[12]研究了三孢布拉霉正負菌比例對其累積β-胡蘿卜素的影響,其設置正負菌的比例從100∶1到1∶100,發現正菌量高于負菌量時番茄紅素含量降低,正負菌比例維持在1∶10時其β-胡蘿卜素的含量最高。
2.5 利用正交試驗優化番茄紅素發酵條件
根據上述試驗結果,外加碳源、氮源和油類分別以玉米粉、黃豆粉和棉籽油對番茄紅素的累積效果最好,本研究進一步考察其最適濃度,同時阻斷劑2-甲基咪唑濃度對番茄紅素合成可能產生較大影響。本試驗選取上述4因素進行正交試驗,具體的實驗設計見表1,每組實驗設置兩個平行,試驗結果取其平均值。
2.5.1 極差分析
表2中的K1、K2、K3分別表示在各因素各水平下菌株ZY合成番茄紅素含量的總和,k1、k2、k3分別表示在各因素各水平下番茄紅素含量的平均值。用同一因素各水平下平均番茄紅素含量的極差R(極差=平均含量的最大值-平均含量的最小值)來反映各因素的水平變動對含量影響的大小。極差大就表示該因素的水平變動對試驗結果的影響大,極差小就表示該因素的水平變動對試驗結果的影響小。
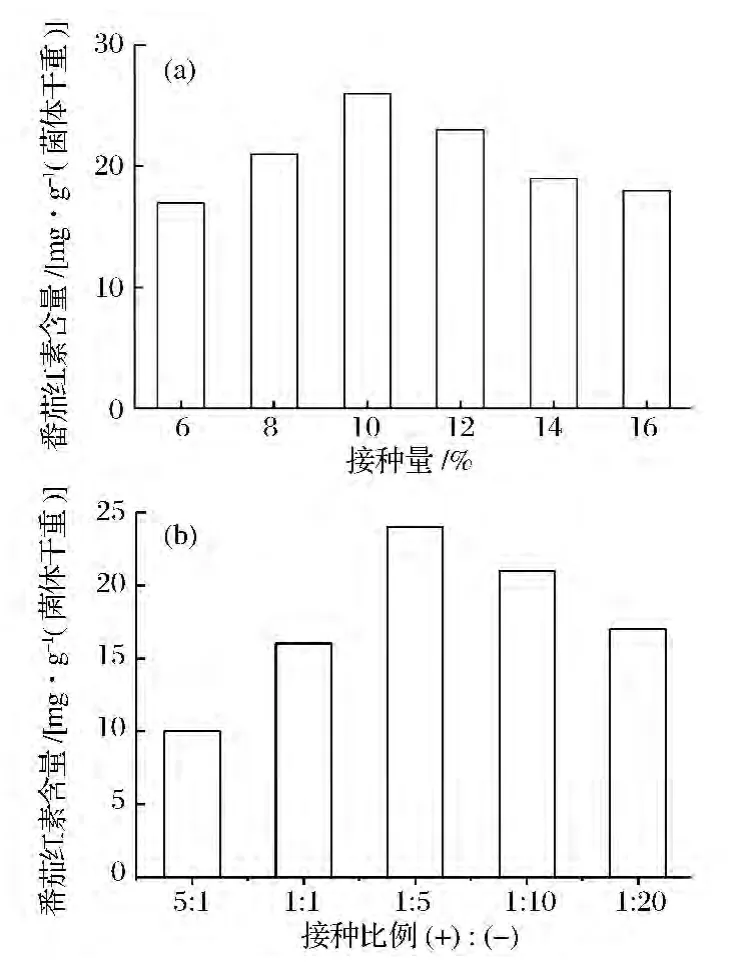
圖4 接種量(a)和正負菌比例(b)對番茄紅素發酵的影響Fig.4 Effects of inoculum size and ratio of(+)and(-)mating type of B.trispora on lycopene fermentation
由表2得到本次實驗因素的主次順序依次為:阻斷劑、棉籽油、玉米粉、黃豆粉。同時可以得到各因素的最佳組合為 A3B3C2D2,即玉米粉50 g/L、阻斷劑0.5 g/L、棉籽油30 g/L、黃豆粉25 g/L。按此搭配的試驗在正交表的9次試驗中并沒有出現,需要做補充試驗進行驗證。
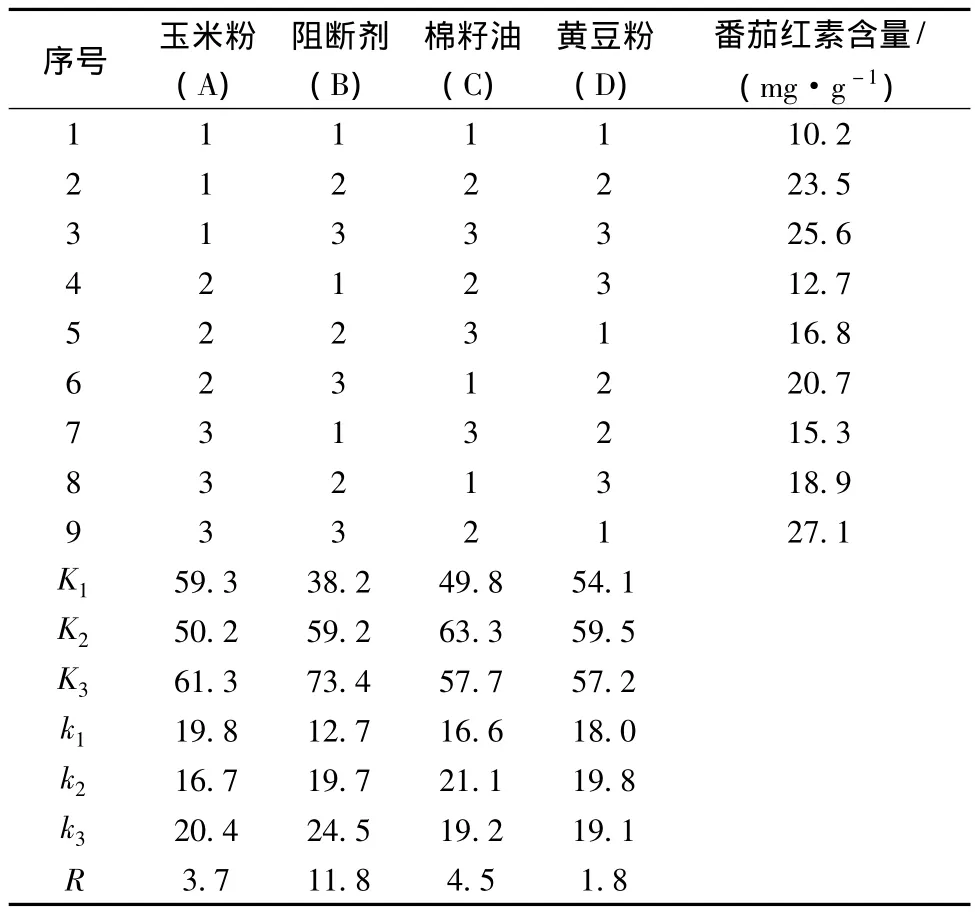
表2 正交實驗結果Table 2 The result of orthogonal test
2.5.2 方差分析
正交試驗的極差分析法簡便、直觀、計算量小,但不能估計試驗誤差,即不能區分試驗結果的差異是由各因素的水平變化而導致,還是由試驗的隨機波動而導致。為了解決此問題,需要對試驗結果做方差分析。對上述試驗結果采用Excel軟件做了方差分析,結果如表3所示。由表3可知各因素對試驗結果的影響程度,阻斷劑對結果影響最大,棉籽油次之,玉米粉再次之,而最后是黃豆粉,這個結果與極差分析的結果一致。
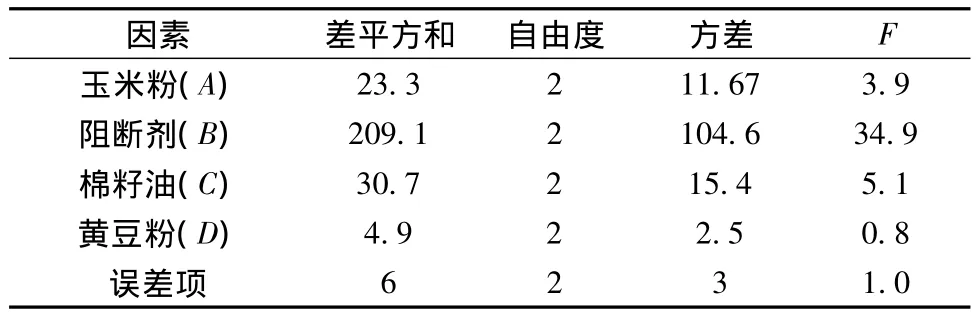
表3 方差分析表Table 3 Analysis of variance
2.5.3 驗證試驗
根據正交試驗分析的結果,對最佳組合A3B3C2D2進行驗證試驗。將ZY接種于該發酵培養基中,為保證實驗的精確性,每組實驗進行3次。結果顯示番茄紅素含量達到29.9 mg/g菌體干重,高于正交試驗中最高值(27.1 mg/g)。Liu等[13]對三孢布拉霉的培養條件進行優化之后,其番茄紅素含量達到19 mg/g菌體干重。Wang等[5]在優化了培養基和培養條件后番茄紅素的含量為11 mg/g菌體干重。Sun等[14]在培養基中添加2種競爭性途徑抑制劑使三孢布拉霉番茄紅素累積含量提高到4.3 mg/g。Shi等[15]在培養基中加入前體和代謝促進劑后番茄紅素含量大幅提高至10 mg/g菌體干重,產量最高達到578 mg/L。上述研究均采用三孢布拉霉進行番茄紅素發酵,但含量遠低于本試驗所獲的結果。除此以外,采用基因工程菌進行番茄紅素合成和發酵優化方面也取得了很大的發展。Alper等[16]在重組大腸桿菌中實現了番茄紅素的高產(220 mg/L),在優化了攪拌速率和pH控制策略后,番茄紅素的含量達到8.15 mg/g菌體干重,生物量達到27 g菌體干重/L。Yoon等[17]采用構建的大腸桿菌基因工程菌進行番茄紅素發酵,在優化了代謝途徑和發酵工藝后,獲得了迄今番茄紅素在大腸桿菌中最高含量(22 mg/g菌體干重),但由于其生物量較低,因此其產量僅為102 mg/L。

表4 驗證試驗結果Table 4 Results of verification test
3 結論
本研究對絲狀真菌三孢布拉霉產番茄紅素發酵培養基及其培養條件進行了優化,獲得以下幾個方面的結論。對三孢布拉霉產番茄紅素發酵培養基的幾個關鍵因素碳源、氮源、油以及接種量和正負菌比例進行了單因素試驗。結果顯示相對于單糖,三孢布拉霉更容易利用多糖合成番茄紅素,且以不溶性的玉米粉為佳;氮源中有機氮源效果較好,黃豆粉為最佳氮源;培養基中添加油類能有效促進番茄紅素累積,以棉籽油為最佳,這可能跟其不飽和度較高有關;同時,三孢布拉霉的接種量特別是接種比例對番茄紅素影響較大,接種量10%為好,正負菌比例要以負菌為主,維持在1∶5時番茄紅素產量達到最大。
同時對上述試驗獲得的幾個重要因素進行了進一步優化,選擇玉米粉、黃豆粉、油類、阻斷劑進行了4因素3水平正交試驗,并對結果進行了極差分析和方差分析,顯示4因素的主次順序為阻斷劑、油、玉米粉、黃豆粉,且阻斷劑對番茄紅素合成影響顯著。通過驗證試驗,確定了培養基最佳組合時番茄紅素產量達到29.9 mg/g菌體干重。
[1] 包有霞,陳碧霄,閆震,等.沼澤紅假單胞菌的培養和生產番茄紅素的優化控制[J].食品與生物技術學報,2009,28(5):693-698.
[2] 李紅,孫清瑞,張連富.溫度對高順式占比番茄紅素穩定性影響研究[J].食品與生物技術學報,2014,33(7):715-720.
[3] Hsu W-J,Yokohama H,DeBenedict C.Chemical bioregulation of carotenogenesis in Phycomyces blakesleeanus[J].Phytochemistry,1990,29(8):2 447-2 451.
[4] Nicolas-Molina F E,Navarro E,Ruiz-Vazquez R M.Lycopene over-accumulation by disruption of the negative regulator gene crgA in Mucor circinelloides[J].Applied Microbiology and Biotechnology,2008,78(1):131-137.
[5] WANG J F,LIU X J,LIU R S,et al.Optimization of the mated fermentation process for the production of lycopene by Blakeslea trispora NRRL 2895(+)and NRRL 2896(-)[J].Bioprocess and Biosystems Engineering,2012,35(4):553-564.
[6] 徐志強,余曉斌.Mg2+對三孢布拉霉合成β-胡蘿卜素的影響[J].無錫輕工大學學報,2003,22(3):104-406.
[7] 劉海麗,余曉斌.表面活性劑和抗氧化劑對三孢布拉霉合成β-胡蘿卜素的影響[J].食品與生物技術學報,2007,26(2):97-101.
[8] Papaioannou E H,Liakopoulou-Kyriakides M.Substrate contribution on carotenoids production in Blakeslea trispora cultivations[J].Food and Bioproducts Processing,2010,88(2-3):305-311.
[9] Mantzouridou F,Tsimidou MZ,Roukas T.Performance of crude olive pomace oil and soybean oil during carotenoid production by Blakeslea trispora in submerged fermentation[J].Journal of Agricultural and Food Chemistry,2006,54(7):2 575-2 581.
[10] Vereschagina O A,Memorskaya A S,Tereshina V M.The role of exogenous lipids in lycopene synthesis in the mucoraceous fungus Blakeslea trispora[J].Microbiology,2010,79(5):593-601.
[11] 王見冬,袁其朋,錢忠明.β-胡蘿卜素發酵過程中關鍵的代謝產物—三孢酸[J].微生物學通報,2004,31(3):147-150.
[12] Varzakakou M,Roukas T,Kotzekidou P.Effect of the ratio of(+)and(-)mating type of Blakeslea trispora on carotene production from cheese whey in submerged fermentation[J].World Journal of Microbiology and Biotechnology,2010,26(12):2 151-2 156.
[13] LIU X J,LIU R S,LI H M,et al.Lycopene production from synthetic medium by Blakeslea trispora NRRL 2895(+)and 2896(-)in a stirred-tank fermenter[J].Bioprocess and Biosystems Engineering,2012,35(5):739-749.
[14] SUN Y,YUAN Q-P,Vriesekoop F.Effect of two ergosterol biosynthesis inhibitors on lycopene production by Blakeslea trispora[J].Process Biochemistry,2007,42(10):1460-1464.
[15] SHI Y Q,XIN X L,YUAN Q P.Improved lycopene production by Blakeslea trispora with isopentenyl compounds and metabolic precursors [J].Biotechnology Letters,2012,34(5):849-852.
[16] Alper H,Miyaoku K,Stephanopoulos G.Characterization of lycopene-overproducing E.coli strains in high cell density fermentations[J].Applied Microbiology and Biotechnology,2006,72(5):968-974.
[17] Yoon S H,Lee Y M,Kim J E,et al.Enhanced lycopene production in Escherichia coli engineered to synthesize isopentenyl diphosphate and dimethylallyl diphosphate from mevalonate[J].Biotechnology and Bioengineering,2006,94(6):1 025-1 032.

