響應面法優化鹿角菜中巖藻多糖的超聲波輔助提取工藝*
宋海燕,何文輝,張澤華,袁榮榮
(上海海洋大學省部共建水產種質資源發掘與利用教育部重點實驗室,上海,201306)
鹿角菜(Pelvetia siliquosa Tsenget C.F.Chang)隸屬褐藻門(Phaeophyta)、圓子綱(Cyclosporeae)、鹿角菜目(Fucales)、鹿角菜科(Fucaceae)、鹿角菜屬(Pelvetia)[1]。鹿角菜藻體骨小,軟骨質,叉狀分枝角度較寬,生長托是長角果形[2]。巖藻多糖是褐藻中重要的雜多糖,其主要單糖組成是L-巖藻糖,是一種硫酸多糖。
多糖提取的常用方法有熱水提取、超聲輔助提取和微波輔助提取法,其中選用超聲波輔助提取是因為其能耗低、溶劑消耗低、提取效率較高以及自動化程度高[3-4]。當今,優化提取工藝以獲得最大多糖提取率已成為研究熱點[5-8]。Box-Benhnken設計(BBD)是一個球形旋轉設計,與傳統方法相比,簡化了需要評估多個變量和它們之間的相互作用試驗的復雜性,已被廣泛應用于優化提取工藝,獲得最佳多糖提取率的最佳工藝參數組合[9-11]。
本試驗以鹿角菜為原材料,采用超聲波輔助提取鹿角菜中巖藻多糖,通過響應面法來優化提取工藝,同時采用自由基清除能力體系來對巖藻多糖進行體外抗氧化活性研究。
1 材料與方法
1.1 材料與儀器設備
鹿角菜(Pelvetia siliquosa Tsenget C.F.Chang)產自海南,已在試驗室人工飼養;L-巖藻糖標準品(Fuc),西格瑪奧德里奇(上海)貿易有限公司;重蒸酚,生工生物工程(上海)股份有限公司。無水乙醇、體積分數95%乙醇、濃 H2SO4、三氯甲烷、正丁醇、K3Fe(CN)6、三氯乙酸、FeCl3、DPPH、抗壞血酸(Vc)、水楊酸、鄰苯三酚、三羥基氨基甲烷(Tris)等均為分析純。
JY92-2D超聲波細胞破碎機,寧波新芝科器研究所;SP-722可見分光光度計,上海光譜儀器有限公司;SXT-06索氏提取器,上海洪紀儀器設備有限公司;DK-S24型電熱恒溫水浴鍋,上海精宏試驗設備有限公司;LXJ-IIB低速大容量離心機,上海安亭科學儀器廠;美國LABCONCO冷凍干燥機,無錫凱派克斯科技有限公司;R-201型旋轉蒸發儀,上海申勝生物技術有限公司。
1.2 實驗方法
1.2.1 巖藻多糖提取工藝研究
鹿角菜洗凈晾干,-80℃預凍24 h,冷凍干燥24 h,研磨粉碎過60目篩,用95%乙醇90℃回流脫脂3次,每次4 h,40℃烘干得脫脂藻粉。
脫脂藻粉加入適量蒸餾水溶脹,超聲波輔助提取后,水浴處理一段時間,提取液冷卻至室溫,4 000 r/min離心20 min后,棄沉淀,濃縮上清液至1/5體積,冷卻后加無水乙醇至濃度為30%,以除去褐藻膠,靜置1 h,4 000 r/min離心20 min,濃縮上清液至1/5體積,加4倍體積95%乙醇,4℃靜置過夜,4 000 r/min離心,收集沉淀,用無水乙醇洗滌數次,冷凍干燥得粗巖藻多糖。
1.2.2 巖藻多糖含量的測定
制備標準曲線[12]:取 L-巖藻糖標準品溶液0,0.2,0.4,0.6,0.8,1.0 mL,加蒸餾水至 2.0 mL,再加入6%苯酚1.0 mL,混勻后,迅速加入5.0 mL濃硫酸,搖勻,靜置5 min,沸水浴加熱20 min后,冷卻至室溫。490 nm處測吸光度,以L-巖藻糖的濃度(c,mg/mL)為橫坐標,吸光度(A)為縱坐標,繪制標準曲線。得回歸方程為:Y=0.0198 c+0.052 7,R2=0.997 6。
樣品溶液的制備:取1 mL樣品溶液,置于試管中,加蒸餾水至2.0 mL,再加入6%苯酚1.0 mL,混勻,迅速加入5.0 mL濃硫酸,搖勻,靜置5 min,沸水浴加熱20 min后,冷卻至室溫。490 nm處測定吸光度,根據回歸方程計算粗巖藻多糖提取率[公式(1)]。

1.3 響應面法試驗設計
在單因素試驗的基礎上,選取超聲時間、料液比、水浴溫度以及水浴時間4因素進行響應面試驗。響應面因素水平見表1。
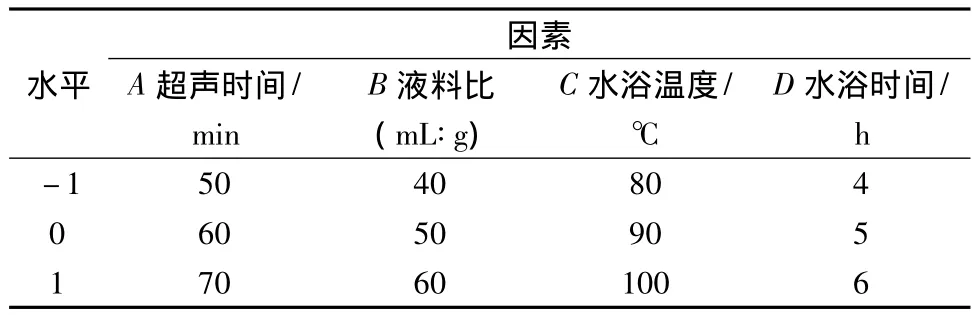
表1 響應面因素水平表Table 1 Analytical factors and levels for RSM
1.4 粗巖藻多糖初步處理
配制2%的粗巖藻多糖溶液,并加入1/3糖溶液體積的 Sevag試劑[V(氯仿)∶V(正丁醇)=5∶1],劇烈振蕩30 min,離心5 000 r/min,10 min,上層水相含多糖,下層為有機相,去除有機相層和蛋白質沉淀層,水相按照此方法反復除蛋白至兩相間沒有白色蛋白質。將脫蛋白后的多糖溶于蒸餾水,借助磁力攪拌,連續透析24 h,每4換水。濃縮后冷凍干燥得初純巖藻多糖(F)。
1.5 巖藻多糖抗氧化活性試驗
1.5.1 巖藻多糖的羥自由基(·OH)清除能力測定
雙氧水與二價鐵發生Fenton反應生成羥自由基,加入巖藻多糖后會和水楊酸競爭與羥自由基的結合,從而使有色產物減少,該產物在510 nm處吸收值最大,可以采用紫外分光光度計測定510 nm處的吸光值來評定。
根據孫海森的方法[13],將巖藻多糖稀釋成不同濃度梯度:0.05,0.1,0.2,0.4,0.8,1.0 mg/mL。取6 mmol/L水楊酸,2 mmol/L 的 FeS04各1 mL,搖勻,再加入1 mL的 6 mmol/L H2O2,搖勻,于37℃水浴恒溫15 min后,測定其吸光度A0。之后,各加入巖藻多糖溶液1 mL,搖勻,放置10 min,測定其吸光度A1,并用水代替H2O2的A2做參照,按公式(2)計算清除率。同時以相同濃度的Vc作為對照。每個處理設置3個重復。
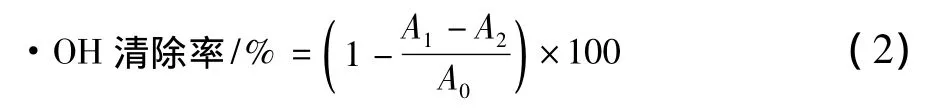
式中:A0為空白對照的吸光值;A2為多糖本底吸光值;A1為巖藻多糖樣品的吸光值。
1.5.2 巖藻多糖的超氧陰離子自由基(O2-·)清除能力測定
堿性條件下,鄰苯三酚經自氧化產生中間產物O2-·,它會加速鄰苯三酚的自氧化反應。參照婁翠的方法[14],分別將巖藻多糖和Vc配成不同質量濃度梯度:0,0.05,0.1,0.2,0.4,0.8,1.0 mg/mL。取 5 mL Tris-HCl緩沖溶液(pH=8.2,50 mmol/L),25 ℃預熱30 min,加入2 mL不同質量濃度的多糖溶液和Vc溶液,25 mmol/L鄰苯三酚溶液0.6 mL,混合均勻后在25℃的水浴條件下反應10 min,再加入8 mol/L的HCl溶液3 mL來終止反應,在320 nm處測定吸光度。以蒸餾水為對照。O2-·的清除能力按公式(3)計算:
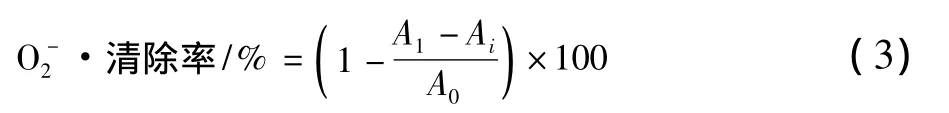
式中:A0、A1、Ai分別為空白對照、巖藻多糖樣品、不加鄰苯三酚溶液的吸光度值。
1.5.3 DPPH法測定巖藻多糖的抗氧化能力
參考郭欣的測定方法[15],取1 mL不同質量濃度梯度樣品溶液(0.05,0.1,0.2,0.4,0.8,1.0 mg/mL),0.2 mL DPPH溶液,以及2 mL蒸餾水,混勻,常溫下30 min后,在515 nm出測定吸光度A1,用蒸餾水代替樣品得到吸光度A0,無水乙醇代替樣品得到吸光度A2[公式(4)]。同時以相同濃度的Vc作為對照。每個處理設置3個重復。
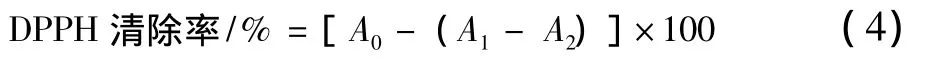
1.5.4 巖藻多糖的還原力測定
采用Amarowicz方法[16],并稍做調整。取pH 6.6的0.2 mmol/L磷酸鈉緩沖液和1%的鐵氰化鉀溶液各2.5 mL,加入不同質量濃度梯度的樣品溶液(0.05,0.2,0.8,1.0,2.0,4.0 mg/mL)1 mL,混勻后50 ℃水浴20 min。加入10%三氯乙酸溶液2.5 mL,混勻,5 000 r/min離心10 min。取上清液2.5 mL,加入蒸餾水2.5 mL,再加入0.1%FeCl32.5 mL,混勻,在避光處靜置10 min后于700 nm波長處測定吸光度。
2 結果與分析
2.1 響應面試驗設計與結果
采用Box-Benhnken設計對巖藻多糖提取工藝進行響應面分析,響應面試驗方案及結果見表2。
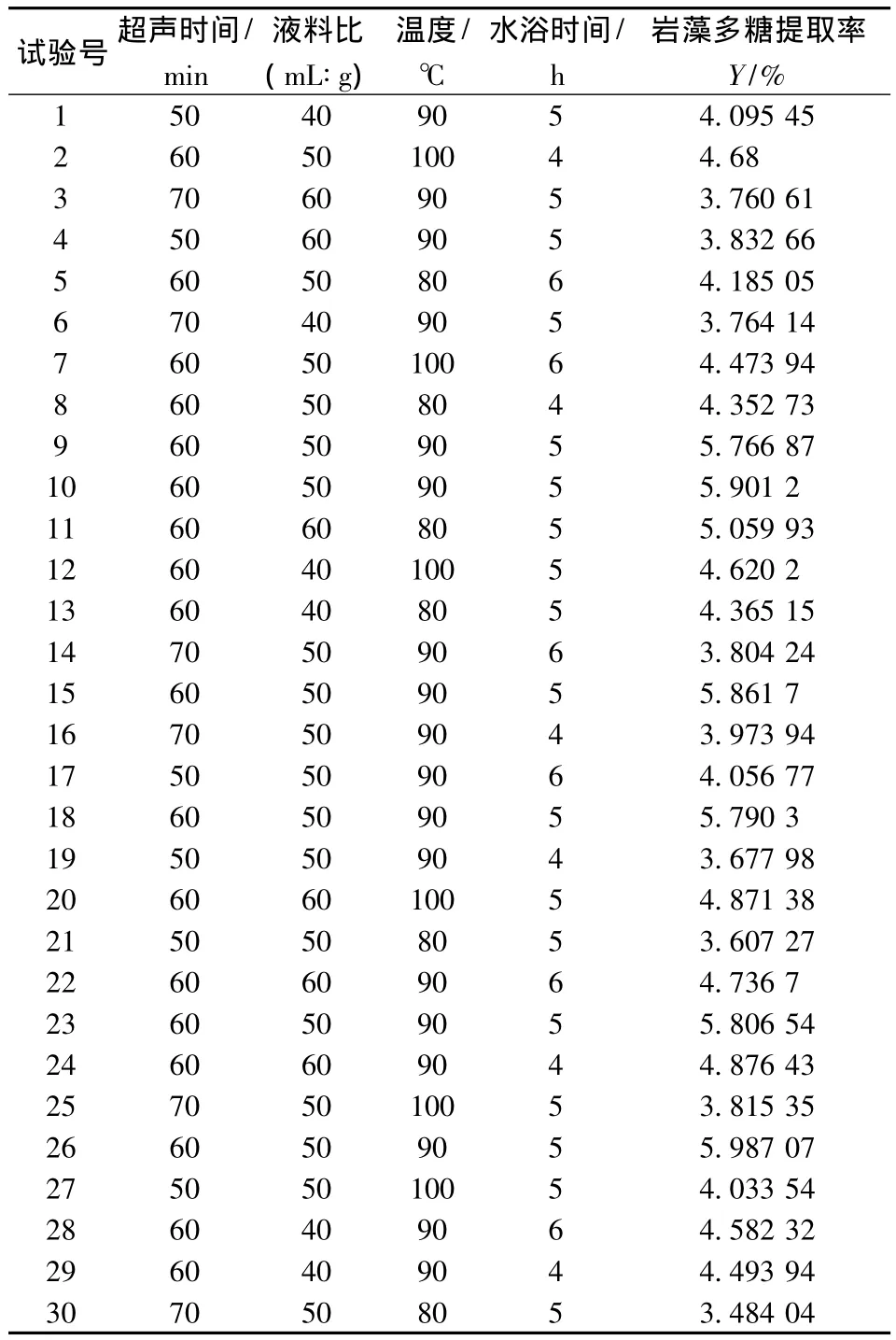
表2 響應面試驗方案及結果Table 2 Design and experimental results of RSM
2.2 數學模型建立與數據分析
利用Design Expert8.05軟件對表2中數據進行擬合,得到巖藻多糖提取率(Y)對試驗因素的二次回歸方程如下所示:
Y=-141.130 78+1.715 42A+0.614 08B+1.352 44C+7.511 35D+6.481 50×10-4AB-2.374 00×10-4AC-0.011 364AD-1.109 00×10-3BC-5.702 75×10-3BD-9.595 00×10-4CD-0.013 969A2-5.145 13×10-3B2-7.033 04×10-3C2-0.648 38D2
二次回歸方程中,A2、B2、C2、D2的系數均為負數,因而推斷回歸方程所對應的拋物面開口向下,說明有極大值點。由表3可知,回歸模型項P<0.000 1,說明該回歸模型極顯著,且模型失擬項在α=0.05水平上不顯著(P=0.155 3>0.05),說明未知因素對該試驗結果干擾小。決定系數R2=0.978 6,說明該二次回歸模型與實際試驗值擬合度較好且可靠性高。調整系數,說明該二次回歸模型可以解釋95.55%的響應值的變化。變異系數(C.V.%=3.71)有較低值,說明試驗值可靠。信噪比(Adeq Precision)為18.552,說明精度很高。該回歸方程模型擬合較好,可用于巖藻多糖的超聲輔助提取工藝優化。
一次項中 A、B、C和 D均為差異極顯著(P<0.001),說明在巖藻多糖提取工藝過程中,超聲時間、液料比、水浴溫度和水浴時間對巖藻多糖的提取有極其顯著的影響,是巖藻多糖提取率的主要限制因子;由表3可以得出影響鹿角菜巖藻多糖提取率的順序依次為超聲時間(A)>水浴溫度(C)>水浴時間(D)>液料比(B)。
2.3 響應面三維圖分析
圖1顯示了水浴溫度和水浴時間在中心水平時,超聲時間和液料比對超聲輔助提取巖藻多糖提取率的影響。當超聲時間在50~60 min范圍,液料比在40~50(mL∶g)范圍內,多糖提取率隨著超聲時間的延長,液料比的增加而不斷提高,當超聲時間和液料比超過中心水平時,提取率減少。且超聲時間對多糖提取率的曲線更陡峭,說明超聲時間影響更大,與表3結果相符。
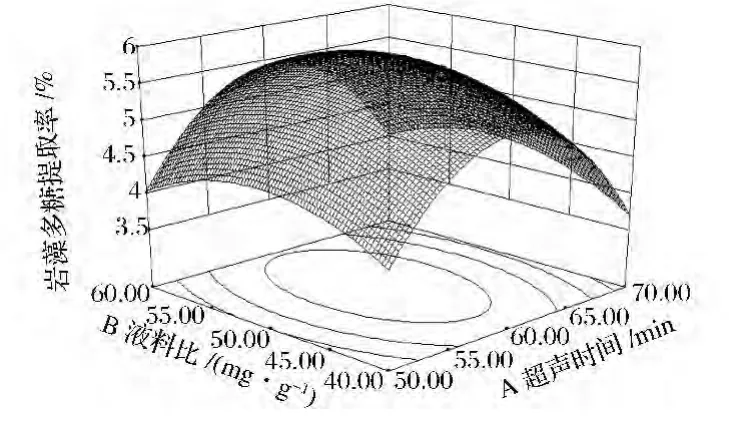
圖1 超聲時間和液料比對巖藻多糖提取率影響的響應面圖Fig.1 Response surface plot and contour plot of ultrasonic time and liquid-solid ratio on extraction of fucoidan
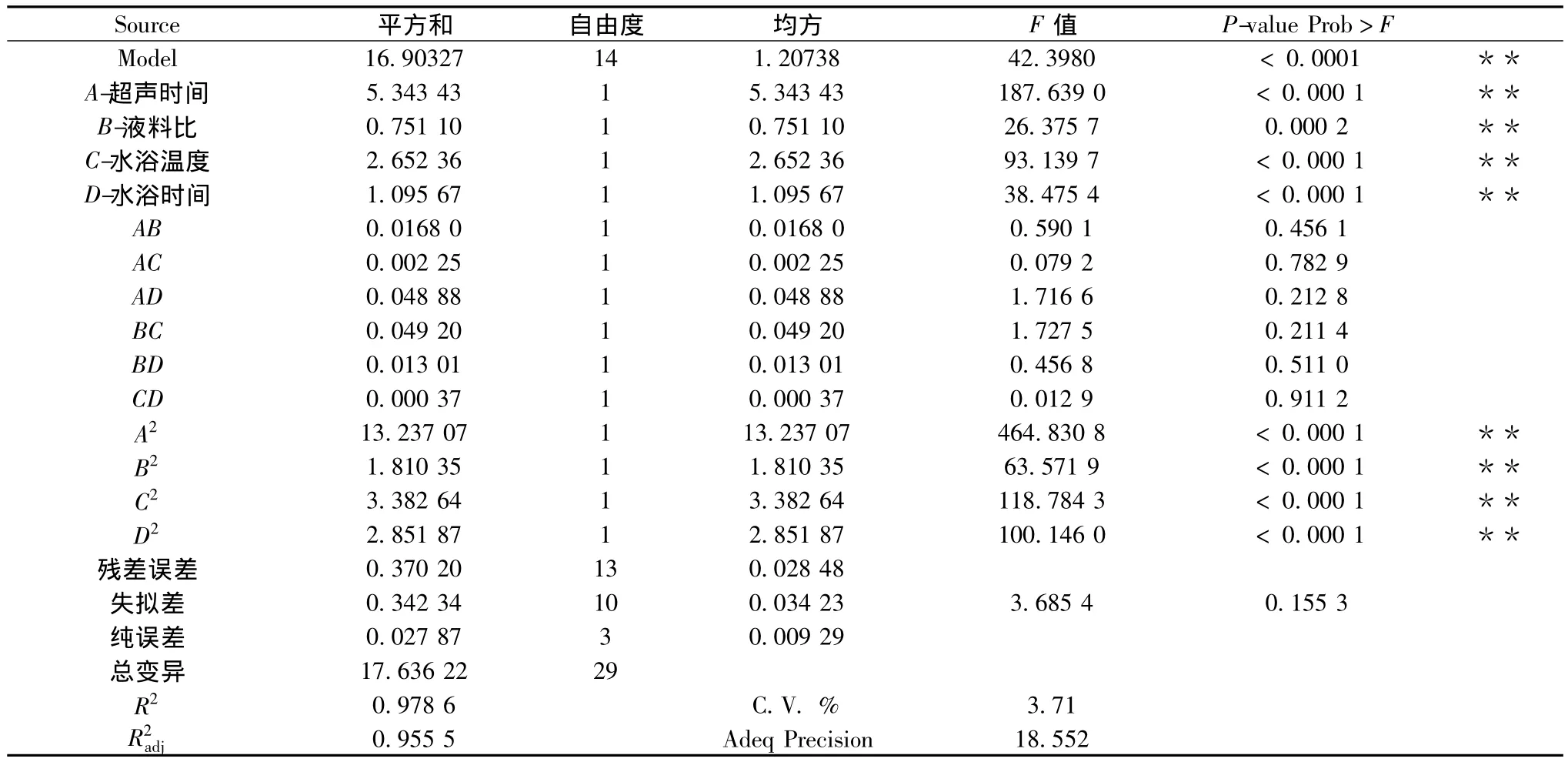
表3 回歸模型方差分析Table 3 Variance analysis(ANOVA)for regression equation of model
圖2和圖3中三維曲面與圖1相似,多糖提取率都是呈先增加后減小的趨勢,且等高線為圓形,說明兩影響因素交互作用不顯著。
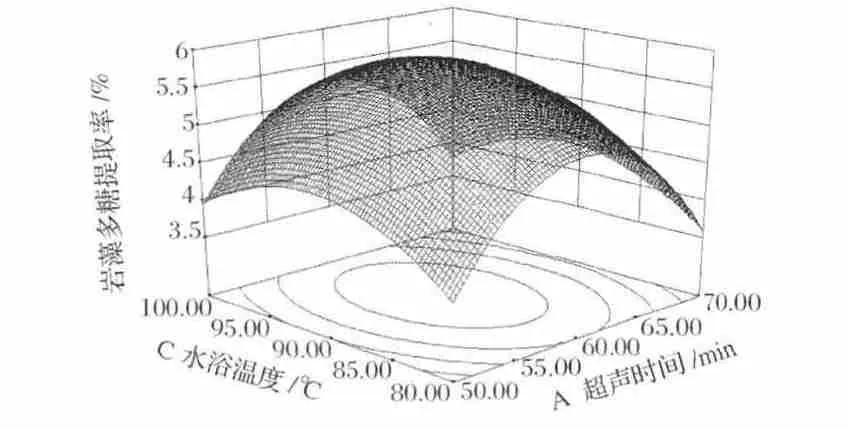
圖2 超聲時間和水浴溫度對巖藻多糖提取率影響的響應面圖Fig.2 Response surface plot of ultrasonic time and water bath temperature on extraction of fucoidan
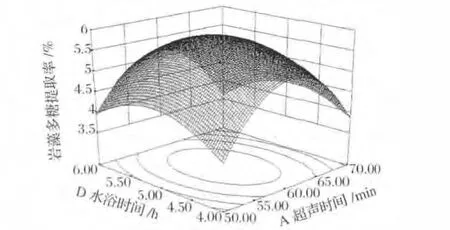
圖3 超聲時間和水浴時間對巖藻多糖提取率影響的響應面圖Fig.3 Response surface plot of ultrasonic time and water bath timeon extraction of fucoidan
圖4、圖5和圖6中三維曲面相似,多糖提取率依然呈先增加后減小的趨勢,由曲面可看出,變化幅度不大。等高線呈橢圓形,表明兩者有交互作用,但由表3可知,兩者交互作用并不顯著。
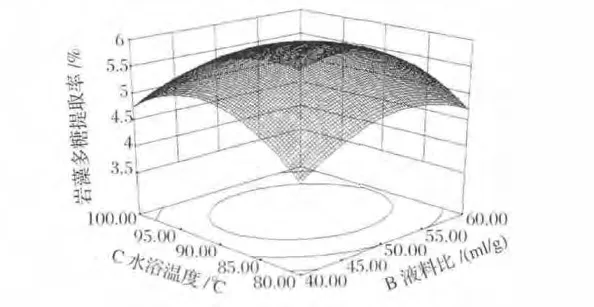
圖4 水浴溫度和液料比對巖藻多糖提取率影響的響應面圖Fig.4 Response surface plot of water bath temperature and liquid-solid ratio on extraction of fucoidan
2.4 最佳工藝參數確定與模型驗證
由中心組合試驗設計[17]優化得試驗結果為A=59.78 min,B=50.75 mL/g,C=90.79℃,D=4.98 h,Y為5.993%。考慮實際操作,將提取條件修改為超聲時間為60 min,液料比為51 mL/g,水浴溫度為91℃,水浴時間為5 h。采用最佳提取條件,3次重復驗證結果為5.966%,5.958%,5.960%,平均提取率為5.961%,與理論預測值相近。因此可以采用響應面法來優化巖藻多糖的提取工藝條件。
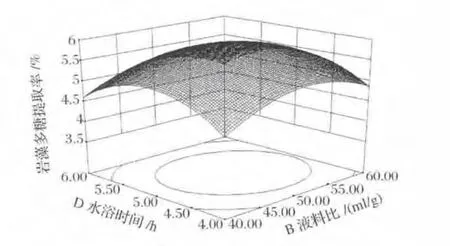
圖5 水浴時間和液料比對巖藻多糖提取率影響的響應面圖Fig.5 Response surface plot of water bath time and liquid-solid ratio on extraction of fucoidan
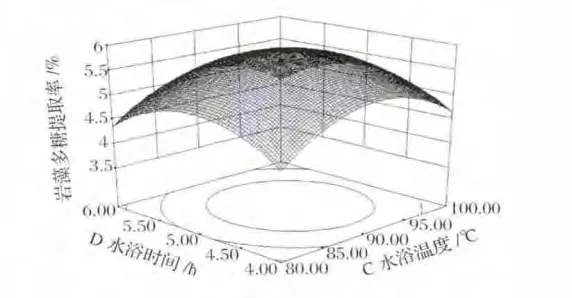
圖6 水浴時間和水浴溫度對巖藻多糖提取率影響的響應面圖Fig.6 Response surface plot of water bath time and water bath temperature on extraction of fucoidan
2.5 超聲波輔助提取法與傳統水浴法對比
在單因素試驗基礎上對傳統水提巖藻多糖工藝進行響應面優化得到最佳提取條件和提取率如表4,通過對比,在超聲波輔助下,提取總時間縮短了2.4 h,多糖提取率提高了0.76%,這是因為超聲波的作用提高了質量傳遞效率,促使細胞中多糖更易釋放和擴散到溶劑中[18]。而水浴時間過長有可能導致多糖降解。
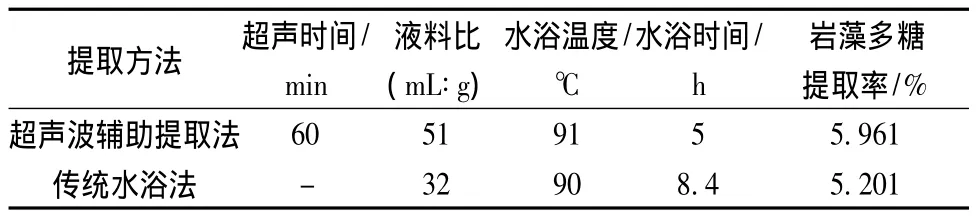
表4 超聲波輔助提取法與傳統水浴法對比Table 4 The comparison between Ultrasonic assisted extraction method and traditional water bath method
3 抗氧化活性結果與分析
3.1 羥自由基清除能力測定
在試驗范圍內,Vc和巖藻多糖對·OH的清除率隨著質量濃度的增加而不斷提高(圖7)。在0.05~0.4 mg/mL范圍內,Vc對·OH的清除率顯著提高,當質量濃度為0.4 mg/mL時,清除率為97.93%。當多糖質量濃度低于0.2 mg/mL時,對·OH的清除率較低,但增幅明顯。當質量濃度在0.2~1.0 mg/mL范圍內,巖藻多糖對·OH的清除率從36.32%增加至77.47%,巖藻多糖和Vc半數抑制濃度IC50分別為0.346 mg/mL和0.101mg/mL巖藻多糖對·OH的清除能力較好但低于Vc。
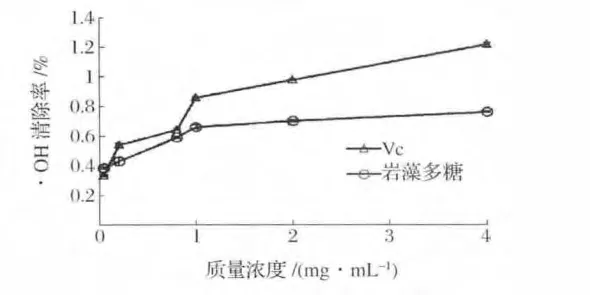
圖7 巖藻多糖和Vc對羥自由基的清除能力Fig.7 Hydroxyl free radical cavenging activity of fucoidan and Vc
3.2 巖藻多糖的O-2·清除能力測定
在試驗范圍內,Vc和巖藻多糖對O2-·的清除率隨著質量濃度的增加而不斷提高(圖8)。巖藻多糖質量濃度低于0.2 mg/mL時,對O2-·的清除率較低,當質量濃度在0.2~1 mg/mL范圍內時,對O2-·的清除率增加較緩慢。當質量濃度為1 mg/mL時,Vc和巖藻多糖對O2-·的清除率分別為95.47%和52.87%。巖藻多糖和Vc半數抑制濃度IC50分別為0.893 mg/mL和0.268 mg/mL,巖藻多糖對O2-·清除作用低于水溶性Vc。
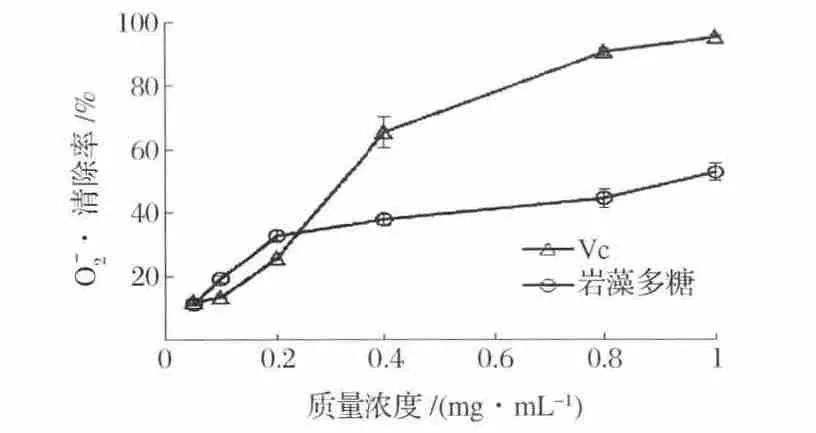
圖8 巖藻多糖和Vc對O2-·的清除能力Fig.8 Superoxide anion radical scavenging activity of fucoidan and Vc
3.3 DPPH法測定巖藻多糖的抗氧化能力
在試驗范圍內,當質量濃度低于0.6 mg/mL時,巖藻多糖對DPPH·的清除率高于水溶性Vc;巖藻多糖的半數抑制濃度IC50小于Vc,分別0.128 mg/mL和0.263 mg/mL;當濃度為1 mg/mL時,清除率為68.36%,略低于水溶性Vc對DPPH·的清除率(圖9)。
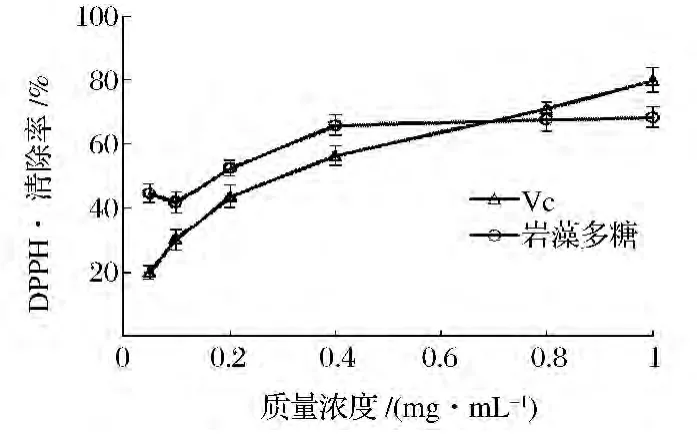
圖9 巖藻多糖和Vc對DPPH·自由基的清除能力Fig.9 DPPH·scavenging activity of fucoidan and Vc
3.4 巖藻多糖的還原力測定
還原力的大小成為衡量其抗氧化活性的重要指標之一,吸光度越大,還原力越大。Vc和巖藻多糖的還原力較好,隨著質量濃度的增加,量效關系明顯,當質量濃度在1~4 mg/mL范圍內,巖藻多糖的吸光度增加緩慢,還原力趨于平穩。當質量濃度為4 mg/mL時,還原力為Vc的62.69%(圖10)。
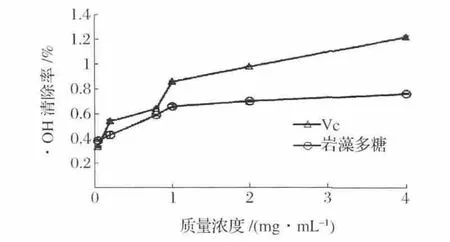
圖10 巖藻多糖和Vc還原能力Fig.10 Reduce activity of fucoidan and Vc
4 結論
通過響應面分析法系二次回歸方法,獲得鹿角菜中巖藻多糖的最佳提取條件為超聲時間60 min,液料比51(mL∶g),水浴溫度91℃,水浴時間5 h。通過方差分析確定該二次回歸模型具有顯著性,一次項對提取率的影響顯著,四個參數的二次交互項雖存在交互作用,但均不顯著。在最佳提取條件下,巖藻多糖提取率達到5.961%,與理想預測值(5.993%)相比,相對誤差小于5%;通過與傳統水提法相比發現,提取總時間縮短了2.4 h,多糖提取率提高了0.79%。對最佳提取條件所得巖藻多糖脫蛋白透析后進行抗氧化能力測定發現,巖藻多糖具有良好的抗氧化能力,還原力隨著質量濃度的增加而不斷提高,對羥自由基、超氧陰離子自由基和DPPH自由基的半數抑制濃度 IC50分別為 0.346 mg/mL、0.893 mg/mL和0.128 mg/mL;但與Vc相比,對羥自由基、超氧陰離子自由基清除作用較弱,但對DPPH的半數抑制濃度IC50小于Vc。因此為鹿角菜中巖藻多糖在保健食品,醫藥開發提供了理論基礎。
[1] 黃禮娟,蔡洪波,張華杰,等.鹿角菜采苗育苗技術的研究[J].海洋水產研究,2008,29(1):70-76.
[2] 曾呈奎,張峻甫.鹿角菜及其分布[J].植物學報,1953,2(2):280-297.
[3] Vilkhu K,Mawson R,Simons L,et al.Applications and opportunities for ultrasound assisted extraction in the food industry-A review[J].Innovative Food Science & Emerging Technologies,2008,9(2):161-169.
[4] XU Y,ZHANG L,Bailina Y,et al.Effects of ultrasound and/or heating on the extraction of pectin from grapefruit peel[J].Journal of Food Engineering,2014,126(4):72-81.
[5] CHEN S,CHEN H,TIAN J,et al.Enzymolysis-ultrasonic assisted extraction,chemical characteristics and bioactivities of polysaccharides from corn silk[J].Carbohydrate Polymers,2014,101(1):332-341.
[6] LI Q,YU N,WANG Y,et al.Extraction optimization of Bruguiera gymnorrhiza polysaccharides with radical scavenging activities[J].Carbohydrate Polymers,2013,96(1):148-155.
[7] SHEN S,CHEN D,LI X,et al.Optimization of extraction process and antioxidant activity of polysaccharides from leaves of Paris polyphylla[J].Carbohydr Polym,2014,104(8):80-86.
[8] YIN X,YOU Q,SU X.A comparison study on extraction of polysaccharides from Tricholoma matsutake by response surface methodology[J].Carbohydr Polym,2014,102(4):419-422.
[9] Box G E P,Wilson K B.On the experimental attainment of optimum conditions[J].Journal of the Royal Statistical Society,1951,13(1):1-45.
[10] XIA Y,KUANG H,YANG B,et al.Optimum extraction of acidic polysaccharides from the stems of Ephedra sinica Stapf by Box-Behnken statistical design and its anti-complement activity[J].Carbohydrate Polymers,2011,84(1):282-291.
[11] WANG Q,SUN Y,YANG B,et al.Optimization of polysaccharides extraction from seeds of Pharbitis nil and its anti-oxidant activity[J].Carbohydr Polym,2014,102(3):460-466.
[12] 李建,楊波,季宇彬.超聲波法提取裙帶菜多糖的工藝研究[J].食品與藥品,2010,12(11):404-406.
[13] 孫海森.海帶巖藻多糖硫酸酯的分離純化及相關活性研究[D].杭州:浙江工商大學,2012.
[14] 婁翠.廣東海帶巖藻多糖的分離純化、結構鑒定及生物活性研究[D].廣州:暨南大學,2012.
[15] 郭欣.超聲處理對海洋巖藻聚糖硫酸酯分子鏈及結構和抗氧化活性影響的研究[D].杭州:浙江大學,2013.
[16] Amarowicz R,Estrella I,Hernández T,et al.Free radical-scavenging capacity,antioxidant activity,and phenolic composition of green lentil(Lens culinaris)[J].Food Chemistry,2010,121(3):705-711.
[17] 黃禮徳,郭立強,劉勝利,等.正交設計優化木賊多糖的超聲提取工藝(英文)[J].化學研究與應用,2012,24(6):990-995.
[18] ZHI Y,HAN X,LI J.Ultrasound-assisted extraction of polysaccharides from mulberry leaves[J].Food Chemistry,2011,127(3):1273-1279.

