基于Staphylococcus carnosus來源的D-果糖-1,6-二磷酸醛縮酶在大腸桿菌合成稀有酮糖的研究*
李子杰,賀貝貝,高曉冬
(江南大學生物工程學院,糖化學與生物技術教育部重點實驗室,江蘇無錫,214122)
醛縮酶介導的羥醛縮合反應是合成手性C-C鍵的最重要方法之一[1-3]。對于醛縮酶來說,磷酸二羥基丙酮(DHAP)依賴型醛縮酶研究最為廣泛。該類醛縮酶催化DHAP供體分子與醛受體分子的羥醛縮合反應,醛縮酶能夠決定產物中兩個新生成的立體中心的構型[4],并且不受底物的結構或立體化學的影響[5]。D-果糖-1,6-二磷酸醛縮酶(FruA)活性高、能夠以多種醛作為受體,是應用最為廣泛的DHAP依賴型醛縮酶。FruA對DHAP分子的專一性要求非常高[6],由于DHAP成本昂貴并且穩定性較差,不利于產物的大量制備[6-8]。
在前期工作中,基于“一釜四酶法”的策略,以外消旋的DL-3-磷酸甘油作為起始底物在磷酸甘油氧化酶的作用下生成DHAP,同時與FruAS.car醛縮酶(Staphylococcus carnosus來源)催化的羥醛縮合反應偶聯,制備了多種酮糖[9]。雖然能夠避免直接使用DHAP,在一定程度上節約了成本,但沒能從根本上實現DHAP的大量合成問題。在本研究中,以便宜的底物葡萄糖作為碳源,通過糖酵解途徑在同時表達FruAS.car醛縮酶和YqaB磷酸酶大腸桿菌工程菌胞內產生DHAP,并分別在培養基中添加醛受體丙醛、丁醛合成相應的稀有酮糖。
1 材料與方法
1.1 質粒和菌株
CDFDuet-1質粒和大腸桿菌BL21Star(DE3),Novagen公司;pKK-fda質粒由Fessner教授提供;大腸桿菌MG1655和DH5α本實驗室保存;用于基因擴增的引物在上海生工合成(表1)。
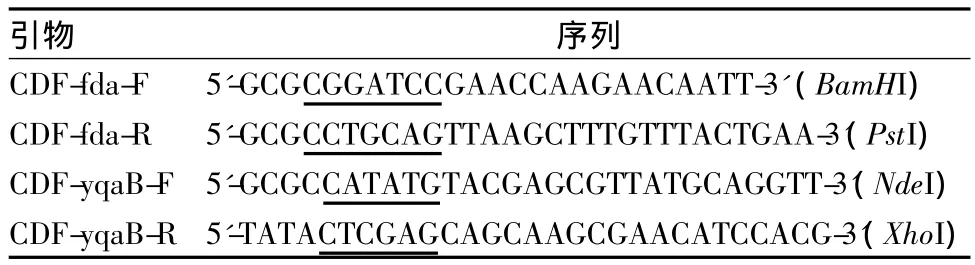
表1 本研究所用引物Table 1 Primers used in this study
1.2 酶、試劑和培養基
DNA聚合酶從Invitrogen公司購買;限制性內切酶和T4連接酶購于寶生物公司;鏈霉素、M9無機鹽、鹽酸硫胺素購自 Sigma-Aldrich;硅膠購自 EMD Chemicals公司。
LB液體培養基(g/L):胰蛋白胨10,酵母提取物5,NaCl 10,121℃濕熱滅菌20 min;M9培養基(g/L):Na2HPO46,KH2PO43,NaCl 0.5,NH4Cl 1,MgSO40.12,CaCl20.011 1,硫胺素0.001,ZnSO40.003 2。
1.3 CDF-fda-yqaB重組質粒的構建
以質粒pKKfda為模板,使用CDF-fda-F和CDF-fda-R分別作為上下游引物通過PCR擴增基因fda;以大腸桿菌MG1655為模板,以CDF-yqaB-F和CDF-yqaB-R分別作為上下游引物擴增基因yqaB;使用限制性內切酶BamHI,PstI分別對fda基因片段和CDFDuet-1質粒進行雙酶切、連接、轉化DH5α,篩選陽性轉化子,得到重組質粒CDF-fda;使用限制性內切酶NdeI,XhoI分別對yqaB片段以及質粒CDF-fda進行雙酶切,連接、轉化、篩選陽性轉化子,得到重組質粒CDF-fda-yqaB。
1.4 稀有酮糖的制備
表達質粒CDF-fda-yqaB轉化BL21Star(DE3)感受態細胞得到BL21Star(DE3)/CDF-fda-yqaB重組菌株。將LB培養基中過夜培養的該重組菌株的培養液以1∶50的比例轉接到以5 g/L葡萄糖為碳源、鏈霉素終濃度為100 μg/mL的M9培養基中(2 L),在37℃,225 r/min條件下培養。當測得菌液OD600為0.8~1.0時,調整溫度為30℃后,加入過濾滅菌終濃度為1 mmol/L的IPTG。IPTG誘導蛋白表達2-3 h后,加入終濃度為30 mmol/L丙醛(過濾除菌)。在發酵過程中,當葡萄糖或丙醛的量不足時,適當補加,并用NaOH溶液來調節發酵液的pH,使其維持在7.0左右。當在培養基中添加丁醛作為醛受體(加入丁醛的終濃度為40 mmol/L),發酵流程參考丙醛為醛受體的發酵。當產物的量沒有顯著增加時,結束發酵,整個發酵過程約為40 h。
1.5 稀有酮糖的分離和純化
發酵結束后對發酵液進行離心(4 000 g,20 min,4℃),將上清液轉移到燒瓶中進行減壓濃縮。濃縮產物用硅膠純化,流動相為二氯甲烷∶甲醇為20∶1(v/v),流出液按照先后順序進行依次收集,首先初步判定目的產物位于哪些離心管中,然后以二氯甲烷∶甲醇20∶1(v/v)為展開劑并以體外合成的相應酮糖產物作為對照,通過TLC檢測來確定含有目的產物的洗脫液。收集目標洗脫液,濃縮、干燥、稱重,用1H-NMR檢測純度。
1.6 同位素標記實驗
將過夜培養的大腸桿菌菌液以1/50的比例轉接到以5 g/L13C全標記葡萄糖作為碳源,鏈霉素終濃度為100 μg/mL的M9培養基中(100 mL)。整個發酵過程參照1.4。當葡萄糖利用完全且產物的量沒有顯著變化時終止發酵。產物的分離純化參照1.5,并用13C NMR檢測。
1.7 分析方法
HPLC檢測條件如下:色譜柱型號為 Bio-Rad HPX-87H(300 mm×7.8 mm,氫型陽離子交換柱),流動相為5 mmol/L H2SO4,流速為0.5 mL/min,柱溫為60℃,示差檢測器檢測。
2 結果和討論
2.1 構建重組表達質粒CDF-fda-yqaB
首先驗證重組質粒CDF-fda是否構建成功,通過BamHI,PstI雙酶切能夠檢測到fda基因(888 bp)大小的片段(圖1-a),表明fda基因片段已經插入到CDFDuet-1質粒中并對fda基因進行測序。為了驗證表達質粒CDF-fda-yqaB是否構建成功,經過BamHI,XhoI雙酶切能夠檢測到大約1 600 bp大小的片段(圖1-b),根據基因fda和yqaB的大小,可以推斷yqaB基因已經成功插入到質粒CDF-fda并進一步對yqaB基因進行測序。
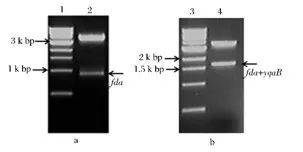
圖1 重組質粒CDF-fda-yqaB的構建Fig.1 Construction of the recombinant plasmid CDF-fda-yqaB
2.2 醛縮酶FruAS.car和磷酸酶YqaB在大腸桿菌中的表達
使用重組表達質粒CDF-fda-yqaB在大腸桿菌BL21Star(DE3)同時過量表達醛縮酶FruAS.car和磷酸酶YqaB。理論上,FruAS.car和YqaB蛋白的分子質量分別為32.855 kDa和20.78 kDa。從SDS-PAGE圖來看(圖2),這兩種蛋白的大小基本上與理論值一致,從而說明醛縮酶FruAS.car和磷酸酶YqaB成功得到了表達。
2.3 以丙醛(丁醛)為醛受體發酵制備稀有酮糖
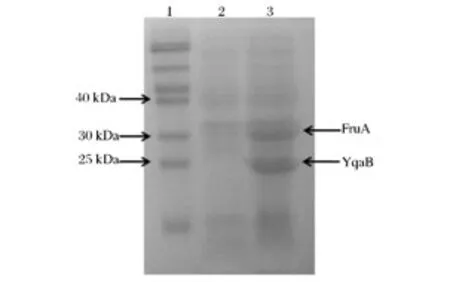
圖2 SDS-PAGE檢測FruAS.car和YqaB的表達Fig.2 SDS-PAGE analysis of the expression of FruAS.carand YqaB
在前期體外實驗中,利用醛縮酶FruAS.car分別以丙醛、丁醛等受體合成了D-蘇式-5,6-二脫氧-2-己酮糖、D-蘇式-5,6,7-三脫氧-2-庚酮糖等稀有酮糖[9]。在體外實驗中,酸性磷酸酶(AP)常用來脫磷酸化得到相應酮糖[9],由于AP的最適pH偏酸性,不適合在大腸桿菌細胞內的脫磷酸化。通過查閱文獻發現來源于大腸桿菌的磷酸酶YqaB在中性pH(生理條件下)具有較強的磷酸酶活性[10]。首先在體外實驗中研究YqaB磷酸酶對底物D-蘇式-5,6-二脫氧-2-己酮糖-1-磷酸和 D-蘇式-5,6,7-三脫氧-2-庚酮糖 1-磷酸的脫磷酸化作用,通過TLC檢測發現該磷酸酶可以脫掉相應酮糖-1-磷酸的磷酸基團得到相應的酮糖(未顯示結果)。為了在大腸桿菌合成如上兩種稀有酮糖,以BL21Star(DE3)/CDF-fda-yqaB作為發酵菌株,以廉價的葡萄糖作為碳源,分別在培養基中添加丙醛、丁醛作為醛受體,進行相應酮糖的合成。為了檢測是否有目標酮糖產物的生成,對發酵液上清進行HPLC檢測,并分別以體外合成純化的兩種稀有酮糖作為對照。由圖3可以看到,D-蘇式-5,6-二脫氧-2-己酮糖能夠被檢測到(如箭頭所示);由圖4可以看到,D-蘇式-5,6,7-三脫氧-2-庚酮糖能夠被檢測到(如箭頭所示)。從而說明分別以丙醛、丁醛為受體,能夠分別在大腸桿菌中合成相應的稀有酮糖。
當在培養基中添加丙醛作為醛受體,對于2 L的發酵,發酵上清液經過硅膠純化,能夠制備D-蘇式-5,6-二脫氧-2-己酮糖(300 mg);當在培養基中添加丁醛作為醛受體(2 L),發酵液經過純化,能夠制備D-蘇式-5,6,7-三脫氧-2-庚酮糖(321 mg)。純化后的酮糖產物用1H NMR進行確認,如圖5所示。總體上來說,以丙醛、丁醛為醛受體的發酵,分離純化后得到相應稀有酮糖的產量比較低,分析其可能的原因如下:由FruAS.car醛縮酶體外合成實驗可以推斷,和D-甘油醛相比,FruAS.car醛縮酶對丙醛、丁醛的活性比較低;YqaB磷酸酶對D-果糖-1-磷酸具有較高的磷酸酶活性,而對 D-蘇式-5,6-二脫氧-2-己酮糖-1-磷酸和 D-蘇式-5,6,7-三脫氧-2-庚酮糖-1-磷酸脫磷酸基團的活性比較低;丙醛、丁醛對大腸桿菌菌體生長具有抑制作用。為了提高產量,一方面對調節DHAP合成的上游基因過量表達,同時敲除DHAP的代謝支路在胞內積累DHAP的量;另一方面對發酵條件進行優化,比如優化丙醛、丁醛加入的量等。

圖3 HPLC檢測在大腸桿菌中合成D-蘇式-5,6-二脫氧-2-己酮糖Fig.3 HPLC analysis of the production of 5,6-dideoxy-D-threo-2-hexulose in E.coli
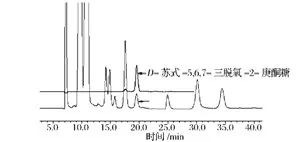
圖4 HPLC檢測在大腸桿菌中合成D-蘇式-5,6,7-三脫氧-2-庚酮糖Fig.4 HPLC analysis of the production of 5,6,7-trideoxy-D-threo-heptulose
2.4 同位素標記實驗
經過羥醛縮合反應得到的稀有酮糖包含兩部分,第1,2,3位的碳原子來源于供體DHAP,其余碳原子來源于醛受體。為了證實產物從DHAP而來的3個碳原子最終從葡萄糖而來,以BL21Star(DE3)/CDF-fda-yqaB作為工程菌,以13C同位素全標記的葡萄糖作為唯一碳源并在培養基中添加丙醛進行發酵。發酵結束后,經過分離純化得到 D-蘇式-5,6-二脫氧-2-己酮糖(25 mg)。通過對酮糖產物進行13C NMR分析檢測,可以得知產物的1位碳對應著位于65 ppm位置的峰,產物的2位碳對應著位于210 ppm位置的峰,產物的3位碳對應著76 ppm位置的峰(圖6),從而證明推斷。
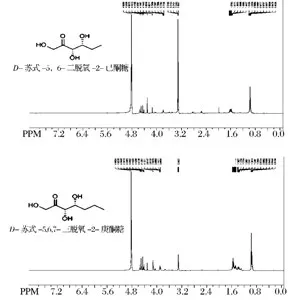
圖5 純化后產物1H NMR鑒定Fig.5 Characterization of products afterpurification by1H NMR
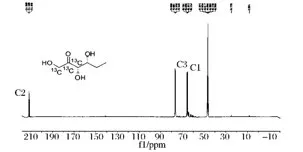
圖6 13C NMR分析同位素標記的產物Fig.6 13C NMR analysis of the product from the isotope experiment
3 結論
以過量表達FruAS.car醛縮酶和YqaB磷酸酶的大腸桿菌工程菌作為發酵菌株,以便宜的葡萄糖為碳源,通過糖酵解途徑在胞內產生DHAP,分別在培養基中添加丙醛或丁醛作為受體,進行了相應稀有酮糖D-蘇式-5,6-二脫氧-2-己酮糖和 D-蘇式-5,6,7-三脫氧-2-庚酮糖的合成,從而成功地將FruA醛縮酶催化的羥醛縮合反應在大腸桿菌中實現。具有重要意義的是在磷酸酶YqaB作用下,羥醛縮合產物能夠在胞內實現脫磷酸生成沒有磷酸基團的酮糖,有利于產物穿過細胞膜進入到胞外,便于分離和純化,同時實現了磷酸基團在胞內的再次利用。然而由于酮糖產量相對較低,擬采用分子生物學的方法提高胞內DHAP水平和優化發酵條件來提高產量。此外,同位素標記實驗證實了酮糖產物從DHAP而來的3個碳原子最終是從葡萄糖而來。
[1] Samland A K,Sprenger G A.Microbial aldolases as C-C bonding enzymes-unknown treasures and new developments[J].Applied Microbiology and Biotechnology,2006,71(3):253-264.
[2] Castillo J A,Calveras J,Casas J,et al.Fructose-6-phosphate aldolase in organic synthesis:preparation of D-fagomine,N-alkylated derivatives,and preliminary biological assays[J].Organic Letters,2006,8(26):6 067-6 070.
[3] Iturrate L,Sanchez-Moreno I,Oroz-Guinea I,et al.Preparation and characterization of a bifunctional aldolase/kinase enzyme:a more efficient biocatalyst for C-C bond formation[J].Chemistry,2010,16(13):4 018-4 030.
[4] Machajewski T D,Wong C H.The catalytic asymmetric aldol reaction[J].Angewandte Chem-International Edition,2000,39(8):1 352-1 374.
[5] Clapes P,Fessner W D,Sprenger G A,et al.Recent progress in stereoselective synthesis with aldolases[J].Current Opinion in Chemical Biology,2010,14(2):154-167.
[6] Sugiyama M,Hong Z,Greenberg W A,et al.In vivo selection for the directed evolution of L-rhamnulose aldolase from L-rhamnulose-1-phosphate aldolase(RhaD)[J].Bioorganic Medicinal Chemistry Letters,2007,15(17):5 905-5 911.
[7] Breuer M,Hauer B.Carbon-carbon coupling in biotransformation[J].Current Opinion in Biotechnology,2003,14(6):570-576.
[8] Sanchez-Moreno I,Garcia-Garcia J F,Bastida A,et al.Multienzyme system for dihydroxyacetone phosphate-dependent aldolase catalyzed C-C bond formation from dihydroxyacetone[J].Chemical Communications(Camb),2004,(14):1 634-1 635.
[9] LI Z,CAI L,WEI M,et al.One-pot four-enzyme synthesis of ketoses with fructose 1,6-bisphosphate aldolases from Staphylococcus carnosus and rabbit muscle[J].Carbohydrate Research,2012,357:143-146.
[10] Kuznetsova E,Proudfoot M,Gonzalez C F,et al.Genomewide analysis of substrate specificities of the Escherichia coli haloacid dehalogenase-like phosphatase family[J].Journal of Biological Chemistry,2006,281(47):36 149-36 161.

