三種有機膦酸阻垢劑對碳酸鈣晶面吸附作用的分子動力學研究
(青海黃河上游水電開發有限責任公司新能源分公司,青海西寧810008)
多晶硅生產裝置的連續穩定運行,需要對循環冷卻水系統進行日常維護。碳酸鈣垢是循環冷卻水系統中最常見的水垢之一,碳酸鈣垢附著在換熱器管壁會影響裝置的換熱效果,造成多晶硅各工藝段物料達不到要求的溫度,影響產品品質。結垢嚴重還會造成換熱器堵塞、管內壓力增大、物料泄漏,引發安全事故。碳酸鈣晶型存在的形式主要有3種:方解石(calcite)、文石(aragonite)和球霰石(vaterite)[1-2]。常溫常壓下,方解石是碳酸鈣顆粒在熱力學上最穩定的結晶相[3],而文石和球霰石是亞穩晶型,很容易轉變為方解石[4]。因此,如何抑制方解石晶體生長已成為多晶硅生產的研究熱點。
有機膦酸阻垢劑具有良好的化學穩定性、協同效應和一定的閾值效應,對Ca2+、Ba2+和Mg2+等多種金屬離子具有較強的螯合作用,能夠很好地抑制碳酸鈣垢的生長,而且不需調節循環水系統的pH 值,因此被廣泛應用于循環冷卻水系統中[5-9]。Bromley等[10]研究表明,有機膦酸阻垢劑至少要含有2個以上的膦酸基團才能達到良好的阻垢效果。
作者在此選擇氨基三亞甲基膦酸(NTMP)、乙二胺四亞甲基膦酸(EDTMP)和二乙烯三胺五亞甲基膦酸(DTPMP)[11]3 種有機膦酸阻垢劑,基于Material Studio 3.0軟件,采用分子動力學模擬方法研究其與碳酸鈣晶面之間的吸附作用,探討其阻垢能力的強弱和吸附作用的本質,為闡述阻垢機理提供理論依據。
1 模擬
由于多晶硅生產的實際循環冷卻水系統的pH 值大約在8~10之間,水溫約為70 ℃左右,在此條件下有機膦酸基團會發生脫氫,形成質子化PO2-3基團。NTMP、EDTMP 和DTPMP 去質子化分子結構如圖1所示。
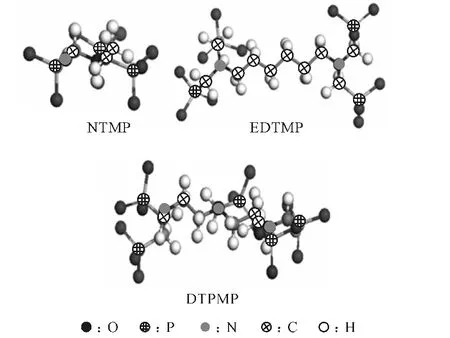
圖1 3種有機膦酸阻垢劑的去質子化分子結構Fig.1 The deprotonated molecular structures of three organic phosphonate scale inhibitors
由圖1可以看出:NTMP是1個N 原子上連接3個亞甲基膦酸基團(-CH2-PO2-3);EDTMP 是2個N 原子上分別連接2個-CH2-PO2-3基團;DTPMP是在3個N 原子上連接5個-CH2-PO2-3基團,含膦酸基團數最多。
方解石屬于R-3C 空間群,六方晶系,晶胞參數為:a=b=4.99 ?、c=17.06 ?、α=β=90.0°、γ=120.0°。方解石晶體形態學上最穩定的生長面是(104)面和(110)面[12-13],因此選擇其作為本研究的目標晶面。借助Cleave Surface工具進行切割分面來得到要考察的方解石習性面。考慮到計算成本,先對(104)面和(110)面設置3×3×3超晶胞,建立方解石晶面層;再采用Smart Minimizer方法對方解石晶面層進行能量最小化,優化步數為10 000,收斂水平為精細,目的是消除超晶胞結構中不合理的能量和構象;然后采用Smart Minimizer方法對目標分子的初始結構進行幾何優化,步數為10 000,收斂水平為精細,得到勢能面上最穩定的阻垢劑分子結構;將優化的有機膦酸阻垢劑分子沿Z軸方向放置在晶面層上方,真空層厚度設置為50?,并應用周期性邊界條件建立有機膦酸阻垢劑分子-方解石晶面吸附模型;最后,設置水的介電常數(ε=78)來近似模擬水溶液環境。
COMPASS力場[14]能夠準確模擬凝聚態的結構和性質,而且能將混合體系分類計算,因此,選擇COMPASS力場作為模擬力場。在分子動力學模擬之前,首先對吸附模型的初始結構執行能量最小化。對于分子動力學模擬,將晶面層固定,而有機膦酸阻垢劑分子可以自由運動。采用NVT 系統,選擇Andersen方法控溫,溫度設定為350K 來模擬循環水環境溫度。模擬時間根據平衡依據及前人的研究先進行200 ps動力學模擬平衡;再執行200ps進行數據采集,每100fs輸出一個結果;統計最后50ps的輸出結果進行數據分析。采用Atom Based和Ewald方法分別計算范德華力和靜電作用力,應用long-range校正。
有機膦酸阻垢劑分子與方解石晶面之間的吸附能(ΔEads)按式(1)計算[15]:

式中:Esys為動力學模擬后有機膦酸阻垢劑分子與方解石晶面吸附體系的總能量;Esur為方解石晶面層的能量;Einhib為模擬計算后有機膦酸阻垢劑分子的單點能。
2 結果與討論
2.1 體系平衡
一個體系是否達到動力學平衡,可以根據模擬過程中的溫度和能量平衡曲線來判斷。一般認為,如果溫度和能量曲線的上下波動在5%~10%范圍內,那么可以認為體系達到了動力學平衡。圖2是有機膦酸阻垢劑EDTMP與方解石(104)面吸附體系的溫度和能量平衡曲線。
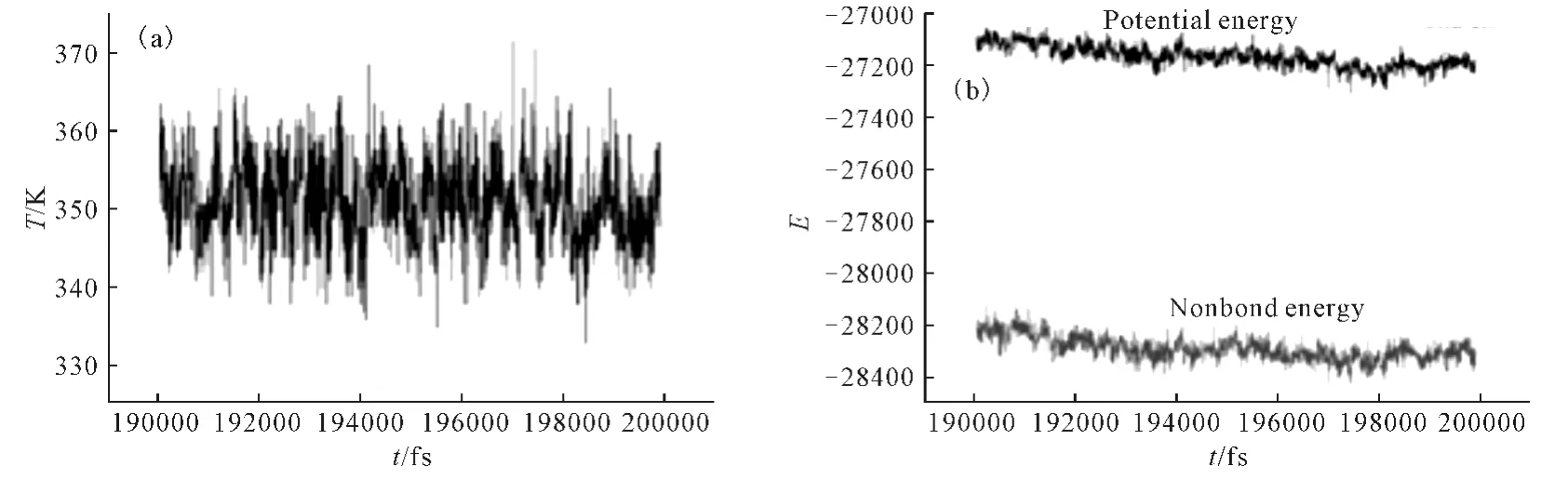
圖2 EDTMP與方解石(104)面吸附體系的溫度(a)和能量(b)平衡曲線Fig.2 Temperature(a)and energy(b)equilibrium curves of EDTMP-calcite(104)face adsorption system
由圖2可看出:溫度在(350±10)K 范圍內上下波動,表明體系已處于溫度平衡;能量平衡曲線光滑平整,表明體系實現了能量平衡。因此,阻垢劑EDTMP與方解石(104)面的吸附體系達到了分子動力學平衡,后續計算結果是可靠的。另2種有機膦酸阻垢劑與方解石晶面吸附體系也可以得到以上結論。
2.2 吸附作用
以EDTMP 為例建立有機膦酸阻垢劑分子-方解石晶面的吸附模型,如圖3所示。
由圖3可看出,有機膦酸阻垢劑EDTMP 在吸附前的初始位置與晶面保持了一定的距離,以獲得足夠的空間使其自身彎曲形變;吸附平衡時,靠近方解石晶面,表明二者之間存在著強的吸附作用。另2種有機膦酸阻垢劑NTMP、DTPMP 在吸附平衡時,也不同程度地靠近方解石晶面(圖略)。
表1列出了3種有機膦酸阻垢劑與方解石晶面之間的吸附能。
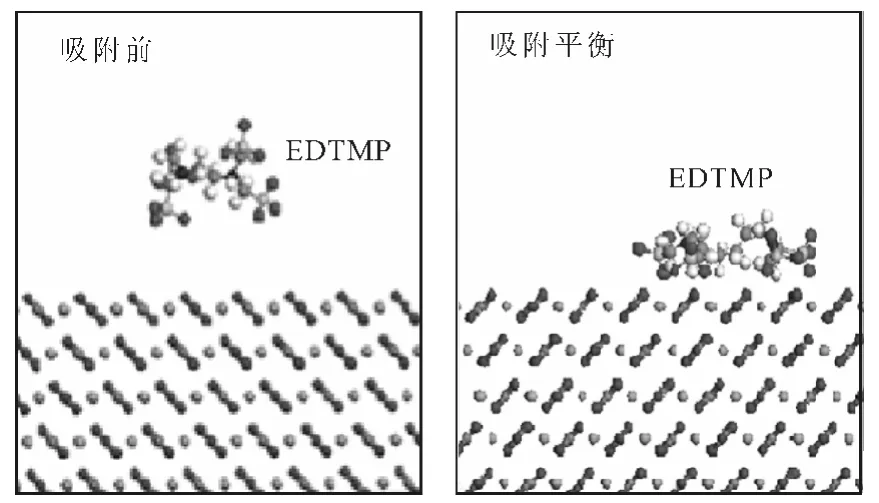
圖3 有機膦酸阻垢劑分子-方解石晶面的吸附模型Fig.3 Adsorption model of organic phosphonate scale inhibitor-calcite crystal surface

表1 3種有機膦酸阻垢劑與方解石晶面之間的吸附能/(kcal·mol-1)Tab .1 Adsorption energies between three organic phosphonate scale inhibitors and calcite crystal surfaces/(kcal·mol-1)
由表1可知:(1)吸附能均為負值,表明阻垢劑分子對方解石晶面的吸附是一個放熱過程。DTPMP分子與(110)面的吸附能最大(-160.12kcal·mol-1),而NTMP分子與(104)面的吸附能最小(-82.90kcal·mol-1)。(2)3種有機膦酸阻垢劑對碳酸鈣晶面吸附作用順序為DTPMP>EDTMP>NTMP。(3)3種有機膦酸阻垢劑對(110)面的吸附作用均強于其對(104)面的吸附作用。
表2是有機膦酸阻垢劑與方解石晶面之間吸附能的組成。

表2 有機膦酸阻垢劑與方解石晶面之間吸附能的組成/(kcal·mol-1)Tab.2 Composition of adsorption energies between organic phosphonate scale inhibitors and calcite crystal surfaces/(kcal·mol-1)
由表2可以看出,吸附能主要由范德華作用能和靜電作用能組成,其中靜電作用能遠大于范德華作用能,對吸附作用的貢獻占主導位置。Chen等[16]認為基團的O 原子會與晶面的Ca2+形成離子鍵,其鍵長接近Ca-O 離子鍵鍵長。表明有機膦酸阻垢劑分子與碳酸鈣晶面之間能發生很強的靜電作用,從而解釋了靜電作用能的貢獻要遠遠強于范德華作用能。Gill等[17]提出阻垢劑與成垢晶面之間的吸附作用主要是靜電作用力,與本研究的結果一致。
吸附能越大,阻垢劑與成垢晶面之間的吸附作用就越強。有機膦酸阻垢劑分子可以通過與晶面之間的吸附作用占據碳酸鈣晶面的活性生長點,從而破壞成垢晶面的正常生長,導致晶格發生轉換,進而抑制碳酸鈣垢的形成,最終達到阻垢效果。
因此,根據有機膦酸阻垢劑對方解石晶面的吸附作用,可以得出3種有機膦酸阻垢劑的阻垢作用順序為:DTPMP>EDTMP>NTMP,這可能與3 種有機膦酸阻垢劑分子中所含基團個數及N 原子之間碳鏈長度不同有關[10]。此外,有機膦酸阻垢劑分子對碳酸鈣(110)面的吸附作用強于(104)面,即與(110)面的結合比(104)面更牢固,可以推測有機膦酸阻垢劑分子會優先吸附在碳酸鈣(110)面上。
3 結論
通過對3種典型有機膦酸阻垢劑(NTMP、EDTMP、DTPMP)與碳酸鈣晶面吸附作用的分子動力學研究,發現NTMP、EDTMP 和DTPMP 分子能夠牢牢吸附在方解石晶面上,而吸附能均為負值,表明吸附過程為放熱過程,有機膦酸分子能夠自發吸附在晶面上;有機膦酸阻垢劑分子對碳酸鈣(110)面的吸附作用強于(104)面,即有機膦酸阻垢劑分子會優先吸附在(110)面上;吸附能主要由靜電作用能和范德華作用能組成,其中靜電作用能遠大于范德華作用能,占主導作用;3種有機膦酸阻垢劑對方解石晶面吸附作用的順序為DTPMP>EDTMP>NTMP,對碳酸鈣垢的阻垢作用順序為DTPMP>EDTMP>NTMP,吸附作用越大,對碳酸鈣垢抑制作用就越強。
[1]GREENLEE L F,TESTA F,LAWLER D F,et al.The effect of antiscalant addition on calcium carbonate precipitation for a simplified synthetic brackish water reverse osmosis concentrate[J].Water Research,2010,44(9):2957-2969.
[2]YANG Y,KIM H,STARIKOVSKIY A,et al.Application of pulsed spark discharge for calcium carbonate precipitation in hard water[J].Water Research,2010,44(12):3659-3668.
[3]MILLO C,ADER M,DUPRAZ S,et al.Carbon isotope fractiona-tion during calcium carbonate precipitation induced by urease-catalysed hydrolysis of urea[J].Chemical Geology,2012,330-331:39-50.
[4]LUPU C,ARVIDSON R S,LUTTGE A,et al.Phosphonate mediated surface reaction and reorganization:Implications for the mechanism controlling cement hydration inhibition[J].Chem Commun,2005,(18):2354-2356.
[5]LESUEUR C,PFEFFER M,FUERHACKER M.Photodegradation of phosphonates in water[J].Chemosphere,2005,59(5):685-691.
[6]JONASSON R G,RISSPLER K,WIWCHAR B,et al.Effect of phosphonate inhibitors on calcite nucleation kinetics as a function of temperature using light scattering in an autoclave[J].Chem Geology,1996,132(1-4):215-225.
[7]LI T T,SHI F F,LI F C,et al.Effects of dry grinding on the structure and granularity of calcite and its polymorphic transformation into aragonite[J].Powder Technology,2014,254:338-343.
[8]REDDY M M.Calcite growth-rate inhibition by fulvic acid and magnesium ion—Possible influence on biogenic calcite formation[J].Journal of Crystal Growth,2012,352(1):151-154.
[9]ASAEDA T,SENAVIRATHNA M D H J,KANEKO K,et al.Effect of calcium and magnesium on the growth and calcite encrustation ofCharafibrosa[J].Aquatic Botany,2014,113:100-106.
[10]BROMLEY L A,COTTIER D,DAVEY R J,et al.Interactions at the organic/inorganic interface:Molecular design of crystalli-zation inhibitors for barite[J].Langmuir,1993,9(12):3594-3599.
[11]TOMSON M B,KAN A T,ODDO J E.Acid/base and metal complex solution chemistry of the polyphosphonate DTPMP versus temperature and ionic strength[J].Langmuir,1994,10(5):1442-1449.
[12]DUFFY D M,HARDING J H.Modeling the interfaces between calcite crystals and Langmuir monolayers[J].J Mater Chem,2002,12:3419-3425.
[13]VILLEGAS-JIMENE Z A,MUCCI A,WHITEHEAD M A.Theoretical insights into the hydrated(10.4)calcite surface:Structure,energetic and bonding relationships[J].Langmuir,2009,25(12):6813-6824.
[14]SUN H.COMPASS:An ab initio force-field optimized for condensed-phase applications—Overview with details on alkane and benzene compounds[J].The Journal of Physical Chemistry B,1998,102(38):7338-7364.
[15]COOPER T G,de LEEUW N H.A computer modeling study of the competitive adsorption of water and organic surfactants at surfaces of the mineral scheelite[J].Langmuir,2004,20(10):3984-3994.
[16]CHEN C Y,LEI W,XIA M Z,et al.Molecular modeling of several phosphonates onto the stepped calcite(011)surface[J].Desalination,2013,309:208-212.
[17]GILL J S,VARSANIK R G.Computer modeling of the specific matching between scale inhibitors and crystal structure of scale forming minerals[J].J Cryst Growth,1986,76(1):57-62.

