一種手性甾體酰胺化合物的蛋白結(jié)合特征研究
(荊楚理工學(xué)院化工與藥學(xué)院,湖北荊門448000)
甾體化合物有較強(qiáng)的細(xì)胞穿透性和良好的膜接受性,在動植物生命活動中發(fā)揮著重要作用[1]。研究發(fā)現(xiàn),甾體酰胺類化合物大都表現(xiàn)出良好的抗腫瘤、抗菌、抑制5α-還原酶等生物活性,且甾體結(jié)構(gòu)的微小變化可能引起此類化合物生理活性的巨大改變[2]。因此,通過對甾體母核或支鏈結(jié)構(gòu)進(jìn)行修飾、研究其構(gòu)效關(guān)系,以得到具有更高生物活性或特殊生理功能的甾體化合物,已成為化學(xué)和生命科學(xué)領(lǐng)域的熱點(diǎn)課題之一[3]。目前,越來越多新的甾體酰胺化合物被合成出來,其中許多已被證實(shí)具有重要的藥理活性,3β-乙酰氧基-17-氮雜-D-h(huán)omo-5-雄甾烯-17-酮(3β-acetoxy-17-aza-D-h(huán)omo-5-androsten-17-one,AHAO)便是其中的一種。AHAO 是具有手性的甾體酰胺化合物,對Hela細(xì)胞有很好的抑制作用[4],表現(xiàn)出了較為理想的抗癌活性,但其具體的藥理活性機(jī)制尚不明確。
鑒于此,作者參照文獻(xiàn)合成了化合物AHAO,并利用光譜技術(shù)研究了AHAO 與人血清白蛋白(HSA)的相互作用,獲取了AHAO 與HSA 的結(jié)合位點(diǎn)、結(jié)合作用力強(qiáng)弱、結(jié)合反應(yīng)的熱力學(xué)性質(zhì)等方面的信息,有助于深入理解AHAO 在人體內(nèi)的運(yùn)輸過程、吸收效率、活性機(jī)理。
1 實(shí)驗(yàn)
1.1 試劑與儀器
磷酸鹽緩沖溶液(pH=7.40,NaCl 0.15 mol·L-1);2.0×10-4mol·L-1HSA 工作液,美國Sigma公司;2.0×10-5mol·L-1AHAO 工作液(純度>99%),自制。
LS-55型熒光分光光度計,Perkin Elmer;YB12型超級恒溫水浴鍋,Prima;J-810 型圓二色譜儀,Jasco;AUY220型電子分析天平,Shimadzu。
1.2 AHAO 的合成路線(圖1)
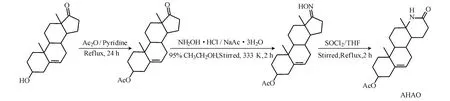
圖1 AHAO 的合成路線Fig.1 The synthetic route of AHAO
1.3 方法
向10mL比色管中加入適量HSA 工作液,然后加入一定量的AHAO 工作液,以磷酸鹽緩沖溶液定容,充分混合均勻后置于超級恒溫水浴鍋中靜置30 min。設(shè)定單色器激發(fā)狹縫寬度、發(fā)射狹縫寬度分別為15nm、4nm,以290nm 的紫外光照射樣品,在300~420nm 波長范圍內(nèi)掃描并記錄HSA-AHAO 體系的發(fā)射光譜。
2 結(jié)果與討論
2.1 AHAO 對HSA 的熒光光譜的影響
HSA 分子含有帶芳香性側(cè)鏈的不飽和氨基酸殘基,能夠吸收紫外輻射誘發(fā)價電子躍遷;若激發(fā)態(tài)價電子以非輻射的形式失活,則可發(fā)射出熒光。藥物分子在與蛋白質(zhì)作用時,可能因?yàn)榉N種原因?qū)е碌鞍踪|(zhì)內(nèi)源熒光猝滅。
不同濃度AHAO 對HSA 熒光發(fā)射光譜的影響如圖2所示。

圖2 不同濃度AHAO 對HSA熒光光譜的影響Fig.2 Effect of different concentrations of AHAO on fluorescence spectra of HSA
2.2 熒光猝滅機(jī)理
導(dǎo)致熒光猝滅的原因很多,如分子碰撞、基態(tài)復(fù)合物的生成、溶解氧,就猝滅機(jī)理而言,主要有動態(tài)猝滅和靜態(tài)猝滅。動態(tài)猝滅是激發(fā)態(tài)分子之間的相互碰撞使得單重電子激發(fā)態(tài)電子以輻射的形式失活引起的,其熱力學(xué)性質(zhì)可以用Stern-Volmer方程描述[5]:

式中:F0為無猝滅劑時蛋白質(zhì)的熒光強(qiáng)度;F為加入猝滅劑后蛋白質(zhì)-猝滅劑體系的熒光強(qiáng)度;KSV為動態(tài)熒光猝滅常數(shù)(L·mol-1),反映了蛋白質(zhì)與猝滅劑在彼此擴(kuò)散和相互碰撞達(dá)到動態(tài)平衡時的量效關(guān)系;[Q]為猝滅劑的平衡濃度;Kq為動態(tài)熒光猝滅的速率常數(shù)(L·mol-1·s-1),反映了體系中分子彼此擴(kuò)散和碰撞對熒光體熒光壽命衰減速率的影響;τ0為無猝滅劑時熒光分子的平均壽命[6]。
為了判斷AHAO 對HSA 的熒光猝滅機(jī)理,先以動態(tài)猝滅來處理,Stern-Volmer方程擬合的曲線方程如圖3所示,根據(jù)方程計算得到的不同溫度下的動態(tài)猝滅常數(shù)KSV見表1。
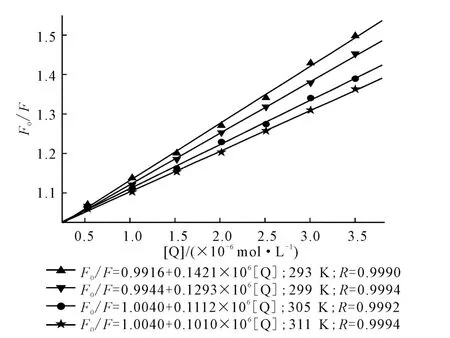
圖3 Stern-Volmer曲線及方程Fig.3 Stern-Volmer curves and equations
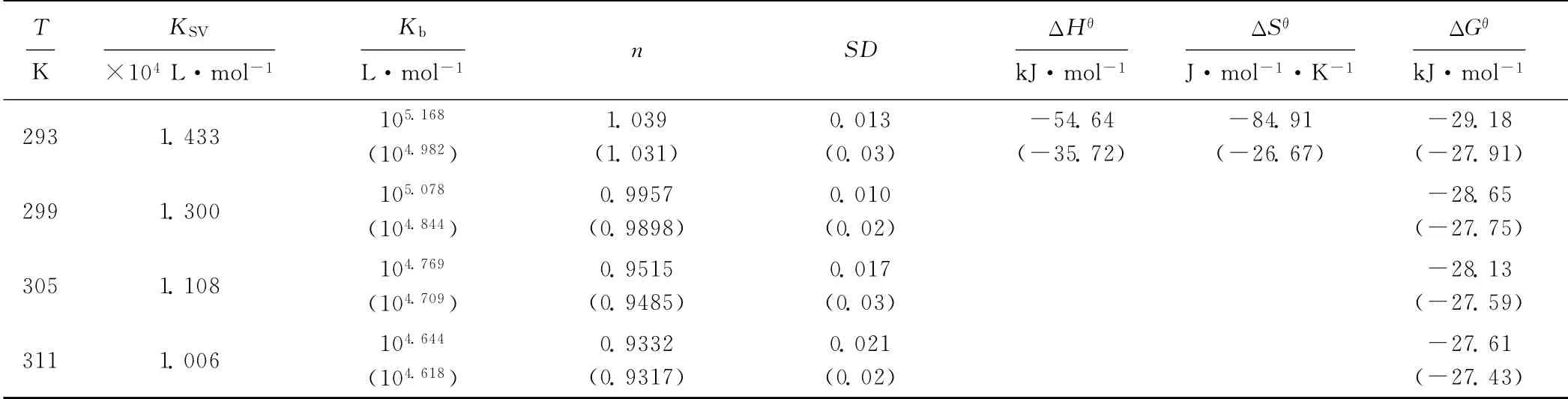
表1 AHAO 與HSA作用的結(jié)合常數(shù)、結(jié)合位點(diǎn)數(shù)和熱力學(xué)常數(shù)Tab.1 Binding constants,binding sites and thermodynamics parameters of interaction between AHAO and HSA
動態(tài)猝滅是分子間碰撞所致,溫度升高將增加分子間有效碰撞次數(shù),加速電子轉(zhuǎn)移和能量傳遞,從而得到更高的動態(tài)猝滅常數(shù)[7]。但從表1看出,293K 時的動態(tài)猝滅常數(shù)KSV為1.433×104L·mol-1,311K時減小到1.006×104L·mol-1,這與動態(tài)猝滅的定義并不相符,表明,AHAO 對HSA 的熒光猝滅機(jī)理不是動態(tài)猝滅,而是靜態(tài)猝滅。
在靜態(tài)猝滅中,小分子與生物大分子結(jié)合,其結(jié)合常數(shù)(Kb)和結(jié)合位點(diǎn)數(shù)(n)可由式(2)計算:

log(F0/F-1)與log[Q]呈線性關(guān)系,斜率為結(jié)合位點(diǎn)數(shù)n,截矩為logKb,如圖4所示。
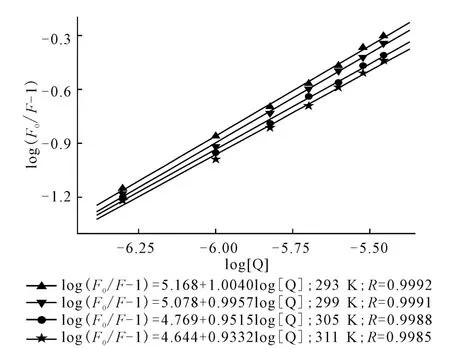
圖4 不同溫度下的log(F0/F-1)-log[Q]曲線Fig.4 log(F0/F-1)-log[Q]Plots at different temperatures
由圖4可看出,線性回歸曲線的斜率接近1,這表明在特定條件下,HSA 分子中只有1個與AHAO 具有高親和力的結(jié)合位點(diǎn);隨著溫度的升高,AHAO 與HSA 作用的結(jié)合常數(shù)Kb值減小,結(jié)合位點(diǎn)數(shù)n也相應(yīng)減少。
2.3 結(jié)合反應(yīng)的熱力學(xué)性質(zhì)
HSA-AHAO 相互作用的焓變和熵變是確定結(jié)合機(jī)理的重要參數(shù)。由于實(shí)驗(yàn)是在一個大氣壓條件下進(jìn)行,故結(jié)合作用的熱效應(yīng)和熵變可以由Van′t Hoff方程求取:以lnK對1/T作圖,擬合得到Van′t Hoff方程,如圖5所示。

ΔHθ和ΔSθ可根據(jù)方程的截矩和斜率作簡單變換得到。而吉布斯自由能ΔGθ則由吉布斯-亥姆霍茲方程(式4)求算,結(jié)果見表1。


圖5 Van′t Hoff方程Fig.5 Van′t Hoff Plot
由表1可看出,ΔHθ和ΔGθ均為負(fù)值,說明HSAAHAO 的相互作用是能夠自發(fā)進(jìn)行的放熱過程;而且與相同條件下的母體酮相比,甾體酰胺化合物AHAO與HSA 反應(yīng)的自發(fā)程度和放熱效應(yīng)都有所增強(qiáng)。
2.4 結(jié)合作用力類型
Ross等[8]指出,如果體系的ΔH和ΔS都增大,作用力一般為疏水作用力;若ΔH和ΔS都減小,作用力可能為氫鍵和范德華力;若ΔH≈0、ΔS>0,一般是靜電作用力的特征。可見,氫鍵和范德華力對于維持HSA-AHAO 復(fù)合物的結(jié)構(gòu)起到主要作用。
2.5 AHAO 對HSA二級結(jié)構(gòu)的影響
在一定波長范圍內(nèi),如果記錄下左旋偏振光和右旋偏振光隨波長連續(xù)變化的情況,并對波長作圖,就可以得到該物質(zhì)的圓二色譜(CD 譜)[9]。HSA 和HSAAHAO 體系的圓二色譜如圖6所示。
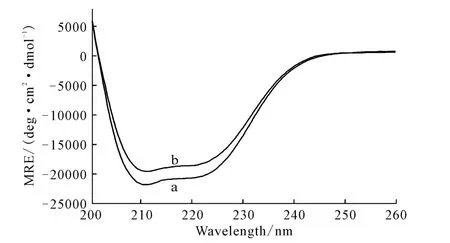
圖6 HSA(a)和HSA-AHAO體系(b)的圓二色譜Fig.6 The CD spectra of HSA(a)and HSA-AHAO system(b)
用計算機(jī)程序計算AHAO 作用前后HSA 二級結(jié)構(gòu)中α-螺旋、β-折疊、β-轉(zhuǎn)角、無規(guī)卷曲等結(jié)構(gòu)相對含量的變化,結(jié)果見表2。
由表2可看出,與AHAO 作用后,HSA 分子中α-螺旋結(jié)構(gòu)減少,而β-折疊、β-轉(zhuǎn)角、無規(guī)卷曲結(jié)構(gòu)均有所增加。

表2 HSA二級結(jié)構(gòu)相對含量/%Tab.2 Relative contents of different secondary structures of HSA/%
3 結(jié)論
在模擬人體血液離子強(qiáng)度和酸度條件下,甾體酰胺化合物(AHAO)與人血清白蛋白(HSA)依靠氫鍵和范德華力結(jié)合,生成了新的復(fù)合物,猝滅HSA 的內(nèi)源熒光;結(jié)合反應(yīng)的ΔHθ=-54.64kJ·mol-1、ΔSθ=-84.91J·mol-1·K-1,是一個自發(fā)進(jìn)行的放熱過程;與相同條件下的母體酮相比,甾體酰胺化合物AHAO 與HSA 反應(yīng)的自發(fā)程度和放熱效應(yīng)都有所增強(qiáng)。AHAO 的結(jié)合使HSA 分子中α-螺旋結(jié)構(gòu)減少,β-折疊、β-轉(zhuǎn)角、無規(guī)卷曲結(jié)構(gòu)增加,起到調(diào)節(jié)其生理功能的作用。
[1]BELKHADIR Y,CHORY J.Brassinosteroid signaling:A paradigm for steroid hormone signaling from the cell surface[J].Science,2006,314(5804):1410-1411.
[2]ASSELIN-LABAT M L,VAILLANT F,SHERIDAN J M,et al.Control of mammary stem cell function by steroid hormone signalling[J].Nature,2010,465(7299):798-802.
[3]HUNAG Y,CUI J,ZHONG Z,et al.Synthesis and cytotoxicity of 17a-aza-D-h(huán)omo-androster-17-one derivatives[J].Bioorg Med Chem Lett,2011,21(12):3641-3643.
[4]HUANG Y,CUI J,CHEN S,et al.Synthesis and antiproliferative activity of some steroidal lactams[J].Steroids,2011,76(12):1346-1350.
[5]SOCHACKA J,SULKOWSKA A,KOWALSKA A.The binding of the sulfur and oxygen purine derivatives with bovine serum albumin[J].Acta Pol Pharm,2008,65(1):169-171.
[6]熊澤云,張華新,王洪林,等.鑭(Ⅲ)-蕓香甙配合物與人血清白蛋白作用特征的研究[J].化學(xué)與生物工程,2014,31(5):24-27.
[7]HU Y J,OUYANG Y,DAI C M,et al.Site-selective binding of human serum albumin by palmatine:Spectroscopic approach[J].Biomacromolecules,2010,11(1):106-112.
[8]ROSS P D,SUBRAMANIAN S.Thermodynamics of protein association reactions:Forces contributing to stability[J].Biochemistry,1981,20(11):3096-3102.
[9]WHITMORE L,WALLACE B A.Protein secondary structure analyses from circular dichroism spectroscopy:Methods and reference databases[J].Biopolymers,2007,89(5):392-400.

