共價偶聯(lián)法在玻片表面固定適配體的研究
武建超,袁 敏,,徐 斐,曹 慧,于勁松,
(1.上海理工大學(xué)醫(yī)療器械與食品學(xué)院,上海200093;2.上海理工大學(xué)食品質(zhì)量與安全研究所,上海200093)
適配體技術(shù)是分析檢測領(lǐng)域的一項新興技術(shù),主要原理是核酸適配體能夠與靶分子通過氫鍵、疏水作用、范德華力等分子作用發(fā)生特異性的結(jié)合,形成諸如發(fā)夾、凸環(huán)、G-四聚體等特殊三維結(jié)構(gòu),然后利用相關(guān)技術(shù)手段實現(xiàn)靶分子的快速、靈敏、特異性檢測[1]。該法目前被廣泛應(yīng)用于重金屬及DNA、蛋白質(zhì)等生化物質(zhì)的快速靈敏檢測。Zhou等[2]利用有熒光基團修飾的適配體與Ag+發(fā)生特異性的結(jié)合,生成C-Ag-C的雙鏈結(jié)構(gòu),之后通過傳感器即可檢測Ag+含量。有研究者[3-5]利用含2個T 堿基的適配體與Hg2+形成的穩(wěn)定結(jié)構(gòu)檢測水中Hg2+含量。上述研究均是在將特定適配體固定在載體的基礎(chǔ)上實現(xiàn)的。而常見的固定載體包括VT 共聚物、纖維素載體、樹脂、金片、水凝膠載體、玻片等。前5種固定載體存在一定弊端,如較低的固定率、復(fù)雜的操作過程、材料昂貴且較難獲取等。而玻片價格低廉、操作簡單、固定效果較好,作為常用載體被廣泛應(yīng)用于核酸檢測相關(guān)的各項研究[6-8]。
目前,相關(guān)研究多采用經(jīng)過修飾的核酸片段固定到玻片表面或者采用特定基團修飾玻片,應(yīng)用成本相對較高[9],且對玻片固定適配體的條件優(yōu)化尚無深入研究。作者以硅烷化玻片為載體,將未經(jīng)修飾的核酸適配體通過共價偶聯(lián)法直接固定在玻片上,采用單因素實驗考察硅烷化試劑濃度、硅烷化反應(yīng)溫度和時間以及適配體與玻片反應(yīng)時間和溫度、適配體濃度和長度對適配體固定率的影響,優(yōu)化了適配體的固定條件,成功實現(xiàn)了對水溶液中Hg2+的吸附,達(dá)到初步富集和去除Hg2+的功能,為后續(xù)富集水中Hg2+的研究開拓了新的研究思路。
1 實驗
1.1 材料、試劑與儀器
玻片(18mm×18mm×0.17mm);適配體片段:AP-16:5′-AGTGATTCGTATTACC-3′、AP-20:5′-TTTTTTTTTTTTTTTTTTTT-3′、AP-21:5′-TTCTTTCTTGGGTTGTTTTGTT-3′、AP-22:5′-ATCGAGATAGTAAGTGCAATCT-3′、AP-44:5′-ACTACTCTCATCATACTCTGGGGACTGTGTTTGTTGTGTGTTGT-3′、AP-50:5′-ATCGAGATAGTAAGTGCAATCT-3′、AP-76:5′-ATTTTACAGAAC AACCAACGTCGCTCCGGGTACTTCTTC-3′,生工生物工程上海股份有限公司。
γ-縮水甘油醚氧丙基三甲氧基硅烷(GOPS)、1-甲基咪唑、3-(N-嗎啡啉)丙磺酸(MOPS),阿拉丁試劑有限公司;二甲基亞砜、丙酮、無水乙醇、硝酸鈉、氯化鈉、檸檬酸二鈉、氫氧化鈉、濃硝酸、濃鹽酸、濃硫酸、雙氧水,國藥集團化學(xué)試劑有限公司;以上試劑均為分析純。MiliQ 超純水;自制。
TG16-WS型臺式高速離心機,金壇恒豐儀器廠;HH 型系列數(shù)顯恒溫水浴鍋,金壇科析儀器有限公司;FA2204B型電子天平,上海精科天美科學(xué)儀器有限公司;NanoDrop 2000/2000C 型超微量紫外分光光度計,美國賽默飛世爾科技有限公司;普蘭德單道可調(diào)移液器,德國普蘭德公司;調(diào)溫萬用電爐、101A-2S型數(shù)顯不銹鋼電熱鼓風(fēng)干燥箱,上海錦屏儀器儀表有限公司;LHS-150SC型智能恒溫恒濕箱,南通利豪實驗儀器有限公司;GBC 型原子吸收光譜儀,澳大利亞GBC科學(xué)儀器公司。
1.2 緩沖溶液的配制
緩沖溶液:用移液器移取0.1 mL 1-甲基咪唑、1.255mL二甲基亞砜、11.19mL雙蒸水于燒杯中,將pH 值調(diào)至10.0,備用。
1×SSC 緩沖溶液:分別稱取0.876g 氯化鈉、0.411g檸檬酸二鈉,定容于100 mL 容量瓶,之后轉(zhuǎn)移至廣口瓶中,加入鹽酸調(diào)節(jié)pH 值至7.0,備用。
1.3 適配體的固定化
1.3.1 玻片的羥基化
將玻片放入30%雙氧水和98%濃硫酸混合溶液(體積比1∶3)中,于電爐上煮至微沸后取下冷卻至室溫,去除廢液并用大量雙蒸水沖洗玻片數(shù)次,烘干,備用。
1.3.2 玻片的硅烷化
取11.4μL GOPS溶液,加入50mL丙酮溶液中,稀釋成1×10-3mol·L-1的混合溶液。然后將羥基化后的玻片浸入該溶液中,室溫反應(yīng)30min后取出。分別用丙酮和無水乙醇沖洗3 次,以除去未結(jié)合的GOPS,最后將洗凈的玻片烘干。玻片硅烷化的原理如圖1所示。
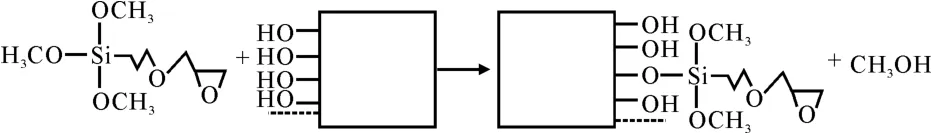
圖1 玻片硅烷化的原理Fig.1 The principle of silylation on the glass chips
1.3.3 適配體在玻片上的固定
分別移取18μL緩沖溶液和1μL 1×10-4mol·L-1的適配體溶液于200μL 離心管中混合均勻,制得濃度為5.3×10-6mol·L-1的反應(yīng)適配體溶液。取9.6μL反應(yīng)適配體溶液均勻涂抹于玻片表面后,將其放至恒溫恒濕培養(yǎng)箱中,45 ℃下反應(yīng)120min[10-13],剩余溶液用于檢測適配體反應(yīng)液的質(zhì)量濃度。適配體在玻片表面固定的原理如圖2所示。

圖2 適配體固定到玻片上的原理Fig.2 The principle of fixing aptamers on the surface of glass chips
1.3.4 適配體固定率的計算
反應(yīng)過后的玻片用1×SSC 緩沖溶液沖洗4 次,再用MiliQ 超純水沖洗2次,共得到96μL的洗脫液,收集于200μL離心管中,混勻2min。用移液器移取2μL樣品滴于檢測儀器上進行檢測,每個樣品平行檢測3次。實驗所用洗脫液的體積為反應(yīng)適配體溶液體積的10倍,通過微量紫外分光光度計對反應(yīng)適配體溶液和洗脫溶液的濃度進行檢測,適配體在玻片上的固定率按式(1)計算:

1.4 適配體對水溶液中Hg2+的吸附
將修飾有適配體的玻片浸沒于20mL 0.1mol·L-1的HgCl2溶液(內(nèi)有1×10-5mol·L-1MOPS,1×10-4mol·L-1NaNO3,pH=11)中,15 ℃下反應(yīng)3h[10]。取出玻片,用少量雙蒸水將玻片表面未結(jié)合適配體的游離Hg2+沖洗干凈,沖洗廢液和浸泡過玻片的溶液合并定容至50mL。用原子吸收光譜儀通過冷原子吸收光譜法檢測廢液中Hg2+的濃度,從而得到玻片上適配體所吸附的汞量,適配體吸附Hg2+的吸附效率按式(2)計算:

式中:c0為浸泡過空白玻片的HgCl2溶液定容至50mL時的Hg2+濃度;c1為與玻片上固定的適配體反應(yīng)后殘余的HgCl2溶液定容至50mL時的Hg2+濃度。
2 結(jié)果與討論
2.1 硅烷化試劑濃度對適配體固定率的影響
將濃度為1.59×10-5mol·L-1的AP-16適配體涂抹在20 ℃下分別用濃度為0 mol·L-1、1×10-3mol·L-1、2×10-3mol·L-1、4×10-3mol·L-1、8×10-3mol·L-1、16×10-3mol·L-1的硅烷化試劑處理30min后的玻片表面,于45℃的恒溫恒濕培養(yǎng)箱中固定化反應(yīng)120min,檢測適配體固定率,結(jié)果見圖3。
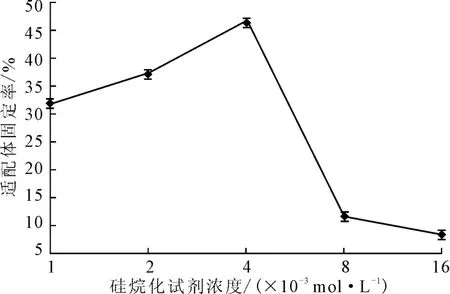
圖3 硅烷化試劑濃度對適配體固定率的影響Fig.3 Effect of concentration of silylation reagent on fixed rate of aptamers
由圖3可知,隨著硅烷化試劑濃度的增大,適配體固定率先升后降,當(dāng)硅烷化試劑濃度為4×10-3mol·L-1時,適配體固定率最高。未進行硅烷化處理的玻片仍然能夠吸附25.23%的適配體。這主要是靠玻片和適配體之間的電荷相互吸引達(dá)到固定效果。而如果硅烷化試劑濃度過高,會使其在玻片表面的密度過大,發(fā)生重疊,降低了環(huán)氧基團與適配體分子的結(jié)合效力,導(dǎo)致適配體固定率降低。因此,硅烷化試劑濃度以4×10-3mol·L-1為宜。
2.2 硅烷化反應(yīng)溫度對適配體固定率的影響
硅烷化反應(yīng)溫度設(shè)定為35 ℃、45 ℃、55 ℃、65 ℃、75 ℃,硅烷化反應(yīng)時間為30min,硅烷化試劑濃度為4×10-3mol·L-1,將1.59×10-5mol·L-1的AP-16適配體在45 ℃恒溫恒濕培養(yǎng)箱中固定化反應(yīng)120min,檢測適配體固定率,結(jié)果見圖4。

圖4 硅烷化反應(yīng)溫度對適配體固定率的影響Fig.4 Effect of silylation reaction temperature on fixed rate of aptamers
由圖4可知,當(dāng)硅烷化反應(yīng)溫度為45 ℃時,適配體固定率最高,達(dá)到66%。當(dāng)硅烷化反應(yīng)溫度低于45 ℃時,隨著溫度的升高,適配體固定率不斷升高,硅烷化反應(yīng)溫度的升高有利于Si-O-Si鍵的形成。但當(dāng)溫度高于55 ℃時,高溫會使環(huán)氧基團失去活性,破壞了硅烷化試劑和適配體的結(jié)合,適配體固定率大幅降低[15]。因此,硅烷化反應(yīng)溫度以45 ℃為宜。
2.3 硅烷化反應(yīng)時間對適配體固定率的影響
玻片在45 ℃下經(jīng)4×10-3mol·L-1硅烷化試劑分別處理15 min、30 min、45 min、60 min、120 min、150min,表面涂抹濃度為1.59×10-5mol·L-1的AP-16適配體,在45℃的恒溫恒濕培養(yǎng)箱中固定化反應(yīng)120min,檢測適配體固定率,結(jié)果見圖5。
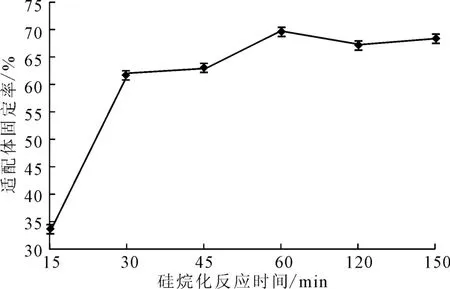
圖5 硅烷化反應(yīng)時間對適配體固定率的影響Fig.5 Effect of silylation reaction time on fixed rate of aptamers
由圖5可知,硅烷化反應(yīng)時間從15min延長到30 min時,適配體固定率明顯提高,之后隨著硅烷化反應(yīng)時間的延長,適配體固定率增幅趨緩,在硅烷化反應(yīng)時間為60min 時,適配體固定率最高,達(dá)67.25%。為提高操作效率,選擇硅烷化反應(yīng)時間為30min。由于玻片上的羥基和GOPS發(fā)生反應(yīng)需要一定的時間,反應(yīng)60min硅烷化基本結(jié)束,反應(yīng)30 min的適配體固定率為62.05 %,與反應(yīng)60 min 適配體固定率為67.8%相差不大。因此,適當(dāng)延長硅烷化反應(yīng)時間能夠提高適配體在玻片上的固定率。
2.4 反應(yīng)時間對適配體固定率的影響
玻片在20 ℃下經(jīng)過濃度為4×10-3mol·L-1的硅烷化試劑處理30 min,然后將濃度為1.06×10-5mol·L-1AP-16 適配體涂抹于玻片上,將其放入45 ℃的恒溫恒濕培養(yǎng)箱中分別固定化反應(yīng)15 min、30min、60 min、120 min、150 min,檢測適配體固定率,結(jié)果見圖6。
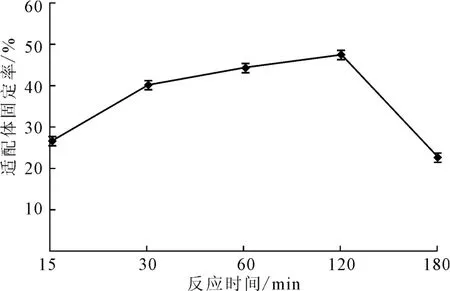
圖6 反應(yīng)時間對適配體固定率的影響Fig.6 Effect of reaction time on fixed rate of aptamers
由圖6可知,適配體和玻片表面的硅烷化試劑的反應(yīng)主要發(fā)生在15~120min之間。隨著反應(yīng)時間的延長,適配體固定率呈上升趨勢,120min后反應(yīng)基本結(jié)束,適配體固定率急速降低。這可能是因為,表面硅烷偶聯(lián)劑分子層長期受熱,使其自聚交聯(lián)或者氧化造成Si-O-Si鍵斷裂[14]。因此,反應(yīng)時間以120 min為宜。
2.5 反應(yīng)溫度對適配體固定率的影響
將濃度為1.06×10-5mol·L-1AP-16適配體涂抹于在20 ℃下經(jīng)過濃度為4×10-3mol·L-1的硅烷化試劑處理30min后的玻片上,分別在25 ℃、35 ℃、45 ℃、55 ℃、65 ℃、75 ℃的恒溫恒濕培養(yǎng)箱中固定化反應(yīng)120min,檢測適配體固定率,結(jié)果見圖7。
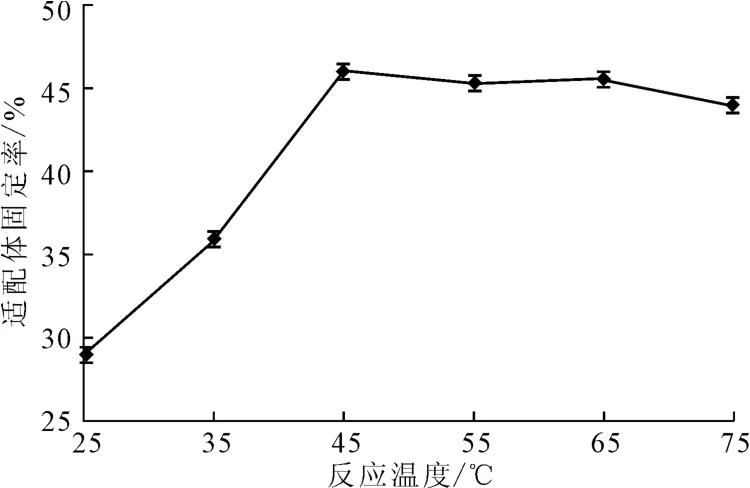
圖7 反應(yīng)溫度對適配體固定率的影響Fig.7 Effect of reaction temperature on fixed rate of aptamers
由圖7可知,隨著反應(yīng)溫度的升高,適配體固定率逐漸上升;當(dāng)反應(yīng)溫度超過45 ℃后,適配體固定率基本保持穩(wěn)定。這可能是因為,反應(yīng)溫度過低,適配體上的末端磷酸根與硅烷化試劑的環(huán)氧基團的開環(huán)反應(yīng)不充分,不利于適配體在玻片上的固定。反應(yīng)溫度超過45 ℃后,反應(yīng)較為穩(wěn)定,即使達(dá)到75 ℃的高溫,適配體固定率變化也不大,說明該固定方法對反應(yīng)溫度較為寬容。綜合考慮,反應(yīng)溫度以45 ℃為宜。
2.6 適配體濃度對適配體固定率的影響
將濃度分別為5.3×10-6mol·L-1、10.6×10-6mol·L-1、15.9×10-6mol·L-1、21.2×10-6mol·L-1、26.5×10-6mol·L-1的適配體涂抹于在20℃下經(jīng)濃度為4×10-3mol·L-1的硅烷化試劑處理30min后的玻片上,在45℃下固定化反應(yīng)120min,檢測適配體固定率,結(jié)果見圖8。
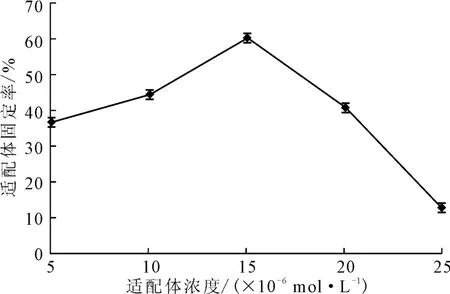
圖8 適配體濃度對適配體固定率的影響Fig.8 Effect of concentration of aptamers on fixed rate of aptamers
由圖8可知,當(dāng)適配體濃度在5.3×10-6~15.9×10-6mol·L-1之間時,隨著適配體濃度的增大,適配體固定率逐漸上升;當(dāng)適配體濃度為15.9×10-6mol·L-1時,適配體固定率最高,達(dá)到60.46%;之后隨著適配體濃度的繼續(xù)增大,適配體固定率逐漸降低。這可能是因為,適配體片段在玻片上的密度過大,重疊度較高,導(dǎo)致反應(yīng)效率降低。因此,適配體濃度以15.9×10-6mol·L-1為宜。
2.7 適配體長度對適配體固定率的影響
將濃度為5.3×10-6mol·L-1的AP-16、AP-21、AP-44、AP-50、AP-76適配體涂抹于在20 ℃下經(jīng)濃度為4×10-3mol·L-1的硅烷化試劑處理30min后的玻片上,在45 ℃下固定化反應(yīng)120 min,檢測適配體固定率,結(jié)果見圖9。

圖9 適配體長度對適配體固定率的影響Fig.9 Effect of aptamers length on fixed rate of aptamers
由圖9可知,適配體固定率隨著堿基數(shù)目的增加即適配體長度的增加而降低。當(dāng)堿基數(shù)目由50增至76時,適配體固定率的降低尤為明顯。一方面,由于適配體長度的增加導(dǎo)致其在玻片上可能卷曲,增加了適配體末端磷酸根離子和玻片上硅烷化的環(huán)氧基團結(jié)合的難度;另一方面,適配體長度的增加,其對應(yīng)的分子量增加,使得懸掛在玻片上的力相應(yīng)增大,因此增加了適配體從玻片上脫落的幾率,導(dǎo)致適配體固定率降低。因此,適配體長度以16個堿基即AP-16為宜。
2.8 對水中Hg2+的吸附
將玻片按照優(yōu)化條件分別固定AP-20和AP-22,其中AP-20為能夠特異性吸附Hg2+的適配體,AP-22作為對照。AP-20 和AP-22 的平均固定率分別為50.61%和49.51%,較AP-16 的最優(yōu)固定率(67.25%)略低,這是由于堿基數(shù)量的增加導(dǎo)致的。將相同的玻片分別均勻地放到20 mL 濃度為1×10-7mol·L-1的HgCl2溶液中,并做空白對照,結(jié)果見圖10。
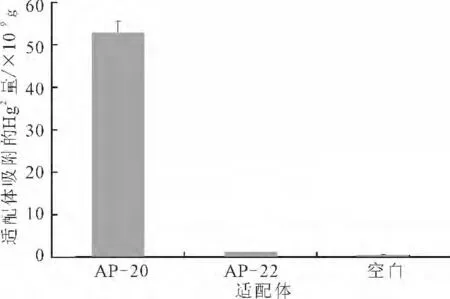
圖10 固定有適配體的玻片對Hg2+的吸附Fig.10 Hg2+Adsorbed by glass chips with immobilized aptamers
空白對照組的數(shù)據(jù)在原子吸收光譜儀允許的誤差范圍內(nèi)[16-17]。由圖10可知,空白玻片和固定了AP-22的玻片都沒有吸附溶液中的Hg2+,而固定有AP-20的玻片對Hg2+具有明顯的吸附作用。經(jīng)計算,固定在玻片上的AP-20吸附Hg2+的量為52.97×10-9g,吸附效率為49.84%。而固定AP-22的玻片,其洗脫溶液的濃度和空白組接近,表明非特異性吸附Hg2+的適配體AP-22不能吸附水溶液中的Hg2+。
3 結(jié)論
以玻片為載體,采用共價偶聯(lián)法對適配體進行了固定,考察了硅烷化試劑濃度、硅烷化溫度和時間、適配體與玻片的反應(yīng)時間和溫度、適配體濃度和長度對適配體固定率的影響,確定了固定適配體于玻片上的最佳條件:濃度為1.59×10-5mol·L-1AP-16適配體與硅烷化玻片在45 ℃下反應(yīng)120min,最佳硅烷化條件:濃度為4×10-3mol·L-1的硅烷化試劑在45 ℃下反應(yīng)30 min。該條件下,適配體的固定率達(dá)62.05%。該法固定化適配體于玻片上具有操作簡單易行的特點。在該最優(yōu)條件下,將適配體AP-20固定在玻片上,初步探索了其對水溶液中Hg2+的吸附效果,固定有適配體的單個玻片吸附Hg2+的效率為49.84%,為利用適配體對水中重金屬的富集與去除提供了一種新的研究思路和參考。
[1]徐敦明,吳敏,鄒遠(yuǎn),等.核酸適體技術(shù)在食品安全分析中的應(yīng)用[J].分析化學(xué),2011,39(6):925-933.
[2]ZHOU Z X,DU Y,DONG S J.DNA-Ag Nanoclusters as fluorescence probe for turn-on aptamer sensor of small molecules[J].Biosens Bioelectronics,2011,28(1):33-37.
[3]LI M,ZHOU X J.Fluorescent aptamer-functionalized graphene oxide biosensor for label-free detection of mercury(Ⅱ)[J].Biosensors and Bioelectronics,2013,41:889-893.
[4]TORIGOE H,MIYAKAWA Y,ONO A,et al.Positive cooperativity of the specific binding between Hg2+ion and T∶T mismatched base pairs in duplex DNA[J].Thermochimica Acta,2012,532:28-35.
[5]VIGNERESSE J L.Evaluation of the chemical reactivity of the fluid phase through hard-soft acid-base concepts in magmatic intrusions with applications to ore generation[J].Chem Geol,2009,263:69-81.
[6]ZAMMATTEO N,JEANMART L,HAMELS S,et al.Comparison between different strategies of covalent attachment of DNA to glass surfaces to build DNA microarrays[J].Anal Chem,2000,280(1):143-150.
[7]HACKLER L Jr,DORMAN G,KELE Z.Development of chemically modified glass surfaces for nucleic acid protein and small molecule microarrays[J].Mol Divers,2003,7(1):25-36.
[8]楊濤,楊婕,張偉,等.聚合物膜與自組裝膜法制備電化學(xué)DNA 傳感器的研究進展[J].分析測試學(xué)報,2007,26(3):431-437.
[9]MISRA A,DWIVEDI P.Immobilization of oligonucleotides on glass surface using an efficient heterobifunctional reagent through maleimide-thiol combination chemistry[J].Anal Biochem,2007,369(2):248-255.
[10]MAHAJAN S,KUMAR P,GUPTA K C.An efficient and versatile approach for the construction of oligonucleotide microarrays[J].Bioorg Med Chem Lett,2006,16(21):5654-5658.
[11]ALDAYE F A,PAMER A L,SLEIMAN H F.Assembling materials with DNA as the guide[J].Science,2008,321(5897):1795-1799.
[12]ONO A,TOGASHI H.Highly selective oligonucleotide-based sensor for mercury(Ⅱ)in aqueou solutions[J].Chem Int Ed,2004,43(33):4300-4302.
[13]DENDANE N,HOANG A,GUILLARD L,et al.Efficient surface patterning of oligonucleotides inside a glass capillary through oxime bond formation[J].Bioconj Chem,2007,18(3):671-676.
[14]MIYAKE Y,TOGASHI H,TASHIRO M,et al.MercuryⅡ-mediated formation of thymine-HgⅡ-base pairs in DNA duplexes[J].Journal of the American Chemical Society,2006,128(7):72-76.
[15]王輝,邸明偉,王清文.熱環(huán)境對偶聯(lián)劑處理聚乙烯木塑復(fù)合材表面性質(zhì)的影響[J].林業(yè)科學(xué),2013,49(12):114-120.
[16]夏新,吳志強,康長安,等.測定汞的原子熒光法和冷原子吸收法比對研究[J].中國測試,2012,38(2):60-62.
[17]區(qū)紅,張燕子,吳慶暉,等.冷原子吸收光譜法結(jié)合熱解-原子吸收光譜法快速測定廢水樣中痕量無機汞和總有機汞[J].分析測試學(xué)報,2004,23(4):68-70.

