穩定表達EGFP-LC3的AR42J細胞系的建立
·論著·
穩定表達EGFP-LC3的AR42J細胞系的建立
吳敏李潔劉曉李欽芳郭曉榕湛先保
【摘要】目的建立穩定表達增強型GFP(EGFP)-LC3的AR42J細胞。方法利用慢病毒過表達載體Lentiviral-EGFP-LC3包裝成慢病毒,感染大鼠胰腺腺泡細胞AR42J。以Lentiviral-EGFP感染作為陰性對照。通過倒置熒光顯微鏡觀察及流式細胞分析儀檢測病毒感染效率,蛋白質印跡法檢測穩定傳代細胞株的LC3蛋白表達。用毒胡蘿卜素處理細胞建立內質網應激模型,采用蛋白質印跡法檢測應激的AR42J細胞的LC3、PERK蛋白表達。結果AR42J細胞的Lentiviral-EGFP-LC3感染效率>85%,并能穩定傳代。Lentiviral-EGFP-LC3感染的AR42J細胞的LC3 mRNA表達量為未感染細胞的(9.14±0.32)倍;LC3蛋白陽性表達并有EGFP-LC3融合蛋白的表達。Lentiviral-EGFP感染的AR42J細胞的LC3 mRNA表達量為未感染細胞的(1.08±0.07)倍,無LC3蛋白表達,僅有GFP表達。與未感染組比較,EGFP-LC3組的LC3 mRNA表達顯著升高,差異有統計學意義(P<0.05),而EGFP組的差異無統計學意義。結論成功構建了穩定表達EGFP-LC3的大鼠胰腺外分泌細胞AR42J,為進一步研究急性胰腺炎與自噬的關系提供了新的細胞模型。
【關鍵詞】慢病毒感染;自噬;細胞系;AR42J細胞
DOI:10.3760/cma.j.issn.1674-1935.2015.02.011
基金項目:國家自然科學基金(81170434,81370571)
收稿日期:(2015-01-03)
Establishment of a stable AR42J cell line expressing EGFP LC3WuMin,LiJie,LiuXiao,LiQinfang,GuoXiaorong,ZhanXianbao.DepartmentofGastroenterology,ChanghaiHospital,SecondMilitaryMedicalUniversity,Shanghai200433,China
Correspondingauthor:ZhanXianbao,Email:zhanxianbao@126.com
Abstract【】ObjectiveTo establish a stable AR42J cell line expressing EGFP LC3. MethodsThe EGFP LC3 overexpressed Lentivirus was constructed and transfected into pancreatic acinar cells (AR42J) of rats. The rats with Lentiviral EGFP transfection were treated as negative control. The transfection efficiency was detected by inverted fluorescence microscope and flow cytometry. The EGFP LC3 protein expression in the stable cell lines were analyzed by Western blot. The cells were treated with thapsigargin to establish endoplasmic reticulum stress model, and the LC3, PERK protein expressions were detected by Western blot. ResultsThe transfection efficiency of Lentiviral EGFP LC3 of AR42J cell was >85%, which could achieve stable passage. The expression of LC3 mRNA of AR42J cells transfected with Lentiviral EGFP LC3 was 9.14±0.32 folds higher than that of negative control, which had no expression of LC3 protein, only EGFP expression. However, compared with non-transfection group, the LC3 mRNA expression in EGFP group was not significantly different. ConclusionsA pancreatic acinar cell line (AR42J) of rat stably expressing EGFP LC3 protein is successfully constructed. And it may provide a new model for further research of the relationship between acute pancreatitis and autophagy.
【Key words】Lentivirus infections;Autophagy;Cell line;AR42J cell
自噬是細胞內過多或異常的細胞器及其周圍的蛋白質和部分細胞質被雙層膜所包裹形成自噬體,自噬體與溶酶體融合并且降解其所包裹的內容物,隨后降解產物(如氨基酸)反向循環至細胞質的過程。通常細胞內自噬維持在很低的水平,在應激條件下可被誘導,它在細胞內具有各種各樣的功能[1-3]。LC3是酵母自噬相關基因ATG8的類似物,當哺乳動物細胞發生自噬時細胞質內LC3由可溶形式LC3(LC3-Ⅰ)轉變為脂溶形式LC3(LC3-Ⅱ),LC3-Ⅱ能夠與新形成的自噬體膜結合。檢測細胞中LC3Ⅱ含量的變化可以判斷自噬的變化。因此,本研究利用過表達LC3的慢病毒載體Lentiviral-EGFP-LC3轉染大鼠胰腺外分泌細胞AR42J,并通過模擬內質網應激來誘導自噬的發生,以明確在AR42J細胞進行自噬研究的可能性,為進一步研究急性胰腺炎與自噬的關系提供穩定的細胞模型。

作者單位:200433上海,第二軍醫大學長海醫院消化內科
通信作者:湛先保,Email:zhanxianbao @126.com
材料與方法
一、材料、試劑和儀器
Lentiviral-EGFP-LC3慢病毒載體及陰性對照慢病毒載體Lentiviral-EGFP由第二軍醫大學微生物教研室提供。AR42J細胞由本實驗室保存。胎牛血清購自美國Gbico公司、1640培養基購自美國Thermo公司;小鼠抗大鼠β-actin單抗購自杭州華安生物技術有限公司、小鼠抗大鼠GFP單抗購自美國Abcam公司、兔抗大鼠LC3單抗購自美國CST公司、兔抗大鼠PERK多抗購自美國Santa-Cruz公司;DMSO、毒胡蘿卜素購自美國Sigma公司;ECL化學發光顯影液購自美國Thermo公司;倒置熒光顯微鏡購自日本OLYMPUS公司;流式細胞分析儀購自德國Miltenyi公司;ABI7500型熒光定量PCR儀購自美國ABI公司。
二、方法
1.慢病毒包裝及滴度檢測:人源胚胎腎細胞(HEK293T細胞)由本實驗室提供,常規培養傳代。取對數生長期細胞,以2.5×106個細胞密度接種于10 cm培養瓶,置37℃、5% CO2培養箱過夜。感染前2至3 h更換新鮮培養基,將Lentiviral-EGFP-LC3、包膜質粒pCMV-VSV -G、包裝質粒pCMV-Dr8.2dvpr(均為美國SIGMA公司產品)與HEK293T細胞共孵育24 h,按說明書操作。以Lentiviral-EGFP感染作為陰性對照,慢病毒包裝后置-80℃冰箱保存[4]。兩種病毒分別命名為EGFP-LC3病毒及EGFP病毒,并運用稀釋梯度法檢測病毒滴度。
2.慢病毒感染:AR42J細胞接種于含10%胎牛血清的1640培養基中,置37℃、5%CO2培養箱中培養。取對數生長期細胞,制備成1×105個/ml細胞懸液。在24孔板中每孔加入500 μl細胞懸液,即每孔5×104個細胞,培養過夜。AR42J細胞分為未感染組、EGFP病毒感染組(EGFP組)、EGFP-LC3病毒感染組(EGFP-LC3組)。
分別取兩種病毒液,加入培養液混懸,病毒滴度為1×108TU/ml,再加入終濃度為7 μg/ml的聚凝胺(polybrene),混勻后加入到相應組的AR42J細胞中,常規培養24 h,隨后更換培養液。48 h后在倒置熒光顯微鏡下任意選取10個視野,分別于10倍鏡、20倍鏡下觀察GFP表達效率,同時取50 μl細胞懸液上流式細胞分析儀檢測感染效率。
3.細胞GFP、LC3蛋白表達檢測:收集未轉染組、EGFP組、EGFP-LC3組細胞,應用RIPA裂解液勻漿細胞,提取蛋白,定量后取50 μg常規行蛋白質印跡法檢測細胞GFP、LC3蛋白的表達,以β-actin為內參。小鼠抗大鼠GFP單抗稀釋濃度為1∶1 000,兔抗大鼠LC3單抗稀釋濃度為1∶1 000,內參小鼠抗大鼠β-actin單抗稀釋濃度為1∶1 000;HRP標記二抗稀釋濃度1∶5 000。最后ECL發光,X線膠片曝光、顯影、定影。
4.細胞LC3 mRNA表達檢測:收集未感染組、EGFP組、EGFP-LC3組細胞,用Trizol提取細胞總RNA,應用逆轉錄試劑盒將RNA逆轉錄成cDNA。再按PCR試劑盒擴增LC3 mRNA。LC3引物上游為5′-CGGAGCTTTGAACAAAGAGTGG-3′,下游為5′-CTCTCTCACTCTCGTACAC-3′,擴增產物177 bp,由上海Invitrogen公司合成。PCR反應條件:95℃ 30 s,95℃ 5 s、60℃ 34 s,40個循環。通過PCR儀自帶分析軟件獲取Ct值,應用公式2-△△Ct計算LC3 mRNA相對表達量,以未感染組細胞的表達量為1。
5.內質網應激模型建立及評估:將穩定表達EGFP-LC3的AR42J細胞以每孔5×105個細胞密度接種于6孔板中,培養過夜后分為未處理組及毒胡蘿卜素(TG)處理組,TG處理組加入1 μmol/L的毒胡蘿卜素處理12 h。收集兩組細胞,提取細胞蛋白,取50 μg蛋白常規行蛋白質印跡法檢測LC3、內質網應激相關基因PERK蛋白的表達,以β-actin為內參。兔抗鼠PERK多抗稀釋濃度為1∶400,其他操作同上。應用圖像分析儀掃描,以目的條帶與內參條帶的灰度值比表示蛋白的相對表達量。
三、統計學處理
結 果
一、AR42J細胞的病毒感染率及其傳代的穩定性
感染48 h后熒光顯微鏡下觀察,兩組病毒感染的AR42J細胞絕大多數胞質內可見熒光蛋白GFP(圖1),流式細胞分析儀檢測到兩組病毒感染細胞的感染效率均在85%以上(圖2)。陽性表達的細胞經10次傳代培養,未見GFP熒光衰減,表明病毒感染的AR42J細胞能穩定地傳代。

圖1 Lentiviral-EGFP-LC3感染的明視野(1A)及暗視野熒光圖(熒光顯微鏡 ×20)

FSC是前向角散射,SSC是側向角散射,A為細胞熒光的總和 圖2 Lentiviral-EGFP-LC3感染(2A、2B)及Lentiviral-EGFP 感染(2C、2D)的 AR42J細胞EGFP表達 (流式細胞分析儀)
二、AR42J細胞的LC3 mRNA表達
未感染組的LC3 mRNA的表達量為1,EGFP組、EGFP-LC3組細胞的LC3 mRNA表達量分別為未感染組細胞的 (1.08±0.07)、(9.14±0.32)倍。EGFP-LC3組的表達量顯著高于未感染組,兩組間差異有統計學意義(F=7.293,P<0.01),而EGFP組與未感染組間的差異無統計學意義。
三、穩定表達細胞系的GFP、LC3蛋白表達
未感染組無GFP、LC3蛋白表達。EGFP組、EGFP-LC3組細胞有GFP蛋白的表達。EGFP-LC3組細胞還有EGFP-LC3融合蛋白表達(圖3)。
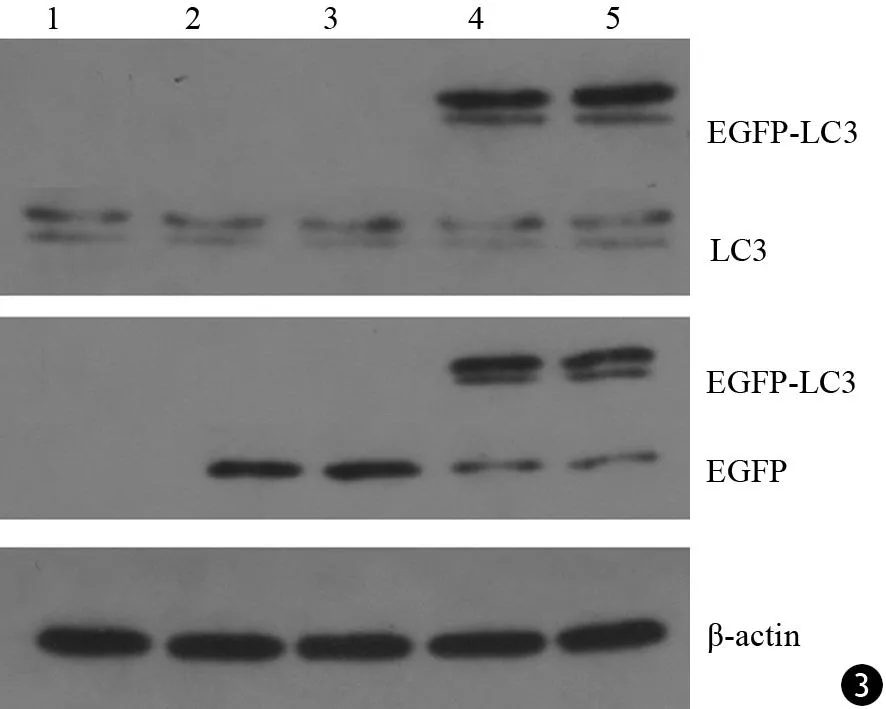
圖3 未感染組(1)、EGFP組(2、3)、EGFP-LC3組(4、5)AR42J細胞的GFP、LC3、GFP-LC3蛋白的表達
四、內質網應激模型的AR42J細胞LC3、PERK蛋白的變化
未處理組與TG處理組AR42J細胞均可檢測出LC3、PERK的表達(圖4)。兩組LC3及PERK蛋白相對含量LC3-Ⅰ為0.273±0.01、0.176±0.03,LC3-Ⅱ為0.156±0.03、0.546±0.04,PERK為0.284±0.02、0.648±0.06。表明TG處理組細胞中LC3-I向LC3-Ⅱ轉變,PERK蛋白的表達較未處理組顯著增加,差異有統計學意義(F值分別為56.14、386.96、150.84,P<0.01,圖4)。
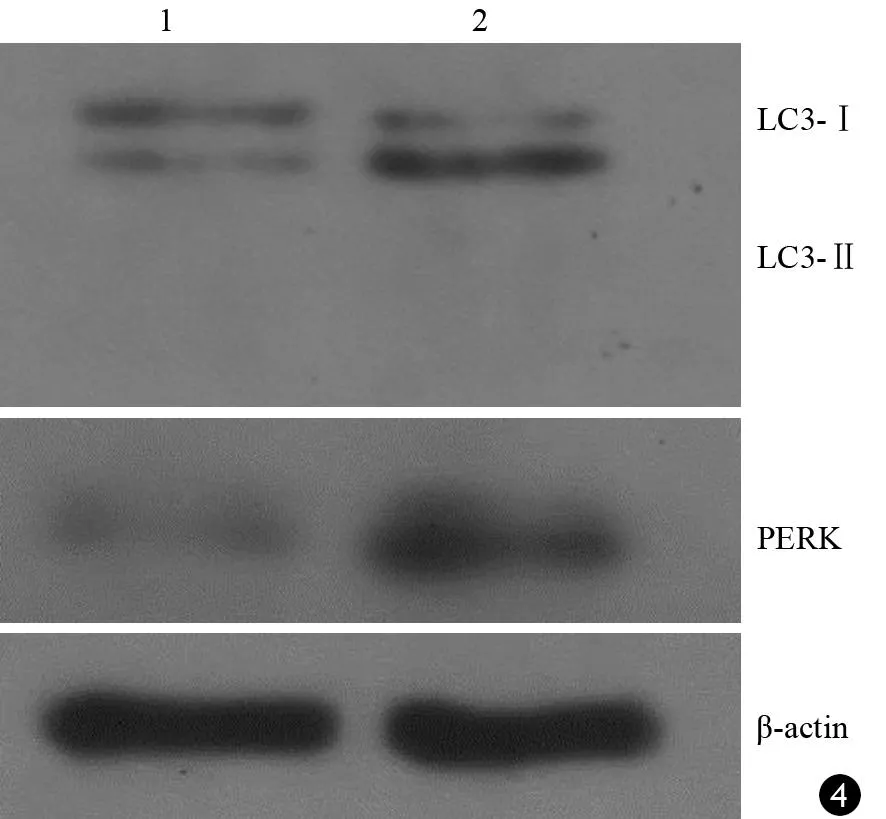
圖4未處理組(1)、TG處理組(2)的Lentivard-EGFP-LC3感染的AR42J細胞的LC3Ⅰ、LC3Ⅱ、PERK蛋白的表達
討 論
自噬參與細胞的生理活動,例如細胞的生長和分化。自噬還可能參與調節一些人類疾病的過程,例如癌癥、肌肉疾病和神經退行性疾病。它還可以作為一種細胞防御機制防止某些病原菌和病毒的感染[5-6]。自噬是一個受到緊密調控的過程,它在細胞生長、發育和動態平衡過程中起著重要的作用。因此構建適合的細胞模型對于后續的實驗研究尤為重要。
自噬體的形成由一系列自噬相關基因(autophagy-related genes,ATG)的產物組成的復合物參與協調[7-8]。ATG編碼的蛋白質至少組成4種復合物,它們各自控制自噬體形成過程中單獨的環節。例如,ULK1/Atg1參與自噬體的成核,Beclin1/Atg6-Vps34和Atg5-Atg12-Atg16復合物參與隔離膜的形成[9-10]。
大鼠胰腺外分泌細胞對于研究急性胰腺炎的分子機制是一種重要的細胞模型。既往一些研究證實,利用瞬時轉染技術可以使外源性基因的表達在24~48 h內達到高峰,然而隨著時間的推移,由于細胞裂解等因素的影響,可能會引起外源性基因的缺失,對實驗的準確性產生影響。同時穩定轉染后細胞可持續傳代,既提高了實驗的準確性,又降低了多次轉染的試驗成本。因此,構建穩定表達EGFP-LC3融合蛋白的AR42J細胞可以保證細胞的持續性以及后續實驗的準確性。
本實驗采用慢病毒過表達載體包裝慢病毒以感染AR42J細胞,通過倒置熒光顯微鏡觀察以及流式細胞分析儀對穩定傳代的細胞進行檢測,綠色熒光蛋白的表達在85%以上。再利用蛋白印跡法檢測細胞中EGFP-LC3融合蛋白的表達,結果表明細胞中成功表達EGFP-LC3融合蛋白。同時建立TG誘導的內質網應激模型,蛋白印跡法檢測顯示LC3-Ⅰ向LC3-Ⅱ轉變明顯。以上表明在AR42J細胞系中可通過TG誘導內質網應激模型的建立,同時表明在AR42J細胞中,內質網應激后可引起自噬的變化。此外,在小鼠RAW264.7細胞系、成神經瘤細胞系等均觀察到一致的結果。此次建立穩定表達EGFP-LC3的AR42J細胞系,為下一步研究急性胰腺炎與自噬關系提供了重要的研究模型。
參考文獻
[1]Hailey DW, Rambold AS, Satpute-Krishnan P, et al. Mitochondriasupply membranes forautophagosome biogenesis during starvation[J]. Cell, 2010, 141(4): 656-667.
[2]Glick D, Barth S, Macleod KF. Autophagy: cellular and molecular mechanisms[J]. J Pathol, 2010, 221(1): 3-12.
[3]Mizushima N. Autophagy: process and function[J]. Genes Dev, 2007, 21(22): 2861-2873.
[4]劉勇,李園,陳珂玲,等.穩定沉默GRP78基因的胰腺腺泡細胞株AR42J的建立[J].四川大學學報·醫學版,2012,43(5):645-650.
[5]Cuervo AM, Dice JF. A receptor for the selective uptake and degradationof proteins by lysosomes[J].Science, 1996, 273(5274): 501-503.
[6]Wang K, Klionsky DJ. Mitochondria removal by autophagy[J].Autophagy, 2011, 7(3): 297-300.
[7]Nishida Y, Arakawa S, Fujitani K, et al. Discovery ofAtg5/Atg7-independent alternative macroautophagy[J]. Nature, 2009, 461(7264): 654-658.
[8]Youle RJ, Narendra DP. Mechanisms of mitophagy[J].Nat Rev Mol Cell Biol, 2011, 12(1): 9-14.
[9]Glick D, Barth S, Macleod KF. Autophagy: cellular and molecular mechanisms[J]. J Pathol, 2010, 221(1): 3-12.
[10]Mizushima N, Yoshimori T, Ohsumi Y. The role of Atg proteins inautophagosome formation[J].Annu Rev Cell Dev Biol, 2011, 27: 107-132.
(本文編輯:呂芳萍)
·讀者·作者·編者·
關于非法網站冒用我刊名義進行征稿的特別提醒
近期我們發現一些網站冒用“中華胰腺病雜志”名義征稿,并承諾“職稱論文權威快速代發”。為此,我刊特別提醒各位作者,向《中華胰腺病雜志》投稿,一定要登錄中華醫學會首頁(http://www.cma.org.cn),進入“業務中心”,在“雜志社遠程稿件管理系統”中投稿,或直接發送到本刊郵箱(Email: yixianbingxue@163.com)進行投稿,以免上當。本刊聯系電話:021-31161362。

