通心絡聯合阿托伐他汀、阿司匹林對家兔動脈粥樣硬化早期血管外膜滋養血管新生的干預作用
網絡出版時間:2014-12-4 13:45網絡出版地址:http://www.cnki.net/kcms/doi/10.3969/j.issn.1001-1978.2015.01.016.html
通心絡聯合阿托伐他汀、阿司匹林對家兔動脈粥樣硬化早期血管外膜滋養血管新生的干預作用
郎艷松1,2, 秘紅英1,2,劉紅利2,袁國強3,4
(1. 河北醫科大學中西醫結合教研室,河北 石家莊050017;2.河北以嶺醫藥研究院,國家中醫藥管理局重點研究室(心腦血管絡病),河北 石家莊050035;3.河北醫科大學附屬以嶺醫院心血管科(國家中醫藥管理局中醫絡病學重點學科),河北 石家莊050091;4. 河北省絡病重點實驗室,河北 石家莊050035)
中國圖書分類號:R-332;R322.121;R364.3;R543.5;R972.6
摘要:目的觀察通心絡聯合阿托伐他汀、阿司匹林對家兔動脈粥樣硬化早期頸動脈外膜滋養血管新生的影響。方法72只健康♀♂各半新西蘭白兔隨機分為對照組、模型組、通心絡(TXL)組、阿托伐他汀(ATO)組、阿司匹林(ASP)組、金三角(ATS)`([1])組,各12只。對照組給予普通飼料、模型組及各用藥組家兔均實施單側頸動脈硅膠管包裹術復合高脂飼料喂養,TXL組給予通心絡超微粉混懸液0.3 g·kg`(-1)·d`(-1)灌胃,ATO組給予阿托伐他汀2.5 mg·kg`(-1)·d`(-1)灌胃,ASP組給予阿司匹林12 mg·kg`(-1)·d`(-1)灌胃,ATS組給予通心絡超微粉混懸液0.3 g·kg`(-1)·d`(-1)加阿托伐他汀2.5 mg·kg`(-1)·d`(-1)加阿司匹林12 mg·kg`(-1)·d`(-1)灌胃,連續給藥4周后取材,HE染色觀察頸動脈內中膜的變化;免疫組化法檢測頸動脈外膜CD34表達情況;微球檢測頸動脈微血管血流量的變化;RT-PCR和Western blot檢測頸動脈組織中VEGF、VEGFR-2基因和蛋白表達情況。結果與對照組比較,模型組VEGF、VEGFR-2基因和蛋白表達以及微血管血流量明顯增強(P<0.01)。與模型組比較,各用藥組VEGF、VEGFR-2基因和蛋白表達以及微血管血流量明顯減弱(P<0.01,P<0.05)。與其他用藥組比較,ATS組VEGF、VEGFR-2基因和蛋白表達以及微血管血流量明顯減弱(P<0.01,P<0.05)。與ASP組比較,TXL組、ATO組VEGFR-2蛋白表達均明顯降低 (P<0.05),ATO組微血管血流量減少明顯(P<0.05)。TXL組與ATO組兩組間比較差異無顯著性(P>0.05)。VEGF、VEGFR-2基因和VEGF蛋白表達組間比較無統計學意義(P>0.05)。各用藥組頸動脈外膜CD34表達減少。結論“ATS”方案有助于減少動脈粥樣硬化早期頸動脈VEGF、VEGFR-2表達,抑制血管外膜滋養血管新生,減少促炎物質進入血管中膜、內膜,延緩動脈粥樣硬化進程。
關鍵詞:動脈粥樣硬化;滋養血管;血管內皮生長因子;彩色微球;通心絡超微粉;阿司匹林;阿托伐他汀
doi:10.3969/j.issn.1001-1978.2015.01.016
文章編號:
文獻標志碼:A1001-1978(2015)01-0071-06
收稿日期:2014-09-28,修回日期:2014-11-15
基金項目:國家重點基礎研究發展計劃(973計劃)資助項目(No 2012CB518606)
作者簡介:郎艷松(1988-),女,碩士,E-mail:769424369@qq.com ;
通訊作者袁國強(1977-),男,博士,副主任醫師,研究方向:中西醫結合臨床心血管病,,E-mail:yuanguoqiang7508@163.com
Abstract:AimTo observe the effect of a treatment proposal named“Golden Triangle”(Atorvastatin, Tongxinluo,and Aspirin) on the vasa vasorum angiogenesis of early atherosclerosis lesions in rabbits carotid artery.MethodSeventy-two healthy New Zealand rabbits with half males and half females were divided into 6 groups randomly(n=12):control group,model group, Tongxinluo group(TXL), atorvastatin group(ATO), aspirin group(ASP),golden triangle group(ATS).The control group was fed with common feedstuff, and all the other groups′ right carotid arteries were equipped with the silicone tube,and were then fed with fatty feedstuff.The Tongxinluo group, the Atorvastatin group and the Aspirin group were given suspension of Tongxinluo supermicro powder(0.3 g·kg`(-1)·d`(-1)),Atorvastatin(2.5 mg·kg`(-1)·d`(-1))and Aspirin (12 mg·kg`(-1)·d`(-1)),the golden triangle group were given suspension of Tongxinluo supermicropowder(0.3g·kg`(-1)·d`(-1)),atorvastatin(2.5 mg·kg`(-1)·d`(-1))and Aspirin (12 mg·kg`(-1)·d`(-1)). All the groups were fed with medicine for 4 weeks.Tissue slice of carotid artery was stained with HE and observed under light microscope.The change of blood liquid was detected by biochemical assay.Immunohistochemical staining was used to detect the protein expression of CD34 around the carotid artery adventitia.Color microsphere method was used to detect the blood flow volume change of the cartoid artery microvascular. VEFG,VEGFR-2 gene and protein expression in the cartoid artery were detected by Real-time PCR and Western Blot.ResultCompared with the control group,the content of VEGF,VEGFR-2 gene and protein expression and the microvascular blood flow volume of cartoid artery microvascular in the model were significantly increased(P<0.01).But those in each drug group were lighter than those in the model group(P<0.01,P<0.05).In the ATS group,the content of VEGF,VEGFR-2 gene and protein expression and the microvascular blood flow volume of cartoid artery microvascular were lower than those in the TXL,ATO and ASP group(P<0.01,P<0.05).Compared with the ASP group,the content of VEGFR-2 protein expression was significantly decreased(P<0.01)in the TXL and ATO group.VEGF,VEGFR-2 gene and protein expression in different subgroups showed no significant difference(P>0.05).The content of CD34 was decreased in TongxinLuo group,atorvastatin group,aspirin group and ATS group.ConclusionThe ATS project can reduce the expression of VEGF,VEGFR-2, inhibit the vasa vasorum angiogenesis and decrease proinflammatory substances in the tunica media and intima of vascular wall. It plays an important role in intervening in the process of AS.
血管外膜在動脈粥樣硬化中的作用越來越受到重視[2],血管外膜上有外彈力板、神經的終末分支、滋養血管以及結締組織等,但近來研究發現在高膽固醇血癥豬模型上,新生滋養血管出現及密度增加在動脈粥樣硬化早期就已出現[3],滋養血管新生程度與動脈粥樣硬化嚴重程度相關,此外新生的滋養血管能夠為促炎物質及促動脈粥樣硬化血液成分進入血管壁提供通路[4],易損斑塊內的新生血管96.5%來源于血管外膜[5]。以往研究顯示通心絡[6]和他汀類藥物[7]主要通過保護血管內皮、抗炎、抗氧化和調脂等作用發揮抗動脈粥樣硬化的作用,阿司匹林[8]則主要通過抑制血小板活化、抗炎、抗氧化等機制延緩動脈粥樣硬化的進程。此外通心絡[9]、阿托伐他汀[10]、阿司匹林[11]均能夠減少斑塊內血管新生,起到穩定斑塊的作用。根據polypill策略[12],即在固定藥物劑量的基礎上聯合用藥,有研究者提出他汀類藥物聯合應用阿司匹林及中藥通心絡膠囊,形成有效防治缺血性心腦血管疾病的“金三角”(ATS)優選方案,在減少危險因素的同時未導致不良反應的風險提高,從而減少心腦血管的發病風險。因此,我們試圖通過實驗驗證通心絡聯合阿托伐他汀、阿司匹林對動脈粥樣硬化早期滋養血管新生的干預作用。
1材料與方法
1.1材料與設備3k15型高速冷凍離心機(Sigma);T10型勻漿機(德國IKA公司);JB-2A型恒溫磁力攪拌器(上海雷磁新涇儀器有限公司);756型紫外分光光度計(美國Thermo Fisher公司);ABI 7300 Real-Time PCR System(美國ABI公司);通心絡超微粉(石家莊以嶺藥業股份有限公司,批號:20120924);阿托伐他汀片(輝瑞制藥有限公司,批號:1237179); 阿司匹林(石藥集團歐意藥業有限公司,批號:018130311);羧甲基纖維素鈉( 天津永大化學試劑開發中心,批號:20130418);DYE-TRAK彩色微球(美國Triton Technology公司,批號:15TB0911);VEGF鼠抗兔單克隆抗體(英國Abcam 公司,批號:ab1316);VEGFR-2 山羊多克隆抗體(美國Santa Cruz公司,批號:sc-48161)。
1.2方法
1.2.1分組與造模健康新西蘭白兔(北京富豪實驗動物養殖中心,批號:SCXR[京]2010-0010),單籠飼養于河北省絡病重點實驗室,體質量(1.8±0.2) kg,適應性飼養1周后,將72只健康清潔級新西蘭白兔隨機分為對照組、模型組、通心絡(TXL)組、阿托伐他汀(ATO)組、阿司匹林(ASP)組、金三角(ATS)組,每組12只。對照組給予普通飼料,其余各組硅膠管包裹后給予高脂飼料(膽 固 醇1%,蛋黃粉7.5%,豬油5%,基礎飼料86.5%,由河北醫科大學實驗動物中心加工定制)喂養[13]。自耳緣靜脈注射3%戊巴比妥(1 mL·kg-1),將新西蘭白兔仰臥位固定于手術臺上,脫毛后常規消毒,鋪洞巾,沿其頸部正中線剪開皮膚,逐層鈍性分離,右側頸動脈鞘暴露后,仔細游離出右頸動脈(RCA)約2.5 cm。用準備好的的硅膠管縱向切開后包裹于RCA外,滴加青霉素預防感染。術后,縫合傷口,自主蘇醒。術后2次/日,連續3 d局部消毒,以預防感染。對照組家兔不作任何處理。 每天12h間隔照明,溫度20℃~25℃,濕度50%~70%,自由飲水和攝食。實驗室每日按時通風和消毒。
1.2.2標本采集和處理喂養4周后,標本采集前12 h禁食禁水,3%戊巴比妥鈉耳緣靜脈注射麻醉(1 mL·kg-1),腹主動脈取血。嚴格無菌操作,剃毛后消毒,沿頸部正中線剪開,快速分離并取下包管側頸動脈,生理鹽水洗凈,一部分4%多聚甲醛保存,另一部分液氮凍存備用。剩余組織制作石蠟切片,蘇木精-伊紅(HE)染色。
1.2.3病理標本光鏡觀察將已固定標本脫水、石蠟包埋切片(厚度約4 μm),HE染色,光鏡觀察。
1.2.4免疫組化法檢測血管外膜CD34表達取固定標本,脫水、石蠟包埋,切片,嚴格按照說明書行CD34免疫組織化學染色。
1.2.5彩色微球測量管壁微血管血流量
1.2.5.1測量原理自家兔左心室注入直徑約為15 μm的彩色微球,隨后微球隨體循環至全身并最終嵌頓于微血管中,將待測標本中的彩色微球回收后,再用有機溶劑將彩色微球洗脫干凈,利用紫外分光光度計測得吸光度值,用以計算待測標本的微循環血流量。
1.2.5.2測量方法用3%戊巴比妥鈉(30 mg·kg-1)耳緣靜脈麻醉后,于右側腹股溝處脫毛后常規消毒,剝離股動脈并插管(管內充滿50 kU·L-1的肝素生理鹽水,并與1 mL注射器相連)。胸部脫毛消毒,沿正中線剪開直至暴露心臟,10 s內將微球(500 μL含有1.2×106個黃色微球,最大吸光度波長448 nm)注射于左心室,在注射前5 s于股動脈插管持續采血1 min并抗凝。處死動物后迅速取出包管處頸動脈并放入聚丙烯離心管中,稱量血液樣本及組織樣本重量。最后利用Triton Technology公司的Excel宏文件(Triton1 Plus Control)計算各組標本中管壁微血管血流量值(單位: μL/min·g),實驗具體操作方法嚴格按照說明書進行。
1.2.6VAGF/VEGFR-2的RT-PCR檢測①組織總RNA提取及定量:取50 mg組織用TRIzol試劑(Gibco)提取組織總RNA。751紫外分光光度計測A260和A280值;以檢測RNA純度并定量。②RNA完整性鑒定,取總RNA液3 μL,加上樣緩沖液1 μL,1%瓊脂糖凝膠電泳,紫外燈觀察28S和18S條帶的完整性。③逆轉錄-聚合酶鏈反應,逆轉錄cDNA的合成反應:取總RNA 6 μg,5×R.T.buffer 4 μL,dNTPs(10 mmol·L-1)2 μL,Random primer 1 μL,RNasin(5×107U·L-1)0.4 μL,AMV-RT(1×107U·L-1)1 μL,DEPC-H20 3.6 μL,充分混勻后,42 ℃反轉錄 40 min,95℃ 5 min滅活反轉錄酶;引物合成:VEGF(73 bp):上游5′-GCGTTCTCAGTGGTGTTTGA-3′,下游5′-TGGCTTGTTCCTCCTTCTTG-3′;VEGFR-2(141 bp):上游5′-GGTTCAAAGACAACGAGATGC-3′,下游5′-TCACACAGCCAAGGACACTG-3′。GAPDH(92 bp):上游5′-AGAGATTGTGCGGGATGTC-3′,下游5′-CCAGTGAGGAAGATGCTGCT-3′;PCR反應體系(25 μL):R.T.product 5.0 μL,10×PCR buffer 2.5 μL,MgCl22.5 μL,primer each 1 μL,Taq DNA polymerase1 μL,DDW 13 μL;反應條件:94℃ 3 min,94℃ 45 s,53℃ 45 s,72℃ 45 s,30個循環;最后72℃延伸5 min。④RT-PCR產物半定量分析:取10 μL產物2%瓊脂糖電泳(85 mA,125 V)50 min,用凝膠圖像分析管理系統(珠海黑馬有限公司)進行拍照和半定量分析,用任意單位(AU)表示凝膠譜帶面積×熒光強度值,VEGFR/GAPDH的AU比值代表VEGFmRNA相對表達水平,VEGFR-2/GAPDH的AU比值代表VEGFR-2mRNA相對表達水平。
1.2.7VAGF/VEGFR-2的Western blot檢測取頸動脈組織約100 mg,加入1 mL細胞裂解液,待充分裂解后進行定量,取蛋白樣品進行SDS聚丙烯酰胺凝膠電泳完畢后對凝膠進行半干轉膜。轉膜完畢,取出PVDF膜,置于封閉液中并室溫封閉2 h。將封閉后的PVDF膜置入稀釋后的一抗溶液中,4 ℃緩慢搖動過夜。室溫洗膜后,將PVDF膜置入稀釋的辣根過氧化物酶標記的二抗溶液中,室溫反應2 h。抗體結合區帶用化學發光法檢測。以GAPDH作為內參照,以目的基因吸光度值/GAPDH吸光度值的比值表示檢測樣品中目的蛋白的相對含量進行數據統計分析。
2.1各組兔頸動脈光鏡觀察對照組:內皮細胞與內彈力板貼合緊密,內皮細胞連續結構完整。平滑肌細胞排列整齊;模型組:內膜層明顯增生,內皮細胞不連續,內可見少量泡沫狀巨噬細胞形成;各用藥組內膜層部分增厚,但內膜損傷程度減輕,以阿托伐他汀組、通心絡組及ATS組改善更為明顯。見Fig 1。
2.2頸動脈壁CD34免疫組織化學染色CD34在頸動脈外膜微血管內皮細胞陽性表達呈現棕褐色,凡是呈現棕色的并與鄰近組織有明顯界限,可視為一個微血管;與空白組比較,模型組CD34在血管外膜新生滋養血管處表達增多;與模型組比較,各用藥組外膜新生滋養血管數量減少(Fig 2中箭頭所示)。2.3動脈微血管血流量的變化與空白組比較,模型組頸動脈微血管血流量增多,差異有統計學意義(P<0.01)。與模型組比較,各用藥組頸動脈微血流量減少(P<0.01)。ATS與其余各用藥組比較微血管血流量減少明顯(P<0.01)。ASP組微血管血流量改變與ATO組比較差異有統計學意義(P<0.05),剩余兩組之間比較差異無統計學意義(P>0.05)。見Tab 1。
Tab 1Comparison of microvascular blood

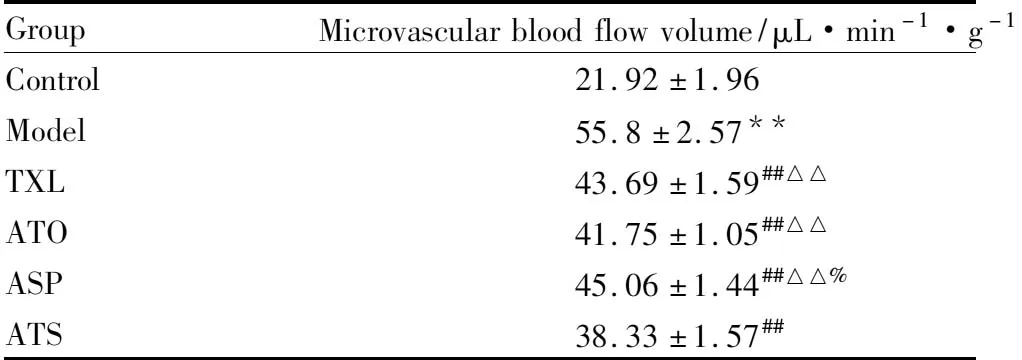
GroupMicrovascularbloodflowvolume/μL·min-1·g-1Control21.92±1.96Model55.8±2.57**TXL43.69±1.59##△△ATO41.75±1.05##△△ASP45.06±1.44##△△%ATS38.33±1.57##
**P<0.01vscontrol group:##P<0.01vsmodel group:△△P<0.01vsATS group:%P<0.05vsATO
2.4頸動脈外膜VEGF mRNA、VEGFR-2 mRNA的變化與正常組比較,模型組VEGF mRNA、VEGFR-2 mRNA 表達明顯升高(P<0.01)。與模型組比較,TXL、ATO、ASP、ATS組VEGF mRNA、VEGFR-2 mRNA 表達均明顯降低 (P<0.01,P<0.05)。ATS組VEGF mRNA、VEGFR-2 mRNA 表達均低于ASP、TXL及ATO組(P<0.01),兩組間比較差異無顯著性(P>0.05)。見Tab 2。
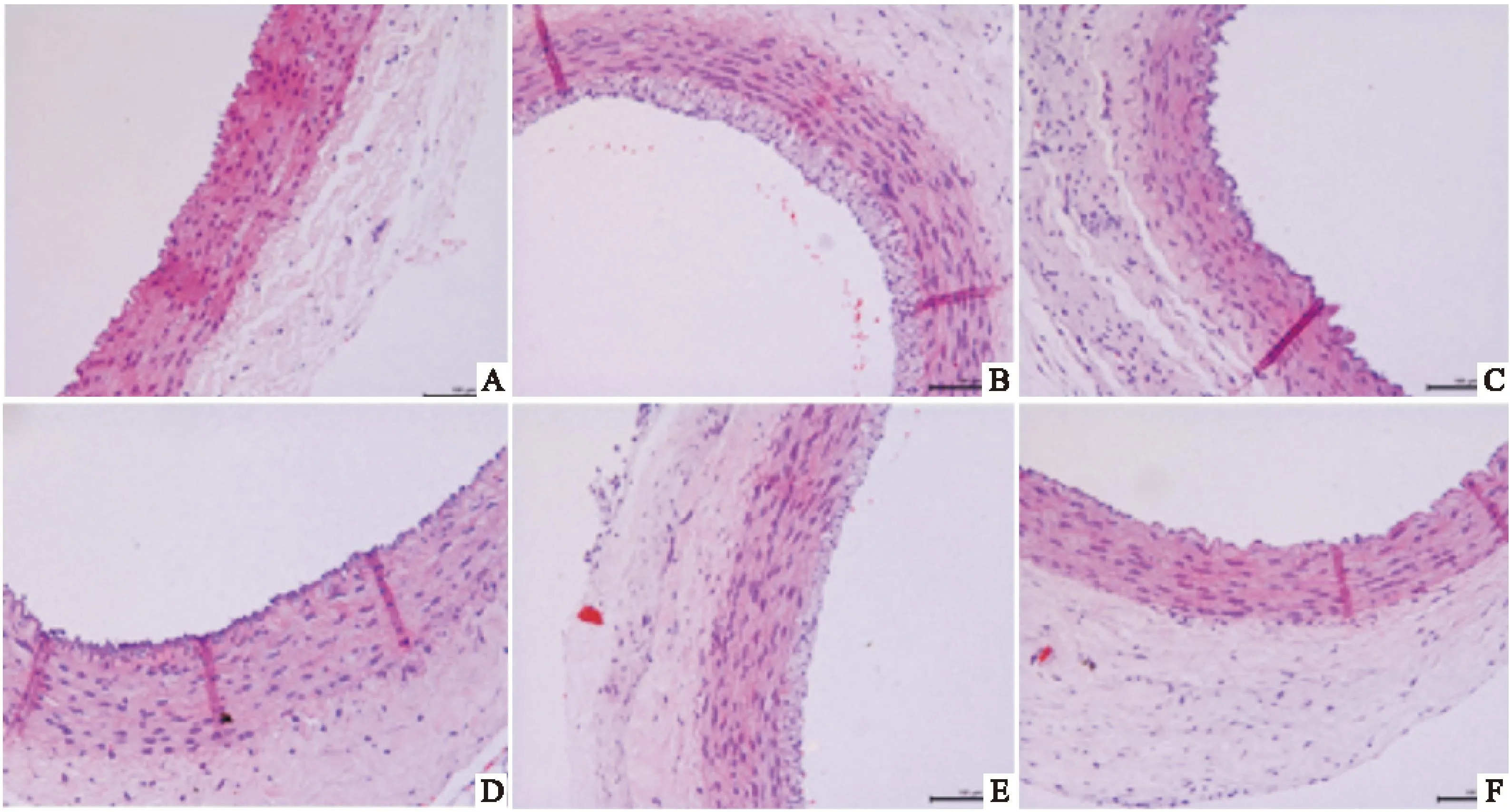
Fig 1 Appearance of carotid artery morphology in all groups(HE staining×400)
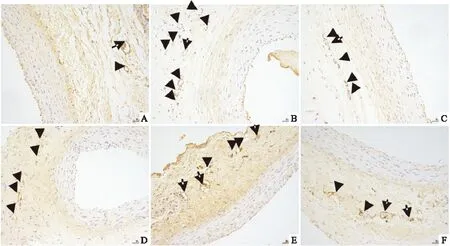
Fig 2 Appearance of CD34 in carotid artery adventitia in all groups(IHC×200)


GroupVEGFVEGFR-2Control1.05±0.161.01±0.18Model4.12±0.51**3.95±0.14**TXL2.17±0.26#△△2.06±0.06#△△ATO1.92±0.33#△△2.73±0.53#△△ASP2.07±0.5#△△2.46±0.51##△△ATS1.21±0.19#1.1±0.12#
**P<0.01vscontrol group;#P<0.05,##P<0.01vsmodel group;△△P<0.01vsATS group
(P<0.01)。與模型組比較,TXL、ATO、ASP、ATS組 VEGF 蛋白表達均明顯降低 (P<0.01,P<0.05);ATS組 VEGF 蛋白表達均低于ASP、TXL及ATO組(P<0.01,P<0.05),兩組間比較差異無顯著性(P>0.05)。
2.5各組頸動脈外膜VEGF、VEGFR-2蛋白水平與正常組比較,模型組VEGF蛋白表達明顯升高與正常組比較,模型組VEGFR-2蛋白表達明顯升高(P<0.01)。與模型組比較,TXL、ATO、ASP、ATS組 VEGFR-2蛋白表達均明顯降低 (P<0.01);ATS組VEGFR-2蛋白表達均低于ASP、TXL及ATO組(P<0.01),與ASP組比較,TXL組、ATO組VEGFR-2 蛋白表達均明顯降低 (P<0.05),兩組間比較差異無顯著性(P>0.05)。見Tab 3。
3討論
隨著對動脈粥樣硬化研究機制的深入,血管外膜在動脈粥樣硬化發生發展中的作用也越來越受到重視,滋養血管作為外膜中的一部分, 在動脈粥樣硬化斑塊形成之前,在動脈粥樣硬化早期新生滋養血管就已出現[14]。新生的滋養血管同時也是炎性物質等進入血管壁的通路[4]。本實驗中單側頸動脈硅膠管包裹術復合高脂飼料喂養模型[15]是為了建立動脈粥樣硬化早期滋養血管新生模型,以驗證“金三角”方案對動脈粥樣硬化早期滋養血管新生的干預作用。
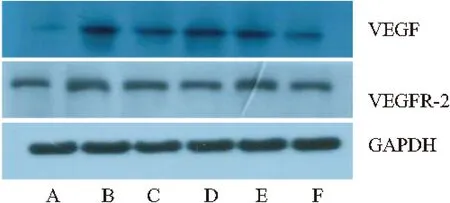
Fig 3Expression of VEGF and VEGFR-2 protein in the
adventitia of common carotid artery in all groups
A:Control group;B:Model group;C:TXL group;D:ATO group;E:ASP group;F:ATS group
Tab 3Levels of VEGF and VEGFR-2 protein expression in the

GroupVEGFVEGFR-2Control0.04±0.010.27±0.02Model0.31±0.01**0.61±0.02**TXL0.24±0.01##△0.40±0.03#△aATO0.18±0.01#△△0.39±0.02#△aASP0.21±0.04#△0.47±0.05#△ATS0.11±0.03#0.31±0.05#
**P<0.01vscontrol group;#P<0.01,##P<0.05vsmodel;△P<0.01,△△P<0.05vsATS group;aP<0.05vsASP group
血管內皮生長因子(VEGF)特異的作用于血管內皮細胞,誘導內皮細胞的增生、遷移,從而發揮生理和病理性促血管新生的作用。VEGF促血管新生的作用主要通過兩個特異表達血管內皮細胞的酪氨酸激酶受體:VEGFR-1和VEGFR-2,VEGF主要通過VEGFR-2促進內皮細胞增殖和新生血管形成[16]。VEGFR-2經過自身胞質內酪氨酸殘基磷酸化,進而激活下游信號通路,促進內皮細胞的存活、增生和遷移,誘導新生血管形成,VEGF及其受體VEGFR-2通路是血管新生發生的主要通路。在滋養血管新生處可見大量VEGF、VEGFR-2表達[17]。采用彩色微球技術可較為準確的測定局部血流狀況[18],本實驗采用該技術檢測頸動脈上微血管的血流量,以間接證實頸動脈外膜滋養血管新生的程度。CD34可間接反映頸動脈外膜微血管數量[15]。
通心絡、他汀類藥物、阿司匹林均對斑塊內新生血管有一定干預作用,此外,辛伐他汀可通過微血管內皮保護作用發揮抑制滋養血管異常增生的作用,但是他汀類的副作用不可避免,既往研究已證實,“金三角”方案減少西藥副作用,上述實驗已證實,3藥聯用組能明顯減少VEGF/VEGFR-2基因和蛋白表達,另外3藥聯用組同時可明顯減少頸動脈微血管血流量,其效果優于3藥單用。“金三角”方案能夠減少血管外膜新生滋養血管數量,使炎性物質進入血管壁的途徑減少,從而為延緩動脈粥樣硬化進程提供一種新途徑。但是“金三角”抑制滋養血管新生的相關機制還有待于進一步研究。
參考文獻:
[1]王磊.通心絡聯合阿托伐他汀、阿司匹林(ATS)對ApoE-/-小鼠動脈粥樣硬化早期干預及機制研究[D].河北: 河北醫科大學, 2013.
[1]Wang L.Effects and mechanism of Tongxinluo combined with atorvastatin and aspirin(ATS)on early atherosclerosis lesions in ApoE-/-mouse[D].HeBei:Hebei Medical University ,2013.
[2]劉子懿,孔煒.血管外膜在動脈粥樣硬化中的作用[J].生理科學進展,2010, 41(3):177-82.
[2]Liu Z Y, Kong W.The role of adventitia in atherosclerosis[J].ProgrPhysiolSci,2010,41(3):177-82.
[3]Heistad D D,Marcus M L, Martins J B. Effects of neural stimuli on blood flow through vasa vasorum in dogs[J].CirculatRes,1979,45(5): 615-20.
[4]G?ssl M, Versari D, Lerman L O, et al.Low vasa vasorum densities correlate with inflammation and subintimal thickening: Potential role in location-determination of atherogenesis[J].Atherosclerosis,2009,206(2): 362-8.
[5]Kumamoto M,Nakashima Y,Sueishi K.Intimal neovascularization in human coronary atherosclerosis:its origin and pathophysiological significance[J].HumPathol,1995, 26(4): 450-6.
[6]畢軼,馬亞兵,高海青.通心絡抗動脈粥樣硬化研究進展[J].中國心血管雜志,2005,10(2):142-3.
[6]Bi Y, MA Y B, Gao H Q.Research Progress of anti-atherosclerosis mechanism of Tong xin luo[J].ChinJCardiovascMed,2005,10(2):142-3.
[7]溫寶書,傅潔民,王慧.他汀類藥物抗動脈粥樣硬化機制的研究進展[J].解放軍藥學學報,2005,21(3):213-6.
[7]Wen B S,Fu J M, Wang H. Research progress of anti-atherosclerosis mechanism of statins[J].PharmJChinPeople′sLiberArmy,2005,21(3):213-6.
[8]邱滿堂,吳曉燕,戚曉紅. 阿司匹林抑制動脈粥樣硬化作用機制的研究進展[J].現代生物醫學進展,2010,10(9):3757-9.
[8]Qiu M T,Wu X Y, Qi X H.Progress on the mechanism of aspirin’s anti-atherosclerotic effects [J].ProgrModBiomed, 2010,10(9):3757-9.
[9]張路,吳宗貴,廖德寧,等.通心絡對實驗性家兔主動脈粥樣斑塊內血管內皮生長因子表達的影響[J].中國動脈硬化雜志,2004,12(2):177-82.
[9]Zhang L,Wu Z G,Liao D N,et al.Effects of tongxinluo on the expression of vascular endothelial growth factor in rabbit aortic atherosclerotic plaques[J].ChinJArterioscl,2004,12(2):177-82.
[10]馬曄,馬建芳,關瑞錦.阿托伐他汀對兔動脈粥樣硬化斑塊的干預作用[J].中國循證心血管醫學雜志, 2013,5(6):390-4.
[10]Ma Y,Ma J F,Guan R J. Intervention effect of atorvastatin on vascular endothelial growth factor in atherosclerotic plaque in rabbits[J].ChinJEvide-BasesCardiovascMed,2013,5(6):390-4.
[11]薛潔,華軼男,顧振綸,等. 阿司匹林抑制兔腹主動脈粥樣斑塊破裂及MMP-2表達的研究[J].中國藥理學通報, 2008,24(10):1335-9.
[11]Xue J,Hua Y N,Gu Z L,et al.Study of aspirin on inhibiting the atherosclerotic plaque rupture and MMP-2 expression of abdominal aorta in atherosclerotic rabbits[J].ChinPharmacolBull, 2008,24(10):1335-9.
[12]Yusuf S,Pais P,Afzal R,et al.Effects of a poly pill (Poly cap) on risk factors in middle-aged individuals without cardiovascu- lar disease(TIPS): a phase,double-blind, randomized trial[J].Lancet, 2009, 373(9672): 1341-51.
[13]肖維剛,張秋艷,郎艷松,等.通心絡對高脂血癥兔甲襞微循環血流速度的影響[J].微循環學雜志, 2013, 23(4): 8-11.
[13]Xiao W G,Zhang Q Y,Lang Y S,et al.Effects of Tongxinluoon on nail fold microcirculation in hyperlipemia rabbit [J].ChinJMicrocircul, 2013, 23(4): 8-11.
[14] Herrmann J,Lerman L O,Rodriguez-Porcel M,et al.Coronary vasa vasorum neovascularization precedes epicardial endothelial dysfunction in experimental hypercholesterolemia[J].CardiovascRes,2001, 51(4): 762-6.
[15]肖維剛.動脈管壁“孫絡-微血管”滋生在動脈粥樣硬化早期病變中的作用及通絡干預研究[D].河北: 河北醫科大學, 2014.
[15]Xiao W G.The role of vasa vasorum angiogenesis in early atherosclerosis and intervention studies with tongxinluo[D].Hebei:Hebei Medical University,2014.
[16]張偉麗,惠汝太.VEGF及其受體在動脈粥樣硬化中的作用 [J]. 中國分子心臟病學雜志,2005,5(3): 568-73.
[16]Zhang W L,Hui R T.The biological role of VEGF and its receptors in atherosclerosis[J].MolCardiolChina,2005,5(3): 568-73.
[17] G?ssl M, Herrmann J, Tang H, et al.Prevention of vasa vasorum neovascularization attenuates early neointima formation in experimental hypercholesterolemia[J].BasicResCardiol, 2009, 104(6): 695-706.
[18]沈偉,范維琥,施海明.微球技術在血管新生研究領域中的應用進展[J].心血管病學進展, 2007,28(5): 763-6.
[18]Shen W,Fan W H,Shi H M. Application improvement of microspheres in angiogenesis research[J].AdvancesCardiovascDis,2007,28(5): 763-6.
Interventional effects of Tongxinluo combined with Atorvastatin and
Aspirin(ATS) on the angiogenesis of vasa vasorum
in the early stage of atherosclerosis
LANG Yan-song1,2,MI Hong-ying1,2,LIU Hong-Li2,YUAN Guo-qiang3,4
(1.DeptofIntegratedTraditionalChineseandWesternMedicineofHebeiMedicalUniversity,Shijiazhuang050017,China;
2.DeptofCardiology,YilingMedicalResearchInstituteofHebeiProvince,KeyLaboratoryofStateAdministrationof
TraditionalChineseMedicine(cardio-cerebralvascularnetworkdisease),Shijiazhuang050035,China; 3.Deptof
CadiovascularDiseases,YilingHospitalofHebeiMedicalUniversity,KeyDisciplineofStateAdministrationofTraditionalChinese
Medicine,Shijiazhuang050091; 4.KeyLaboratoryofNetworkDiseaseofHebeiProvince,Shijiazhuang050035,China)
Key words:atherosclerosis;vasa vasorum;VEGF;color microsphere;Tongxinluo supermicropowder;Atorvastatin;Aspirin