吸入氫氣對失血性休克大鼠肺組織水通道蛋白表達的影響
吸入氫氣對失血性休克大鼠肺組織水通道蛋白表達的影響
卜慶麗1,閆戰秋2,李會1,李恩琪2,帥訓軍1,姜敏1,艾登斌1
(1青島市市立醫院,山東青島266011;2濰坊醫學院)
摘要:目的探討吸入氫氣對失血性休克大鼠肺組織水通道蛋白(AQP)表達的影響。方法選擇成年雄性SD大鼠40只,隨機分為假手術對照組(CON組)、失血性休克組(SH組)、1%氫氣組(1%H2組)及2%氫氣組(2%H2組),每組各10只。SH組、1%H2組及2%H2組制備大鼠失血性休克模型,1%H2組和2%H2組分別在模型制作過程中吸入1%、2%的氫氣,其他組操作中不吸入氫氣。復蘇2 h時,采集各組大鼠動脈血,行血氣分析,測算氧合指數(PaO2/FiO2)。處死大鼠取肺組織,測定肺組織肺濕干重比(W/D)。光鏡下觀察肺組織,進行病理評分。取左肺組織,制成10%組織勻漿,離心后取上清液,采用酶聯免疫吸附法測定肺組織AQP-1、AQP-5蛋白。結果SH組、1%H2組、2%H2組W/D、肺組織病理評分均高于CON組,PaO2/FiO2、AQP-1及AQP-5蛋白表達均低于CON組(P均<0.05)。1%H2組及2%H2組W/D、肺組織病理評分均低于SH組,PaO2/FiO2、AQP-1及AQP-5蛋白表達均高于SH組(P均<0.05)。結論 吸入氫氣可能通過增加肺組織中AQP-1、AQP-5蛋白的表達,從而減輕失血性休克大鼠肺損傷的程度。
關鍵詞:氫氣;失血性休克;急性肺損傷;水通道蛋白
doi:10.3969/j.issn.1002-266X.2015.42.009
中圖分類號:R605.971 文獻標志碼:A
收稿日期:(2015-07-10)
通信作者:艾登斌
失血性休克是臨床常見的危重癥,其中肺是最常受累的器官。肺損傷是導致休克后全身炎癥反應的重要病理過程。因此,如何防治失血性休克后的急性肺損傷具有重要的臨床意義[1,2]。研究表明,休克后肺損傷與肺內水分子的滲出及清除平衡失調有關。水通道蛋白(AQP)是一種對水分子有通透性的膜蛋白分子,與急性肺損傷、肺水腫密切相關[3]。AQP-1和AQP-5在肺臟組織中高度表達,對維持肺內水平衡起著重要作用[4]。氫氣是一種生理惰性氣體,可通過抗炎、抗氧化、抗凋亡等作用治療急性肺損傷[5]。但氫氣對肺組織AQP的作用尚不明確。2015年1~6月,我們采用吸入氫氣處理失血性休克大鼠,觀察其肺組織AQP-1、AQP-5的表達變化,探討吸入氫氣治療失血性休克急性肺損傷的機制。
1材料與方法
1.1動物與分組成年雄性SD大鼠40只,體質量230~280 g。通過隨機數字法分為假手術對照組(CON組)、失血性休克組(SH組)、1%氫氣組(1%H2組)及2%氫氣組(2%H2組),每組各10只。
參考文獻1.2失血性休克模型制備SH組、1%H2組及2%H2組[6]制備大鼠失血性休克模型。大鼠稱重后,腹腔注射20%烏拉坦(0.5 mL/100 g)進行麻醉,右側腹股溝區備皮后分離股動脈、股靜脈,分別置入套管。除CON組外,其他各組經股動脈套管放血制備失血性休克模型。連接MP150多導生理信號記錄儀監測平均動脈壓(MAP),放出的血液加入肝素儲存于容器中備用,股靜脈用于回輸血液和復蘇液體。置管成功后,經股動脈導管10 min內放血,維持MAP于40 mmHg,維持休克狀態1 h。維持休克狀態時,如血壓高于45 mmHg則放部分血液,血壓低于35 mmHg則回輸少量血液。1 h后回輸全部放出的血液并補等容量的乳酸林格氏液進行復蘇,以維持MAP>80 mmHg為復蘇成功的標志。CON組只進行置管不進行放血,其他操作與SH組相同。
1.3氫氣干預方法參照文獻[7]使用M177021氫氣發生器電解水產生氫氣,純度約為99.999%。實驗開始時將大鼠放入具有入氣口和出氣口的密閉箱子,將氫氣與氧氣混合氣體經入氣口輸入箱子里,在出氣口收集殘氣。使用JSA8-H2氫氣檢測儀檢測出氣口處氫氣的濃度,調節到相應的氫氣濃度。1%H2組和2%H2組分別在模型制作過程中吸入1%、2%的氫氣,其他組操作中不吸入氫氣。
1.4氧合指數(PaO2/FiO2)測算復蘇2 h時,采集各組動脈血,使用i-STAT300型血氣分析儀行血氣分析,測算PaO2/FiO2。
1.5肺組織肺濕干重比(W/D)測算采集動脈血后立刻處死各組大鼠,取肺組織,剪下右肺下葉組織,用濾紙吸干表面水分后稱濕重,然后放入80 ℃烤箱烤24 h至恒重后稱干重,計算W/D。
1.6肺組織病理評分取右肺中葉,用預冷的生理鹽水將肺組織沖洗干凈,用4%甲醛溶液固定后進行HE染色。參照文獻[8]光鏡下觀察肺組織,觀察中性粒細胞浸潤、肺泡內充血、肺間質水腫和肺泡水腫情況,分別對各項病理改變進行病理評分:無改變或改變非常輕微計0分;輕度改變計1分;中度改變計2分;重度改變計3分;極重度改變計4分。計算4項病理改變指標的總分,每張切片隨機選擇10個視野,取總分平均值。
1.7肺組織AQP-1、AQP-5蛋白表達檢測取左肺組織,稱重后加入9倍預冷的生理鹽水,制成10%組織勻漿,離心后取上清液。采用酶聯免疫吸附法(ELISA)測定肺組織AQP-1、AQP-5蛋白的表達。

2結果
SH組、1%H2組、2%H2組W/D、肺組織病理評分均高于CON組,PaO2/FiO2、AQP-1蛋白、AQP-5蛋白均低于CON組(P均<0.05)。1%H2組及2%H2組W/D、肺組織病理評分均低于SH組,PaO2/FiO2、AQP-1蛋白、AQP-5蛋白均高于SH組(P均<0.05)。見表1。
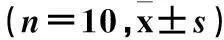
表1 各組肺組織W/D、PaO 2/FiO 2、病理評分、AQP-1蛋白、AQP-5蛋白比較
注:與CON組比較,*P<0.05;與SH組比較,#P<0.05。
3討論
失血性休克及復蘇過程中極易誘發急性肺損傷,其機制眾多。既往研究發現,即使在失血性休克后無感染發生,急性肺損傷的發生率仍較高(約40%),肺內水的滲出與吸收失衡是急性肺損傷發生的重要原因[9]。
氫氣是一種電中性小分子物質,具有較好的細胞膜通透性,能自由進入細胞內發揮一定的生理作用。研究證明,氫氣具有抗氧化、抗凋亡和抗炎等多種作用,在各種器官保護中發揮重要作用[10]。最近有研究表明,氫氣能減輕各種肺損傷[11,12]。本研究發現,SH組W/D、肺組織病理評分高于CON組,PaO2/FiO2低于CON組,提示失血性休克后可以導致肺組織損傷;1%H2組及2%H2組W/D、肺組織病理評分低于SH組,PaO2/FiO2高于SH組,提示吸入氫氣后能減輕肺組織的水腫程度、減輕肺損傷,并能改善肺功能,說明吸入氫氣可以改善失血性休克大鼠肺損傷的程度。
AQP是一種存在于細胞膜上對水具有特異通透性的膜蛋白,對肺內水平衡調節具有重要作用[13,14]。其中AQP-1和AQP-5為專一水通道蛋白,僅能轉運水蛋白,廣泛存在于各系統中。AQP-1主要存在于肺泡毛細血管內皮細胞及臟層胸膜間皮細胞上,主要清除支氣管和脈管周圍的的水分[15]。AQP-5主要存在于Ⅰ型肺泡上皮細胞內,主要功能是清除肺泡內的水分[16]。但吸入氫氣是否對休克后肺損傷中AQP具有調控作用尚不明確。本研究發現,1%H2組和2%H2組AQP-1、AQP-5蛋白表達高于SH組,提示吸入氫氣能提高肺組織中AQP-1及AQP-5,可能與其減輕肺損傷有關,推測吸入氫氣可能通過促進AQP-1和AQP-5蛋白的表達,發揮減輕失血性休克后肺損傷的作用。
綜上所述,吸入氫氣可能通過促進肺組織中AQP-1和AQP-5蛋白的表達,從而減輕失血性休克大鼠肺損傷的程度。
參考文獻:
[1] Kawanishi S, Takahashi T, Morimatsu H,et al.Inhalation of carbon monoxide following resuscitation ameliorates hemorrhagic shock-induced lung injury[J]. Mol Med Rep, 2013,7(1):3-10.
[2] Li HB, Wang GZ, Gong J,et al.BML-111 attenuates hemorrhagic shock-induced acute lung injury through inhibiting activation of mitogen-activated protein kinase pathway in rats[J]. J Surg Res, 2013,183(2):710-719.
[3] 高巨,周羅晶,陳弘,等.烏司他丁對大鼠“失血性休克—內毒素”二次打擊肺組織水通道蛋白表達的影響[J].中國急救醫學,2011,31(10):901-904.
[4] Singha O, Kengkoom K, Chaimongkolnukul K, et al. Pulmonary edema due to oral gavage in a toxicological study related to aquaporin-1, -4 and -5 expression[J]. J Toxicol Pathol, 2013,26(3):283-291.
[5] Ohsawa I, Ishikawa M, Takahaski K, et al. Hydrogen acts as a therapeutic antioxidant by selectively reducing cytotoxic oxygen radicals[J]. Nat Med, 2007,13(6):688-693.
[6] Xie KL, Yu YH, Zhang ZS, et al. Hydrogen gas improves survival rate and organ damage in zymosan-induced generalized inflammation model[J]. Shock, 2010,34(5):495-501.
[7] Junko K, Hiroshi M, Toru T,et al. Effects of biliverdin administration on acute lung injury induced by hemorrhagic shock and resuscitation in rats[J]. PLoS One, 2013,8(5):e63606.
[8] Kozian A, Schilling T, Freden F, el al. One-lung ventilation induces hyperperfusion and alveolar damage in the ventilated lung:all experimental study[J]. Br J Anaesth, 2008,100(4):549-559.
[9] Maeshima K, Takahashi T, Uehara K,et al. Prevention of hemorrhagic shock-induced lung injury by heme arginate treatment in rats[J]. Biochem Pharmacol, 2005,69(11):1667-1680.
[10] Nakashima KN,Mori T. Molecular hydrogen alleviates nephrotoxicity induced by anti-cancer drag cisplatin without compromising anti-tumor activity in mice[J].Cancer Chemother Pharmacol, 2009,64(4):753-781.
[11] Awamura T,Huang CS, Tochigi N, et al. Inhaled hydrogen gas therapy for prevention of lung transplant-induced ischemia/reperfusion injury in rats[J]. Transplantation, 2010,90(6):1344-1351.
[12] 石海梅,周華成,賈雅蕊,等. 氫氣對失血性休克大鼠急性肺損傷的影響[J].中華危重病急救醫學,2013,25(6):347-350.
[13] Preston GM, Carroll TP, Guhhino WB, et al. Appearance of water channels in xenopus oocytes expressing red cell CHIP28 protein.[J]. Science, 1992,256(5055):385-387.
[14] Sun CY, Zhao YX, Zhong W, et al. The expression of aquaporins 1 and 5 in rat lung after thoracic irradiation[J]. J Radiat Res, 2014,55(4):683-689.
[15] Gao ZL, Xu JL, Sun DL, et al.Traditional Chinese medicine, Qing Ying Tang, ameliorates the severity of acute lung injury induced by severe acute pancreatitis in rats via the upregulation of aquaporin-1[J]. Exp Ther Med, 2014,8(6):1819-1824.
[16] Verkman AS. Role of aquaporins in lung liquid physiology[J].Respir Physiol Neumbiol, 2007,159(3):324-330.

