腦淀粉樣血管病所致腦出血的免疫性血管病理損害初步研究
顧小花,徐俊,程欣欣,張巧全,時建銓
腦出血是威脅人類生命健康與安全的突發腦血管事件,而自發性腦出血又多在非外傷情況下出現,是無明顯誘因的腦大、小動脈,靜脈和毛細血管自發性破裂引起的腦內出血。自發性腦出血是一種多因素疾病,受環境和遺傳因素等多種因素共同作用,而腦淀粉樣血管病(cerebral amyloid angiopathy,CAA)是其重要的致病因素之一,發病率與年齡呈正相關。與CAA相關的免疫病理機制改變有多種,而由晚期糖基化終產物受體(receptor for advanced glycation end products,RAGE)、低密度脂蛋白受體相關蛋白1(low-density lipoprotein receptor related protein-1,LRP1)參與的β-淀粉樣蛋白(amyloid β,Aβ)的轉運異常使大腦中Aβ聚集是否為其可能的病理機制,目前尚無確切結論。
1 對象與方法
1.1 研究對象 入組患者為2010-2011年因腦出血急診就診本院神經外科,并于發病72 h內行手術治療的患者,共46例,其中男27例,女19例,年齡31~81歲,平均(56±15)歲。所有患者入院后均行顱腦計算機斷層掃描(computed tomography,CT)/磁共振成像(magnetic resonance imaging,MRI)、計算機斷層掃描血管造影(computed tomography angiography,CTA)檢查證實為自發性顱內出血,且排除外傷、動脈瘤、動靜脈畸形、煙霧病、腫瘤等可能,患者無明確的抗凝及抗血小板聚集等相關藥物使用史,無明確的血液系統疾病史。患者入院后均完善相關術前檢查,明確無明顯的手術禁忌,急診行手術治療,均給予“去骨瓣減壓+血腫清除術”治療,術后24 h復查頭顱CT血腫清除均較理想,術中留取血腫組織及腦組織碎片用作病理學檢查。
1.2 研究方法 用免疫熒光技術對腦組織切片進行染色,先采用硫黃素T染色,在顯微鏡下觀測,得出ICH患者的皮層腦組織Aβ的表達情況,再采用CD34(兔抗人CD34抗體,武漢博士德生物工程有限公司,1∶1000)染色確定Aβ沉積的部位為血管壁,根據波士頓診斷標準[1],陽性者即硫黃素與CD34均強染則確診為CAA,陰性者即硫黃素未被染上者則確診為非CAA,分別將陽性與陰性者分為CAA-ICH組與非CAA-ICH組,進行免疫熒光染色檢測LRP1與RAGE的表達情況。每張切片隨機選取5個不重疊40倍視野,采用Image J分析軟件,分別計算每視野的LRPl和RAGE的平均灰度值,進而求出每例標本的平均灰度值。用平均灰度值代表LRPl和RAGE的表達水平。陽性區表達的強弱和灰度值呈正相關,灰度值越大則陽性表達越強,灰度值越小則陽性表達越弱。
1.3 統計學處理 采用SPSS 13.0進行統計分析,計量資料如符合正態分布采用(表示,兩組間比較采用獨立樣本t檢驗;計量資料如不符合正態分布,采用中位數(四分位數間距)表示,兩組間比較用Kruskal-Wallis H秩和檢驗。計數資料采用頻數或百分位數表示,組間比較用χ2檢驗或Fisher確切概率法,P<0.05為差異有顯著性。
2 結果
2.1 臨床資料結果 本研究納入的46例ICH腦組織樣本中,確診為CAA者為8例(其中男5例,女3例),占總數的17.39%,非CAA-ICH組共38例(其中男22例,女16例),CAA-ICH組與非CAA-ICH組患者一般資料比較及CAA-ICH組8例患者的基本資料分別見表1、表2。
本研究納入的46例ICH腦組織樣本中,確診為CAA者為8例,患者腦組織標本CD34/硫黃素T雙重熒光染色見圖1。
2.2 腦組織中LRPl和RAGE的表達情況 本研究納入的46例ICH腦組織樣本中,確診為CAA的8例患者腦組織標本均有Aβ、RAGE、LRP1蛋白的共表達(陽性率100%),而在非CAA自發性腦出血患者中均無共表達。CAA患者腦組織標本LRP1/硫黃素T及RAGE/硫黃素T雙重熒光染色見圖2。
2.3 LRPl和RAGE在腦組織中的表達水平 兩組腦組織標本中LRPl和RAGE的表達水平比較見表3,CAA-ICH組的LRP1表達水平較非CAA-ICH組顯著降低(P=0.031),CAA-ICH組的RAGE表達水平較非CAA-ICH組顯著升高(P=0.015),比較結果見圖3。
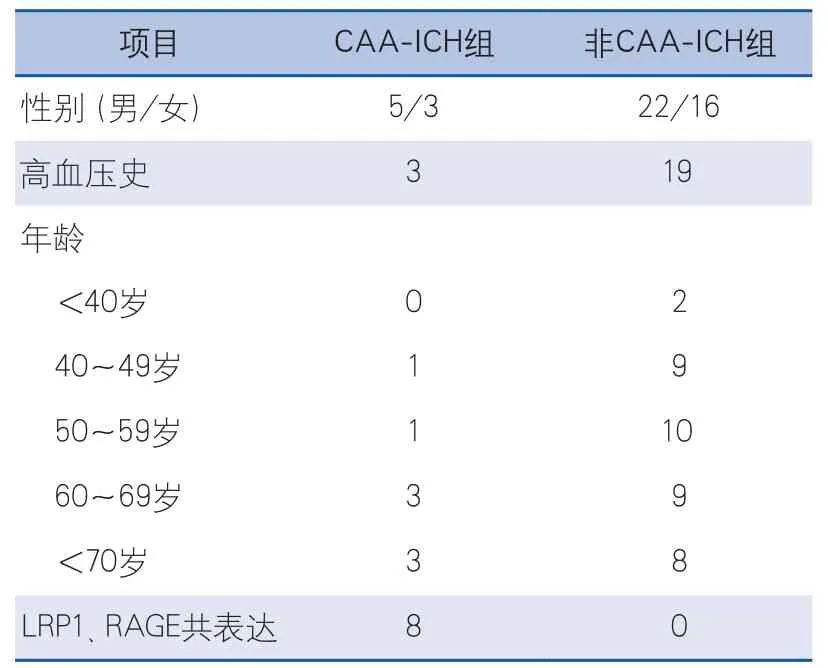
表1 CAA-ICH組與非CAA-ICH組一般資料比較
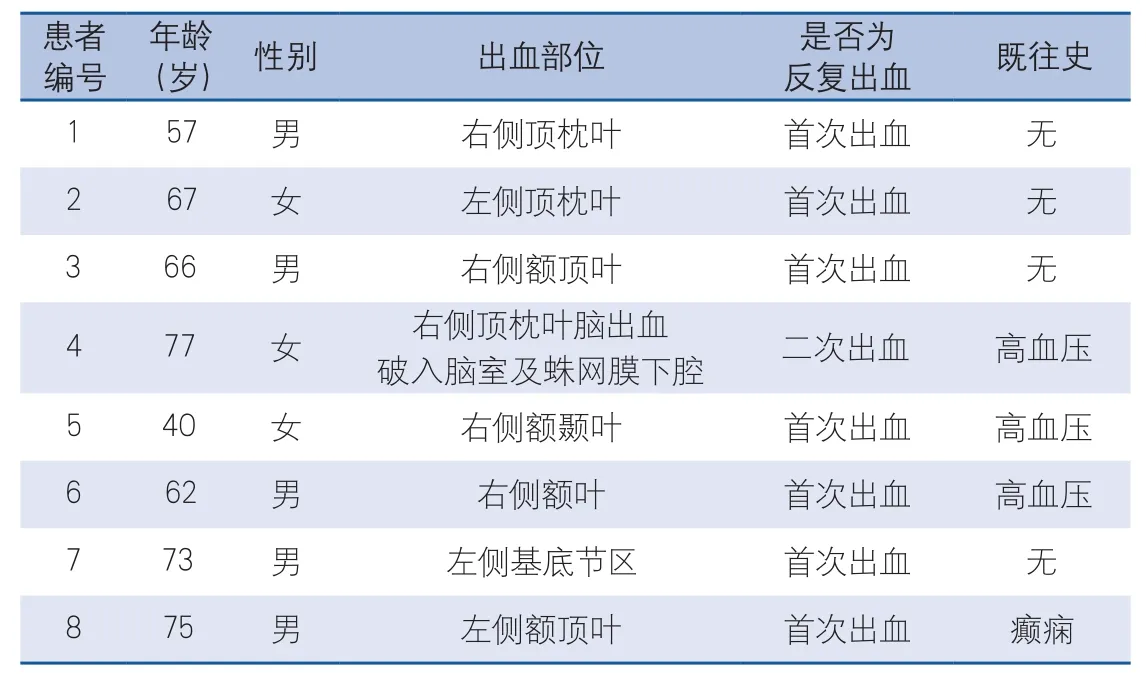
表2 CAA-ICH組患者基本資料
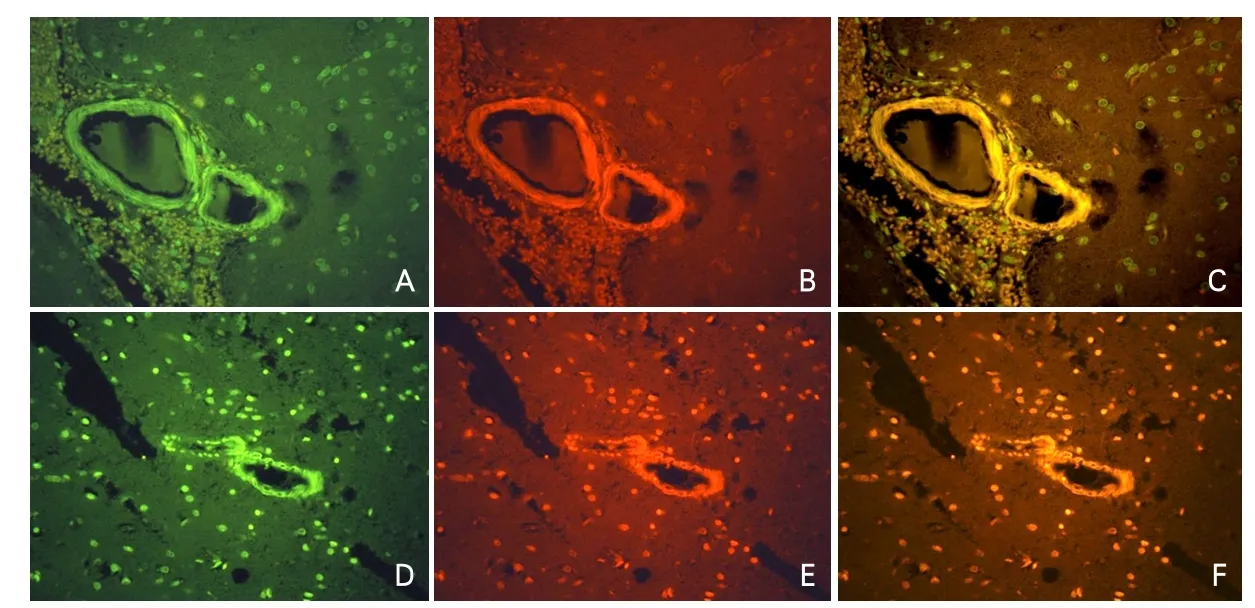
圖1 1例腦淀粉樣血管病患者腦組織標本CD34/硫黃素T雙重熒光染色
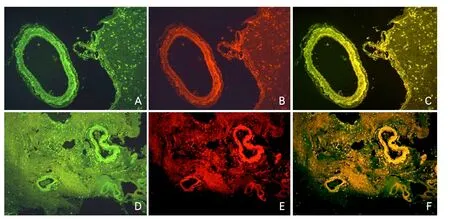
圖2 1例腦淀粉樣血管病患者腦組織標本LRP1/硫黃素T及RAGE/硫黃素T雙重熒光染色
3 討論
CAA是老年人常見的腦小血管病,通常分為散發性CAA和家族性CAA,散發性CAA病因不明,主要是由不可溶的Aβ和其他淀粉樣肽在軟腦膜和皮質的動脈、微動脈和毛細血管壁的沉積,從而表現出一些臨床和病理特征[2]。目前研究認為,CAA出血部位常在枕葉、顳葉后部或額葉的表淺部位,枕葉是CAA-ICH的特征性部位。本研究中,CAA相關腦葉出血多分布在頂、顳、枕、額葉,較少累及基底節。部分患者合并高血壓,考慮高血壓可能是CAAICH的促發因素,或是再發出血的誘導因素。目前研究認為,高血壓可以加重CAA相關血管病變,尤其是纖維素樣壞死,從而導致CAA-ICH。在尸檢證實的CAA-ICH患者中,高血壓的患病率顯著高于不伴有ICH的CAA,進一步提示高血壓與CAA-ICH密切相關。CAA好發于老年人(家族性CAA除外),其發病率及嚴重程度均隨年齡增長而顯著增加,女性發病率略高于男性[3],本研究中,CAA-ICH患者主要集中于60歲以上老年人,男女發病率無明顯差異。
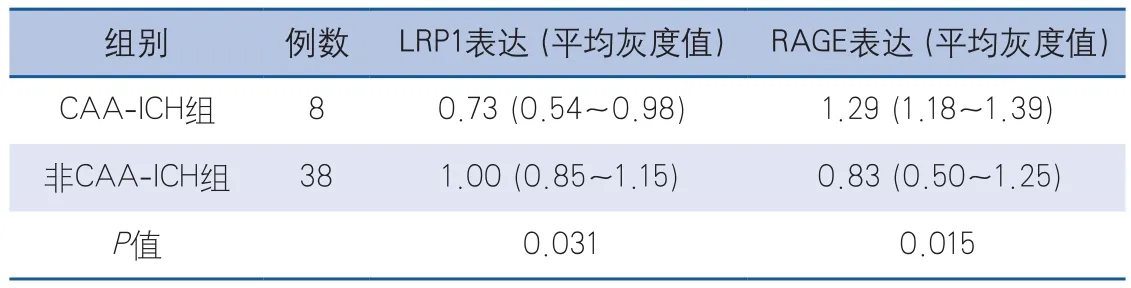
表3 兩組腦組織標本中LRPl和RAGE的表達水平比較(M,P25-P75)
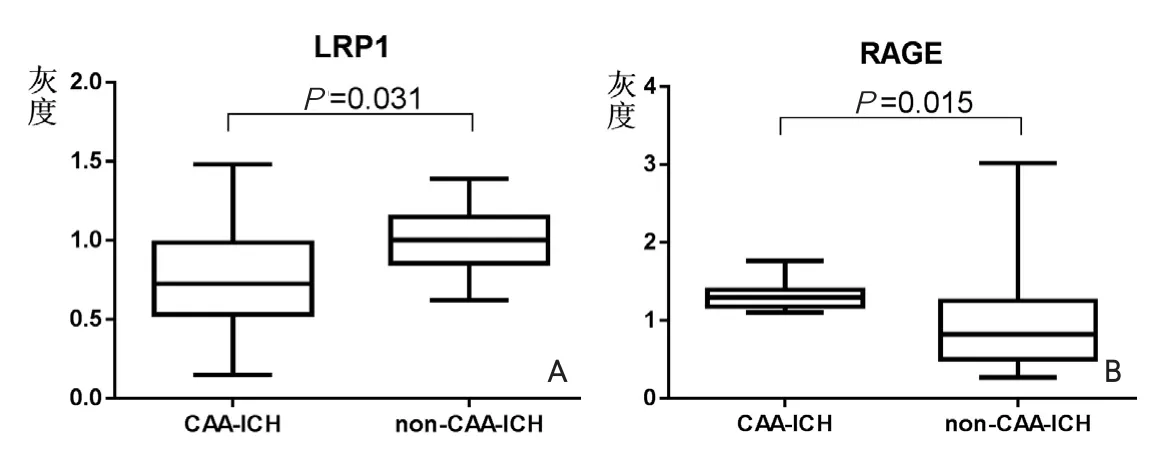
圖3 CAA-ICH組與非CAA-ICH組LRP1、RAGE平均灰度比較的箱式圖
CAA目前病因尚不清楚,主要病理特征是Aβ在腦內的異常聚積。Aβ由分泌酶水解β淀粉樣前體蛋白(β-amyloid precursor protein,APP)產生,其代謝異常造成的Aβ片段聚集沉積引發的級聯反應是CAA的主要致病原因。在正常狀態下,Aβ可恒定地被分解、去除,在腦實質中僅以可溶狀態微量存在。腦內Aβ水平通過兩種途徑維持平衡:第一種途徑是Aβ的生成和降解,β、γ分泌酶參與Aβ的生成,而腦啡肽酶、胰島素降解酶參與Aβ的降解;第二個平衡是Aβ通過血腦屏障(blood brain barrier,BBB)的內向與外向轉運,存在于BBB上的LRP1與RAGE受體是一對作用相反的Aβ跨BBB轉運體,大腦對Aβ的清除能力可能取決于兩者運輸Aβ量的代數和[4]。各種原因使Aβ代謝平衡破壞,即變成高度不溶性的β淀粉樣蛋白沉著在細胞間,加上變性的神經細胞突起和反應性神經膠質細胞形成斑塊,Aβ沉積在血管壁引起CAA。
本研究的著力點在于Aβ的第二條代謝途徑,LRP1是一種細胞表面蛋白,主要表達在血管壁上,特別是血管平滑肌細胞中,因含有與低密度脂蛋白(low-density lipoprotein,LDL)受體相同的重復序列,故稱LRP1。近年相關動物實驗表明,特定條件敲除血管平滑肌細胞中LRP1的APP/PS1小鼠,Aβ積累加劇[5]。既往研究表明,LRP1介導Aβ從腦內進入外周血液循環,Aβ和LRP1之間相互結合,以內吞或胞飲作用通過BBB進入外周血液,LRP1障礙導致Aβ的外流降低,因而使Aβ在腦中沉積增加[6]。本研究也發現,相對于非CAA-ICH組,CAAICH組中LRP1表達水平顯著減低。RAGE為細胞表面免疫球蛋白超家族中的一員,由404個氨基酸組成,人類表達RAGE蛋白的基因位于第6號染色體的短臂上,特點是維持與組織中配體的并置,其可在納摩爾(nmol)水平結合可溶的Aβ,介導外周血液中的Aβ通過BBB進入腦內,RAGE的下調能抑制Aβ的內流。與富含Aβ環境中觀察到的LRP1抑制相反,過度的Aβ數量通過陽性負反饋機制上調RAGE的表達[7]。在CAA患者的腦組織中,Aβ與小膠質細胞的RAGE結合,促使小膠質細胞向淀粉樣斑塊遷移、增殖,激活NF-κB并分泌巨噬細胞集落刺激因子(macrophage colony stimulating factor,M-CSF),引起炎癥反應。由于RAGE與Aβ相互作用,受體表達增加,使RAGE介導的Aβ內流增加,導致Aβ異常聚積[7-8]。本組研究中,測出RAGE在CAA-ICH組中表達顯著升高,表明在CAA-ICH組患者中,Aβ上調RAGE表達增加,導致Aβ從腦小血管向腦實質的轉運/沉積增多。綜上所述,CAA-ICH組患者的LRP1表達降低,RAGE表達升高可能導致Aβ的轉運異常,從而促進了CAA的形成。
CAA中Aβ沉積導致血管破裂的確切發病機制尚不清楚,有研究發現,與不伴有ICH的CAA相比,CAA-ICH患者常存在CAA血管病變合并癥,這可能與出血的易感性有關。這些合并癥包括微小動脈瘤膨脹擴張,纖維素樣壞死,血管壁的同心樣分裂(“雙管”樣表現),微量出血;在少數病例中,可見血管閉塞和血管炎[9]。因此可能的機制為:Aβ在血管壁迅速整合、聚集,導致細胞骨架松散,甚至發生崩解,細胞出現的損傷、水腫,細胞膜的膽固醇和脂質的流動性減弱[10],引起血管內彈力層破裂受損、纖維素樣壞死,血管脆性增加,形成微動脈瘤,最終導致破裂自發性的出血。目前引起LRP1、RAGE異常表達的原因尚不明確,而LRP1、RAGE對腦淀粉樣變性程度與腦出血的相關性需進一步探討。
CAA的發病率被顯著低估。典型的CAA相關性出血發生在腦葉區域,經常破入蛛網膜下腔,并經常發生在夜間。而高血壓性腦出血通常在日間活動時發生,好發于腦深部。一般合并認知功能減退的老年人,出現非外傷性、非高血壓性出血,同時影像學提示腦表淺部位出血特別是多發腦葉出血的患者,應該考慮到本病。梯度回波磁共振成像及磁敏感加權序列可被應用于檢測無癥狀性腦微出血(該疾病典型特征),為活體診斷可疑CAA提供了依據,顯著提高了CAA的檢出率[11-12]。本研究提示CAA是ICH的重要病因之一,CAA相關的免疫-血管因子RAGE、LRP1蛋白異常表達,在ICH發生發展中具有重要作用。不足之處在于樣本數量較少,需要大樣本的研究進行驗證。
1 Charidimou A,Martinez-Ramirez S,Reijmer YD,et al. Total magnetic resonance imaging burden of small vessel disease in cerebral amyloid angiopathy:An imaging-pathologic study of concept validation[J].JAMA Neurol,2016 Jun 27.
2 Yamada M. Cerebral amyloid angiopathy:emerging concepts[J]. J Stroke,2015,17:17-30.
3 Yamada M. Risk factors for cerebral amyloid angiopathy in the elderly[J]. Ann N Y Acad Sci,2002,977:37-44.
4 莊志清,閆福嶺. 慢性低氧對小鼠腦微血管內皮細RAGE和LRP-1表達的影響[J]. 中華腦血管病雜志(電子版),2009,3:4-8.
5 Kanekiyo T,Liu CC,Shinohara M,et al. LRP1 in brain vascular smooth muscle cells mediates local clearance of Alzheimer's amyloid-β[J]. J Neurosci,2012,32:16458-16465.
6 施詠梅,張志珺. 低密度脂蛋白受體相關蛋白與Alzheimer病[J]. 中華腦血管雜志(電子版),2007,1:138-142.
7 Cai Z,Liu N,Wang C,et al. Role of RAGE in Alzheimer's disease[J]. Cell Mol Neurobiol,2016,36:483-495.
8 Yan SS,Chen D,Yan S,et al. RAGE is a key cellular target for Abeta-induced perturbation in Alzheimer's disease[J]. Front Biosci (Schol Ed),2012,4:240-250.
9 李曉秋,韓雅玲,陳會生. 10例淀粉樣腦血管病相關腦葉出血的臨床病理分析[J]. 解放軍醫學雜志,2015,40:530-534.
10 唐亞娟,趙繼宗,李永,等. 自發性腦出血與淀粉樣腦血管病相關性研究[J]. 中華醫學雜志,2010,90:1016-1019.
11 張楚楚,孫永安,程欣欣,等. 磁敏感成像對腦淀粉樣血管病導致腦出血的診斷價值探討[J]. 中華老年心腦血管病雜志,2013,15:1253-1256.
12 Auriel E,Charidimou A,Gurol ME,et al. Validation of clinicoradiological criteria for the diagnosis of cerebral amyloid angiopathy-related in fl ammation[J].JAMA Neurol,2016,73:197-202.

