富鋰相xLi2MnO3·(1-x)LiMnO2正極材料的水熱合成及性能
王連邦,蔣靖康,蘇利偉,臧 寧,徐 亮,朱 偉
(1. 浙江工業大學 化學工程學院,浙江 杭州 310014;2. 國家動力及儲能電池產品質量監督檢測中心,浙江 長興 313100)
?
富鋰相xLi2MnO3·(1-x)LiMnO2正極材料的水熱合成及性能
王連邦1,蔣靖康1,蘇利偉1,臧寧2,徐亮2,朱偉2
(1. 浙江工業大學 化學工程學院,浙江 杭州 310014;2. 國家動力及儲能電池產品質量監督檢測中心,浙江 長興 313100)
摘要:電動車的發展對鋰離子電池正極材料提出了更高的要求.錳基富鋰相xLi2MnO3·(1-x)LiMnO2復合材料因其高容量、價格低廉以及環境友好等優點成為鋰離子電池正極材料的研究熱點.采用兩步水熱法成功合成了分散均勻的0.4Li2MnO3·0.6LiMnO2復合材料,并對其結構和電化學性能進行了研究.結果表明:經電化學活化后的材料容量可達189.4 mAh/g,30周后材料的放電容量較常規充放電活化高約10 mAh/g.電化學活化能有效激活Li2MnO3相并增加材料的容量,這為含Li2MnO3相的復合材料提供了增強電化學性能的方法.
關鍵詞:鋰離子電池;正極材料;xLi2MnO3·(1-x)LiMnO2復合材料;水熱法;電化學活化
近年來,電動汽車(EV)以及混合動力汽車(HEV)的發展推動了大功率鋰離子電池產業的快速發展,因此亟待開發比傳統LiCoO2具有更高電壓、更高容量、安全環保且價格低廉的正極材料[1-4].錳基正極材料因其貯量豐富,成本低且無污染的優點,受到廣泛關注,其中尖晶石型LiMn2O4研究較為成熟,但其實際容量僅為110~120 mAh/g,難以滿足人們對高能量密度電池的需求[5].正交型層狀錳酸鋰(o-LiMnO2)理論容量為285 mAh/g,符合目前高容量電池的需求,但其本身在充放電過程中易發生層狀結構向類尖晶石結構的不可逆轉變,且循環過程中發生的Jahn-Teller效應,造成材料容量衰減,循環穩定性差[6].針對這些缺點的改性主要有三方面:1)摻雜離子,如Mg2+,Cr3+,In3+和S2-等,優化晶體結構[7-9];2)顆粒表面包覆金屬氧化物,如AlF3,Al2O3和CoO等,避免電解液與活性物質直接接觸,減少晶型改變[10-12];3)與Li2MnO3形成富鋰相xLi2MnO3·(1-x)LiMnO2復合材料,利用Li2MnO3首次高壓(>4.5 V)充電過程中脫出Li+的同時產生的MnO2單元來穩定層狀結構,減少層狀向類尖晶石相的轉變[13],該復合材料具有高電壓、高容量的優勢.傳統xLi2MnO3·(1-x)LiMn-O2復合材料的制備方法主要為共沉淀法,先合成金屬鹽的氫氧化物[14]或碳酸鹽[15]前驅體,再通過高溫煅燒獲得所需材料,反應過程中原料充分接觸,但沉淀過程較難控制,易造成偏析.
采用水熱法合成xLi2MnO3·(1-x)LiMnO2復合材料不僅減少了高溫煅燒時的能耗,且制備出的產物顆粒分布均勻,形貌規整.復合材料中錳的平均價態根據文獻報道的絡合滴定法和氧化還原滴定法聯用進行測定[16],從而得出x的值.為了體現Li2MnO3組分能夠穩定復合材料結構及提供更高容量、更高電壓的作用,對復合材料制成的電池進行電化學活化,即先在低電壓范圍內(通常為2~4.5 V)預循環幾周對材料進行預處理,激活材料后在高電壓范圍內(2~4.8 V)完成后續循環.結果表明:經電化學活化后的材料容量可達189.4 mAh/g,30周后材料的放電容量較未活化高約10 mAh/g.
1實驗部分
1.1材料制備
采用兩步水熱法合成xLi2MnO3·(1-x)LiMnO2復合材料.第一步水熱法合成MnOOH前驅體,KMnO4和Mn(NO3)2按1∶4摩爾比混合后加入4 mol/L的LiOH溶液中,反應時鋰錳摩爾比為1,220 ℃水熱反應20 h后得到的沉淀物經過濾干燥即得前驅體MnOOH.第二步水熱反應將LiOH與前驅體按鋰錳摩爾比為10混合,其中,LiOH濃度為2 mol/L,200 ℃水熱反應8 h后得到的沉淀物經過濾洗滌至中性,真空干燥后即得目標產物.材料制備過程如圖1所示.

圖1 xLi2MnO3·(1-x)LiMnO2復合材料的合成路線圖Fig.1 Schematic illustration of preparation forxLi2MnO3·(1-x)LiMnO2 composites
1.2分析與表征
采用荷蘭PANalytical型X射線衍射儀進行XRD物相分析,使用Cu-Kα輻射源,掃描范圍10°~80°,掃描步長為0.02 (°)/s.分別采用Hitachi S-4700型掃描電子顯微鏡(SEM)觀察樣品的表面形貌和Tecnai G2F30型透射電子顯微鏡(TEM)觀察樣品的微觀結構.復合材料中x值的確定方法為絡合滴定與氧化還原滴定聯用,將樣品溶解于硫酸溶液中并加入過量Na2C2O4,80 ℃水浴待樣品完全溶解后,用KMnO4標準溶液返滴定過量Na2C2O4,總錳量的滴定是在pH為6.0時,以二甲酚橙為指示劑, EDTA標準溶液滴定所得.
1.3電化學性能測試
采用兩電極扣式實驗電池進行電化學性能測試.工作電極由活性材料、乙炔黑和PVDF(聚偏氟乙烯)按照8∶1∶1的質量比組成,以N-甲基吡咯烷酮(NMP)為溶劑混合成漿狀后,均勻涂抹在鋁箔上,120 ℃下真空干燥12 h,制成電極片,即電池正極.金屬鋰片為負極,Celgard2400為隔膜,電解液為1 mol/L的LiPF6/ EC+EMC+DMC(質量比1∶1∶1).在充滿高純氬氣的手套箱內組裝成CR2032型紐扣電池,采用LAND(CT2001A)電池測試系統進行充放電測試,0.05 C條件下進行充放電測試.CHI660B電化學工作站進行循環伏安測試.
2結果與討論
圖2是前驅體MnOOH和xLi2MnO3·(1-x)LiMnO2復合材料的XRD圖.圖2(a)為前驅體MnOOH的XRD圖,尖銳的衍射峰表明其具有良好的結晶度;圖2(b)中的衍射峰由o-LiMnO2(空間群為Pmnm)和m-Li2MnO3(空間群C2/m)組成,表明合成了xLi2MnO3·(1-x)LiMnO2復合材料,且材料結晶度良好.Li離子濃度高能促進與錳源的有效反應,有利于層狀結構的形成[17],因此采用較高濃度堿溶液反應.通過滴定法測定及計算得復合材料中x值為0.4,即復合材料分子式可表示為0.4Li2MnO3·0.6LiMnO2.
圖3(a)為前驅MnOOH的SEM圖,從圖3(a)看出:MnOOH前驅體為50~60 nm寬,20~30 nm厚,1 μm以上長的納米棒,分散均勻.圖3(b)為0.4Li2MnO3·0.6LiMnO2復合材料的SEM圖,從3(b)看出:復合材料為800 nm左右的納米棒;從放大的表面圖(圖3b左上角圖)可看出,納米棒是由大小在200 nm左右的納米片狀顆粒聚集而成.圖3(c)中的復合材料的TEM圖可看出:0.31 nm的晶面間距對應 Li2MnO3相的(0 2 2)晶面,0.56 nm的晶面間距對應LiMnO2相的(0 1 0)晶面,表明復合材料中兩相共存,與復合材料的XRD結果一致.
考慮到復合材料中的Li2MnO3相在小于4.4 V(vs. Li/Li+)電壓時不具有電化學活性,即+4價的錳無法被氧化到更高價態,需在高電壓范圍內對復合材料進行電化學性能測試[18].本工作采用逐步增加電壓的電化學活化法(Electrochemical treatment,簡寫為ECT);先2~4.5 V循環2周,再2~4.6 V循環兩周,2~4.7 V循環兩周,最終在2~4.8 V循環,電化學活化復合材料中的Li2MnO3相并提供容量.圖4為復合材料不同截止電壓(圖4a:2~4.5 V,圖4b:2~4.8 V,圖4c:ECT)時不同周數的充放電曲線圖.三種電壓范圍時,第一周3.8 V時均有一個明顯的充電平臺,對應LiMnO2的氧化脫鋰反應;當電壓逐漸上升至4.8 V時,在約4.75 V時出現第二個充電平臺,對應著Li2MnO3的脫鋰活化,即Li+脫出的同時失去O,該反應過程是不可逆的[19],因此2~4.8 V范圍內充放電第一周復合材料的庫倫效率較低,僅為56.9%.第一周后,4.5 V以下的充電平臺轉變為兩個,與LiMnO2的層狀結構轉變為類尖晶石結構有關[17, 20].不同電壓范圍時的放電曲線中均可以看到4 V和2.75 V左右的兩個平臺,隨著循環周數的增加,4 V的平臺變長,表明LiMnO2的層狀結構向類尖晶石結構轉變增加,2.75 V的放電平臺對應LiMnO2的嵌鋰,無明顯變化.從圖4(b)中看出:充放電電壓范圍變大,脫嵌鋰深度變大,材料的容量增加,因此,截止電壓為4.8 V時容量比4.5 V時高20~30 mAh/g.當復合材料在ECT程序下充放電時,2~4.5 V充放電結束后,放電容量為127 mAh/g,與圖4(a)中第二周放電容量相差不大;隨著電壓的逐步增加,材料的脫嵌鋰程度增加,當活化電壓達到4.8 V穩定充放電時,放電容量達到189.4 mAh/g,比最初容量提高了62.4 mAh/g,30周后材料的放電容量較常規充放電(圖4b)時高約10 mAh/g,為146.7 mAh/g,50周后的放電容量仍高于常規充放電容量7 mAh/g.隨著充放電電壓的逐步增加,材料的容量逐漸增加.電化學逐步充放電活化能夠有效激活Li2MnO3相,提高材料的容量,這為含Li2MnO3的復合材料提供了增強電化學性能的方法.
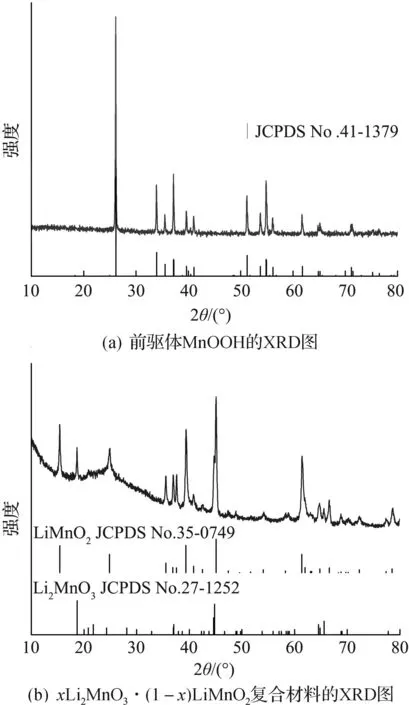
圖2 前驅體及復合材料的XRD圖Fig.2 XRD patterns of of precursor and composites

圖3 前驅體和復合材料的SEM和TEM圖Fig.3 SEM and TEM images of precursor and composites

圖4 復合材料不同周數的充放電曲線及循環性能Fig.4 Charge/discharge profiles at different cycles and cyclic performances of composites
圖5為復合材料前三周的循環伏安曲線(CV),其中,掃描電壓為2~4.8 V,掃描速率為0.1 mV/s.從圖5可以看出第一周約4.1 V出現了一個尖銳的氧化峰,對應充放電曲線中3.8 V時的平臺及隨后的斜坡;同時在接近4.8 V時出現尖峰,表明Li2MnO3相的活化過程.第二周和第三周時3.3 V和2.7 V處出現一對氧化還原峰,對應Mn3+/Mn4+的轉變;4.2 V和3.8 V處的一對氧化還原峰對應LiMnO2的層狀結構轉化而成的類尖晶石結構相的反應,與第二周后的充放電曲線平臺對應,證明了層狀結構向類尖晶石結構的轉變;第三周的4 V左右的氧化還原峰較第二周明顯,表明類尖晶石結構隨著循環的進行逐漸增加.從CV曲線中可以看出:第一周循環后材料中層狀結構和類尖晶石結構共同存在,形成一個混合相復合材料.
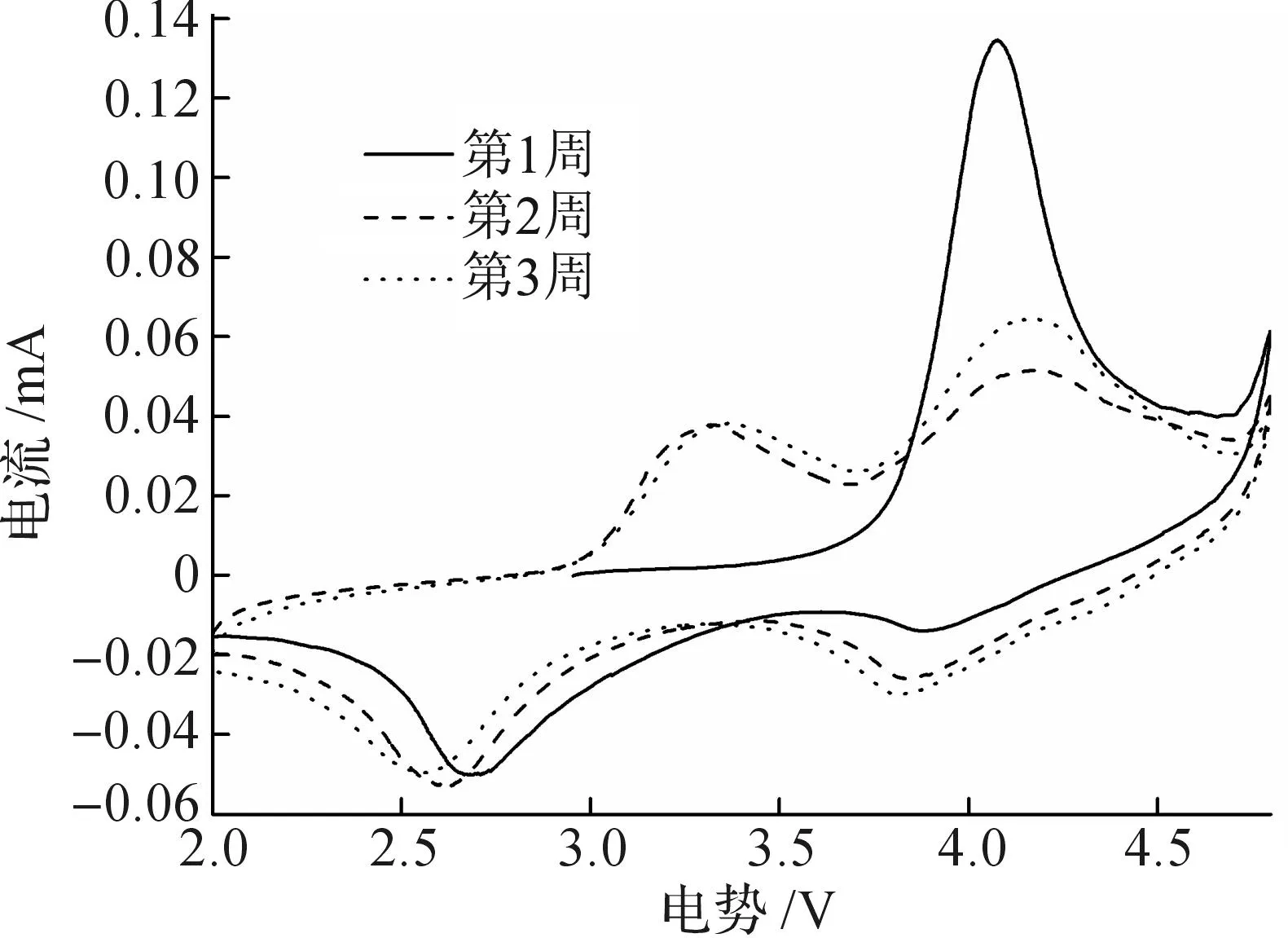
圖5 0.4Li2MnO3·0.6LiMnO2復合材料的循環伏安圖Fig.5 Cyclic voltammograms of 0.4Li2MnO3·0.6LiMnO2 composites
3結論
采用水熱法合成了0.4Li2MnO3·0.6LiMnO2復合材料,為富鋰相復合材料的合成提供了一種穩定可控且相對溫和的制備方法.同時對復合材料的結構和形貌進行了表征,研究了其在不同充放電電壓范圍及電化學活化時的性能.結果表明:所得產物結晶度良好,經電化學活化后的材料容量可達189.4 mAh/g,30周后材料的放電容量較常規充放電高約10 mAh/g.電化學活化能有效激活Li2MnO3相并提高材料的容量,這為含Li2MnO3的復合材料提供了增強電化學性能的方法.
參考文獻:
[1]王連邦,李晟,張品杰,等.低成本動力鋰離子電池磷酸鐵鋰正極材料的合成及性能[J].浙江工業大學學報,2012,40(4):355-360.
[2]WANG L, TANG W, JING Y, et al. Do transition metal carbonates have greater lithium storage capability than oxides? A case study of monodisperse CoCO3and CoO microspindles[J]. ACS Applied Materials & Interfaces, 2014,6(15):12346-12352.
[3]SU L, JING Y, ZHOU Z. Li ion battery materials with core-shell nanostructures[J]. Nanoscale, 2011,3(10):3967-3983.
[4]毛信表,王連邦,馬淳安.新型鋰儲藏合金負極材料研究進展[J].浙江工業大學學報,2006,34(4):364-368.
[5]王連邦,唐偉杰,蘇利偉,等.納米LiMn2O4的動態水熱法制備及儲鋰性能[J].浙江工業大學學報,2014,42(5):473-477.
[6]IDEMOTO Y, MOCHIZUKI T, UI K, et al. Properties, crystal structure, and performance of o-LiMnO2as cathode material for Li secondary batteries[J]. Journal of the Electrochemical Society,2006,153(2):418-424.
[7]WANG D, HUANG Y, HUO Z, et al. Synthesize and electrochemical characterization of Mg-doped Li-rich layered Li[Li0.2Ni0.2Mn0.6]O2cathode material[J]. Electrochimica Acta,2013,107:461-466.
[8]PANG W K, LEE J Y, WEI Y S, et al. Preparation and characterization of Cr-doped LiMnO2cathode materials by Pechini's method for lithium ion batteries[J]. Materials Chemistry and Physics,2013,139(1):241-246.
[9]SU Z, LU Z W, GAO X P, et al. Preparation and electrochemical properties of indium-and sulfur-doped LiMnO2with orthorhombic structure as cathode materials[J]. Journal of Power Sources,2009,189(1):411-415.
[10]PARK B C, KIM H B, BANG H J, et al. Improvement of electrochemical performance of Li [Ni0.8Co0.15Al0.05] O2cathode materials by AlF3coating at various temperatures[J]. Industrial & Engineering Chemistry Research,2008,47(11):3876-3882.
[11]CHO J, KIM Y J, KIM T J, et al. Enhanced structural stability of o-LiMnO2by sol-gel coating of Al2O3[J]. Chemistry of Materials,2001,13(1):18-20.
[12]CHO J. Stabilization of spinel-like phase transformation of o-LiMnO2during 55 ℃ cycling by sol-gel coating of CoO[J]. Chemistry of Materials,2001,13(12):4537-4541.
[13]THACKERAY M M, KANG S-H, JOHNSON C S, et al. Li2MnO3-stabilized LiMO2(M = Mn, Ni, Co) electrodes for lithium-ion batteries[J]. Journal of Materials Chemistry,2007,17(30):3112-3125.
[14]ZHAN D, YANG F, ZHANG Q, et al. Effect of solid-state reaction temperature onelectrochemical performance of LiMn2O4submicro-rods as cathode material for Li-ion battery by using γ-MnOOH submicro-rods as self-template[J]. Electrochimica Acta,2014,129:364-372.
[15]LEE D K, PARK S H, AMINE K, et al. High capacity Li[Li0.2Ni0.2Mn0.6]O2cathode materials via a carbonate co-precipitation method[J]. Journal of Power Sources,2006,162(2):1346-1350.
[16]于永麗,王乃芝,張秀娟,等.正極材料錳酸鋰中錳的價態分析[J].冶金分析,2007,27(6):20-23.
[17]HE Y, FENG Q, ZHANG S, et al. Strategy for lowering Li source dosage while keeping high reactivity in solvothermal synthesis of LiMnO2nanocrystals[J]. ACS Sustainable Chemistry & Engineering,2013(6):570-573.
[18]ROBERTSON A D, BRUCE P G. Mechanism of electrochemical activity in Li2MnO3[J]. Chemistry of Materials,2003,15(10):1984-1992.
[19]ARMSTRONG A R, ROBERTSON A D, BRUCE P G. Overcharging manganese oxides: extracting lithium beyond Mn4+[J]. Journal of Power Sources,2005,146(1/2):275-80.
[20]WU S H, YU M T. Preparation and characterization of o-LiMnO2cathode materials[J]. Journal of Power Sources,2007,165(2):660-665.
(責任編輯:陳石平)
Hydrothermal synthesis of Li-richxLi2MnO3·(1-x)LiMnO2
cathode material and electrochemical performance
WANG Lianbang1, JIANG Jingkang1, SU Liwei2, ZANG Ning2, XU Liang2, ZHU Wei2
(1. College of Chemical Engineering, Zhejiang University of Technology, Hangzhou 310014, China;
2. National Power and Energy Storage Battery Product Quality Supervision and Inspection Center, Changxing 313100, China)
Abstract:New challenges to the cathode materials of Li-ion batteries are proposed with the development of electric vehicles (EV). xLi2MnO3·(1-x)LiMnO2composite is one of research focus of cathodes in Li-ion batteries due to their high capacity and environmental benignity. In this work, homogeneous-dispersed 0.4Li2MnO3·0.6LiMnO2composites are fabricated via a two-step hydrothermal method and their structure and electrochemical performance are tested. The results reveal that the discharge capacity can reach to189.4 mAh/g, and remained 10 mAh/g higher than that without a electrochemical treatment after it lasts 30 weeks. The electrochemical treatment can effectively activate Li2MnO3phase and increase the capacity which provides a way to improve the electrochemical performances of composites containing Li2MnO3phase.
Keywords:lithium ion battery; cathode; xLi2MnO3·(1-x)LiMnO2composites; hydrothermal method; electrochemical treatment
文章編號:1006-4303(2015)04-0355-05
中圖分類號:TM911.18
文獻標志碼:A
作者簡介:王連邦(1973—),男,浙江寧海人,教授,博士生導師,研究方向為化學電源和儲能設計,E-mail:wanglb99@zjut.edu.cn.
基金項目:浙江省科技廳重大專項(2012C14027);國家科技支撐計劃項目(2014BAC03B03);湖州市優秀創新團隊項目(2012C70026)
收稿日期:2015-02-13