陽離子膽固醇的合成及其基因傳遞性能研究
王文喜,洪 璐,蔡 婷,鄭海麗,朱 淼,陳麗娜
(浙江工業大學 藥學院,浙江 杭州 310014)
?
陽離子膽固醇的合成及其基因傳遞性能研究
王文喜,洪璐,蔡婷,鄭海麗,朱淼,陳麗娜
(浙江工業大學 藥學院,浙江 杭州 310014)
摘要:采用琥珀酸將N,N-二甲基乙二氨偶聯到膽固醇上,合成新型的陽離子膽固醇衍生物——N-(N′,N′-二甲基)乙基丁二酸單膽固醇酯單酰胺(DC-CHEMS),并考察其作為基因載體的可行性.以DC-CHEMS和磷脂為膜材采用薄膜分散法制備脂質體,透射電鏡顯示其形態規整,粒徑均勻;激光粒度測定儀測得其平均粒徑為136 nm,Zeta電位為25 mV.瓊脂糖凝膠電泳顯示當+/-電荷比大于4∶1時,脂質體能將DNA完全結合,且能保護DNA免受DNase I酶的降解.溶血試驗和MTT細胞毒性試驗結果顯示,所得脂質體具有較低的毒性.細胞攝取和基因轉染實驗表明:所得脂質體能顯著促進HepG2細胞對F-ODN的攝取;當+/-電荷比為1∶1,1∶2時,基因轉染效果強于市售的轉染試劑Lipfectamine?2000.因此,DC-CHEMS作為基因載體,具備了高效低毒的優勢,值得進一步的深入研究.
關鍵詞:陽離子膽固醇衍生物;陽離子脂質體;基因載體
如何安全有效地將外源基因藥物遞送至細胞內是基因治療廣泛應用急需解決的瓶頸問題之一[1-2].非病毒載體因具有低毒、基因攜載率高、免疫原性小和制備方便等優點,越來越受到國內外研究者的青睞[3].其中陽離子脂質體為研究最多且最為成熟的非病毒類載體,已有多種產品上市[4].這些陽離子脂質體主要由陽離子型脂質和膽固醇混合制備而得,由于陽離子脂質價格昂貴,合成工藝復雜,作為藥物載體則不利于市場推廣.為了解決這一問題,近年來有許多學者嘗試在膽固醇上進行修飾,制備各種陽離子型的膽固醇衍生物用作基因載體,也獲得了較高的轉染效率[5-8].與脂肪烴鏈組成的陽離子脂質相比,膽固醇因其剛性、生物降解性及膜融合能力使復合物有更好的穩定性,在真核細胞中表達出更好的轉染效率[9].其中最引人關注的是3β[N-(N,N,-二甲氨基乙烷)-氨甲酰基]膽固醇(DC-Chol),常被用作陽性對照試劑用于基因載體的研究中[10].因此,本實驗通過琥珀酰基將N,N-二甲基乙二胺接到膽固醇上合成一種新的陽離子膽固醇衍生物——N-(N′,N′-二甲基)乙基丁二酸單膽固醇酯單酰胺,將其與磷脂混合制備脂質體,測定其理化性質和生物學性質,并以反義寡核苷酸和綠熒光蛋白質粒DNA為基因藥物模型,考察其作為基因藥物載體的可行性.
1試劑與儀器
1.1試劑
N,N-二甲基乙二胺、N-羥基琥珀酰亞胺購自于阿拉丁試劑(上海)有限公司;二環己基碳二亞胺、膽固醇購自于國藥集團化學試劑有限公司;綠熒光蛋白質粒DNA和FITC-寡核苷酸購自于上海生工技術服務有限公司;磷酸鹽緩沖液(PBS)、胎牛血清、胰酶和DMEM購自于吉諾生物醫藥有限公司;大豆卵磷脂S100購自于德國Lipoid公司;MTT購自于美國Sigma公司;其他試劑均為分析純.
1.2儀器
ANANCEⅢ(500M)核磁共振波普儀(瑞士Bruker公司); SpectraMax M2e多功能酶標儀(美國分子儀器公司);DelsaNano激光粒度測定儀(Beckman公司);J-25型高速冷凍離心機(Beckman公司);JY92超聲細胞粉碎機(寧波新芝科技研究所);311二氧化碳恒溫培養箱(Thermo ELECTRON 公司);FC500MCL流式細胞儀(Beckman公司); REV-52CS旋轉蒸發儀(上海亞榮生化設備儀器有限公司);JEM透射電子顯微鏡(日本電子公司);ECLIPSE-Ti顯微鏡(Nikon公司).
2實驗方法
2.1DC-CHEMS的合成與表征
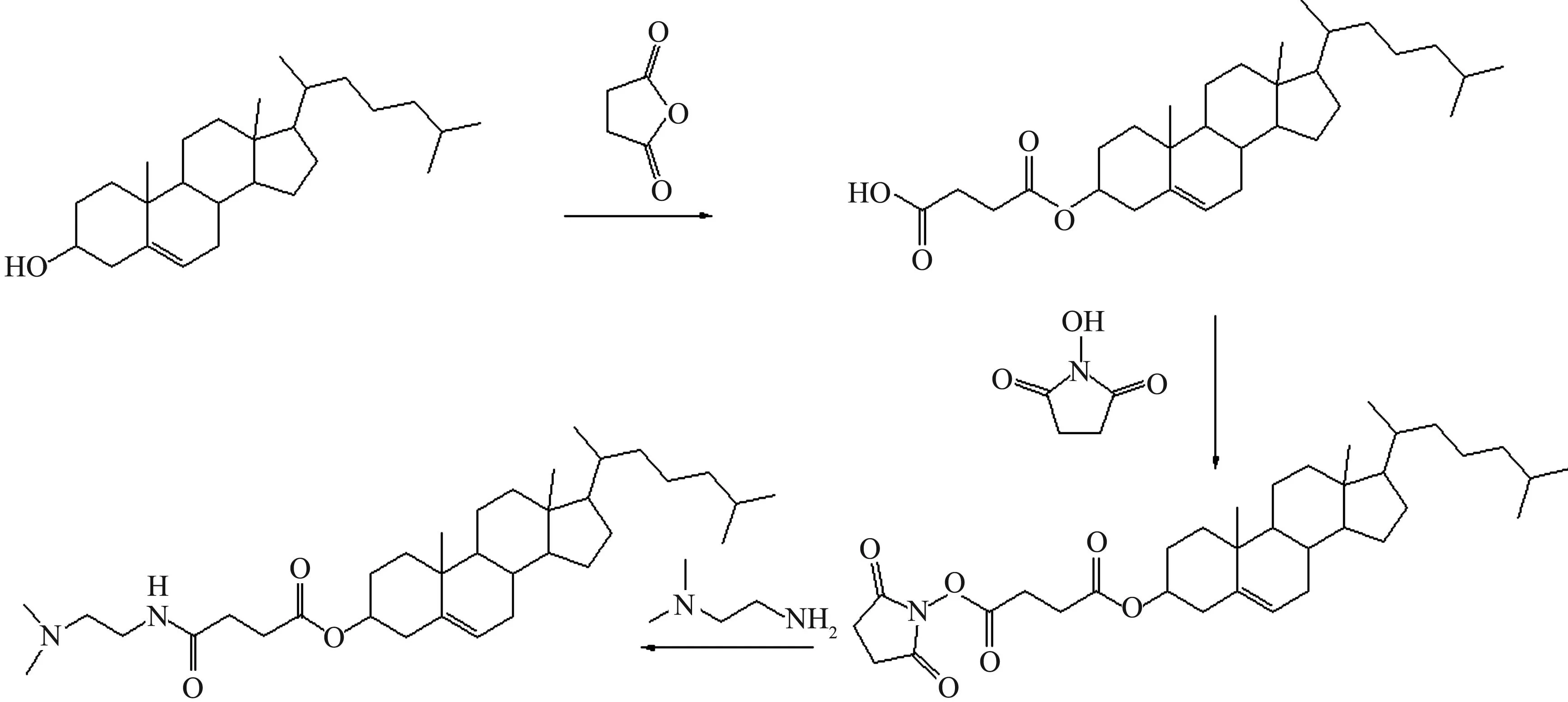
將5 g膽固醇、4 g丁二酸酐、150 mL四氫呋喃和40 mL三乙胺置于圓底燒瓶中,80 ℃回流攪拌48 h.反應結束后,40 ℃旋轉蒸干,所得的固體溶解在60 mL無水乙醇中,加入100 mL蒸餾水快速攪拌,冰水浴析出白色固體,抽濾得粗產物膽固醇琥珀酸單酯(CHEMS).采用丙酮重結晶法純化CHEMS,N-羥基琥珀酰亞胺(NHS)活潑酯法活化CHEMS上的羧基形成活潑酯.0.5 g活潑酯溶于20 mL二氯甲烷中形成溶液A,冰水浴準備.120 μL N,N-二甲基乙二胺溶于10 mL預冷的二氯甲烷中形成溶液B.將溶液B逐滴加入到溶液A中,冰水浴反應1 h.反應結束后,常溫旋干,加3 mL異丙醇溶解固體,冰水浴使初產物析出,所得固體用乙醚純化,真空抽干乙醚,得產物,通過薄層色譜法、核磁共振法和質譜法對該產物進行表征.其合成路線為
2.2DC-CHEMS脂質體的制備與表征
采用薄膜分散法制備脂質體.稱取適量的摩爾比為2∶1的大豆卵磷脂S100和DC-CHMES,溶于10 mL氯仿中,30 ℃真空旋轉蒸干,加5 mL 磷酸緩沖液(PBS)搖晃,待梨型瓶壁上的薄膜消失,再置于37 ℃水浴鍋中水化2 h.探頭超聲200次(超聲功率400 W,工作時間2 s,間歇2 s),得磷脂終質量濃度為10 mg/mL的脂質體[11].
脂質體適當稀釋后,用透射電子顯微鏡觀察其形態,并用納米粒徑儀測定脂質體的粒徑及Zeta電位.
2.3脂質體與質粒DNA結合率以及保護DNA能力的測定
采用瓊脂糖凝膠電泳阻滯實驗來判斷脂質體/質粒DNA復合物的形成情況.配制脂質體5個梯度,控制+/-電荷比分別為1∶1,2∶1,4∶1,8∶1,16∶1.取質粒DNA 10 μL(100 μg/mL)和樣品5 μL 37 ℃孵育0.5 h,以同質量濃度的純質粒DNA作對照組.取15 μL樣品與3 μL 6×DNA電泳加樣緩沖液混勻,將各樣品上樣于0.8%的瓊脂糖凝膠電泳上樣孔中,140 V,20 min,置于紫外燈下觀察,并用凝膠成像系統拍照保存.
采用同樣的方法來考察脂質體保護DNA的能力.配制3個梯度的脂質體,控制+/-電荷比分別為2∶1,4∶1,8∶1.取質粒DNA10 μL和樣品5 μL于37 ℃孵育0.5 h,另取相同量的質粒DNA加5 μL PBS稀釋.每份樣品加5 μL DNaseI酶(2.5 U/μL)置37 ℃恒溫水浴20 min.將樣品轉移到80 ℃水浴中放置5 min滅活DNaseI酶,再加2 μL體積分數為10%的Triton X-100溶液破壞脂質體[12].以同質量濃度的質粒DNA作為對照組.將各樣品上樣于0.8%的瓊脂糖凝膠電泳,140 V,20 min,置于紫外燈下觀察,并用凝膠成像系統拍照保存.
2.4溶血試驗
用生理鹽水配置2%大鼠血紅細胞懸液.按表1配比生理鹽水和脂質體,輕輕混合均勻,置37 ℃水浴鍋中1 h,3 000 r/min離心5 min,取上清液2 mL,加10% Triton X-100溶液0.3 mL破乳.在550 nm下測吸光度.以生理鹽水組離心前加曲拉通樣品為陽性對照,生理鹽水組離心得上清液加Triton X-100樣品為陰性對照,計算溶血百分率為
溶血百分率=(A樣品-A2)/(A1-A2)×100%
式中:A樣品為樣品的吸光度;A2為陰性對照組吸光度;A1為陽性對照組吸光度.

表1 不同質量濃度脂質體溶血試驗
注:1) 為離心前加Triton X-100,其余為離心后加.
2.5細胞毒性
采用溴化四氮唑比色法(MTT Assay)測定陽離子脂質體的細胞毒性[13].取對數生長期的HepG2細胞,接種于96孔板中(5×103個/孔),于37 ℃,5% CO2培養箱中培養過夜.每孔加入150μL DMEM稀釋的空白DC-CHEMS脂質體,其磷脂質量濃度分別為0.01,0.25,0.5,0.1,0.2 mg/mL,每個質量濃度設置6個副孔.置培養箱中培養5 h后,每孔加入20 μL MTT溶液(5 mg/mL),再繼續培養4 h.小心吸棄培養基,每孔加入150 μL二甲基亞砜,平行搖動使甲瓚晶體溶解并測量其在490 nm處的吸光值,計算細胞存活率為
細胞存活率=A490樣品/A490對照×100%
式中:A490樣品為不同磷脂質量濃度樣品的吸光度;A490對照為對照孔的吸光度.
2.6脂質體對F-ODN在HepG2細胞攝取的促進作用
將呈對數生長的HepG2細胞胰酶消化后,以5×103個/孔的密度接種于96孔板中培養過夜.分別按+/-電荷比1∶1,4∶1,8∶1,16∶1制備含熒光標記的寡核苷酸(F-ODN)脂質體復合物.用無血清DMEM培養基稀釋,控制寡核苷酸終質量濃度為1μg/mL,同時設立單用寡核苷酸和Lipofectamine?2000(加入量按說明書上配置)做對照.傾去培養液,每孔加入150 μL脂質體復合物,每個比例設3個副孔.5 h后,吸除上清液,200 μL/孔PBS洗3次,加40 μL胰酶消化2~3 min,加40 μL血清終止消化,離心,收集細胞,經流式細胞儀檢測細胞的陽性染色率以及細胞內平均熒光強度,以兩者的乘積作為胞內熒光總量.每份樣品分析的細胞數為104個.
2.7脂質體的基因轉染效率
將呈對數生長的HepG2細胞胰酶消化后,以5×103個/孔的密度接種于96孔板中培養過夜.分別按+/-電荷比1∶8,1∶4,1∶2,1∶1,4∶1制備帶有綠熒光基因的質粒DNA脂質體.用無血清培養基稀釋,控制質粒DNA質量濃度為1 μg/mL,同時設立單用質粒DNA和Lipofectamine?2000(加入量按說明書上配置)做對照.傾去培養液后,每孔加入150 μL稀釋后的脂質體復合物,每個比例設3個副孔.5 h后,去除培養基,換成質量分數為10%的血清完全培養基培養48 h,用熒光顯微鏡進行熒光拍照.
3結果與討論
3.1DC-CHEMS的表征
圖1(a)為DC-CHEMS的質譜圖,從圖1可看出:在質荷比m/z為557.5[M+H+]處有一個很大的峰,該峰為DC-CHEMS的質子化物.圖1(b)為的DC-CHEMS的1H NMR(CDCl3,500 MHz)譜圖.化學位移δ0.64~1.49,δ4.56~4.59,δ5.35是膽固醇上的特征峰.δ2.67是—N(CH3)2的特征峰,δ2.47是—NHCH2CH2N(CH3)2的特征峰.
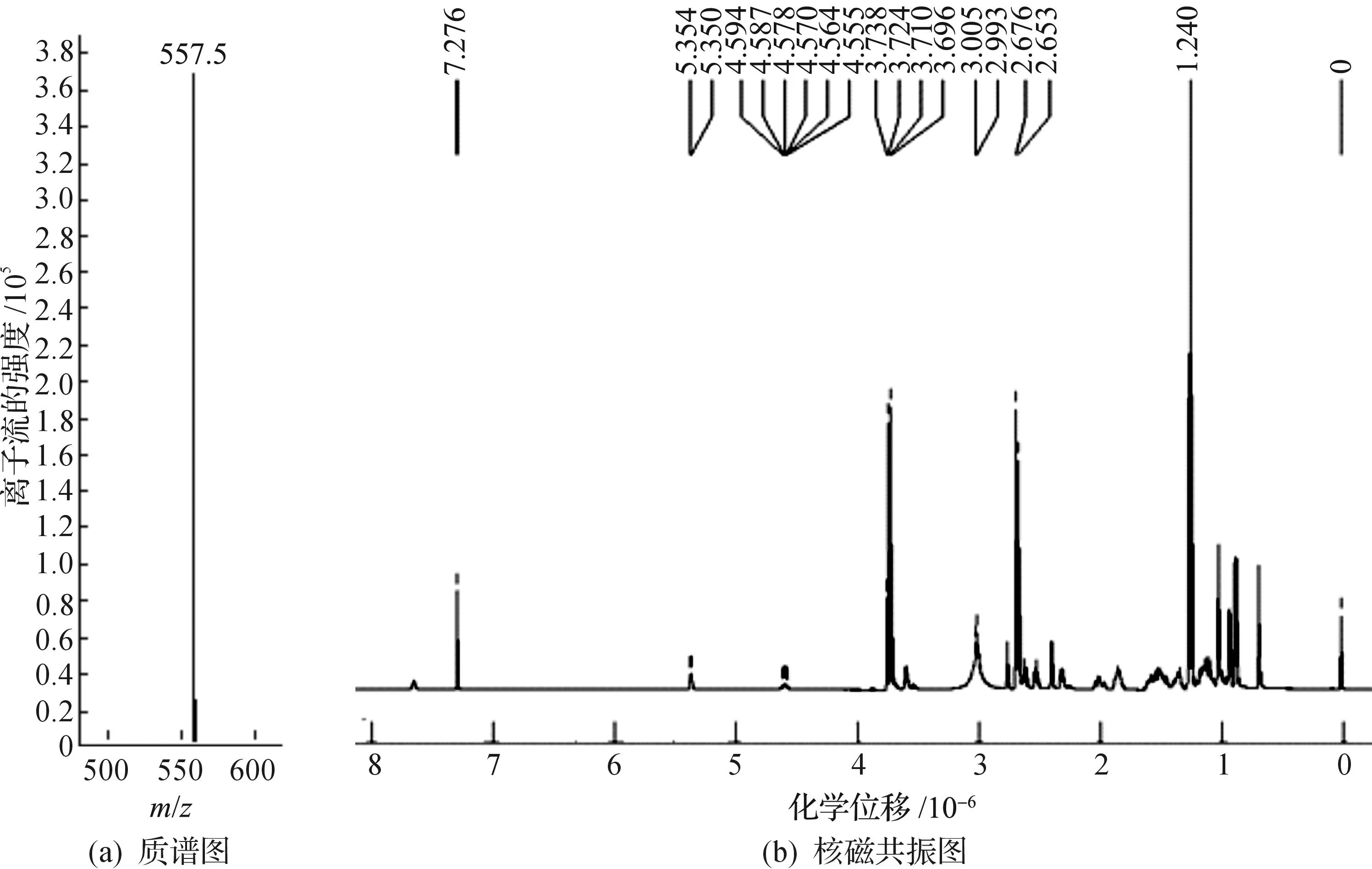
圖1 DC-CHEMS的質譜圖和1H核磁共振圖Fig.1 Mass Spectrometryand 1H NMR spectra of DMAPA-CHEMS
3.2DC-CHEMS脂質體的表征
激光粒度測定儀測定DC-CHEMS脂質體在pH7.2的PBS中的Zeta電位為25.37 mV,為陽離子脂質體.圖2顯示了脂質體粒徑分布情況,從圖2可以看出:脂質體的大小較為均一,呈較好的正態分布,平均直徑為136 nm.圖3是為磷鎢酸負染后脂質體的透射電鏡圖,從圖3可看出:脂質體形態較規整,幾乎都呈圓形,而且顆粒大小較均一,與激光粒度儀所測得的粒徑相近.
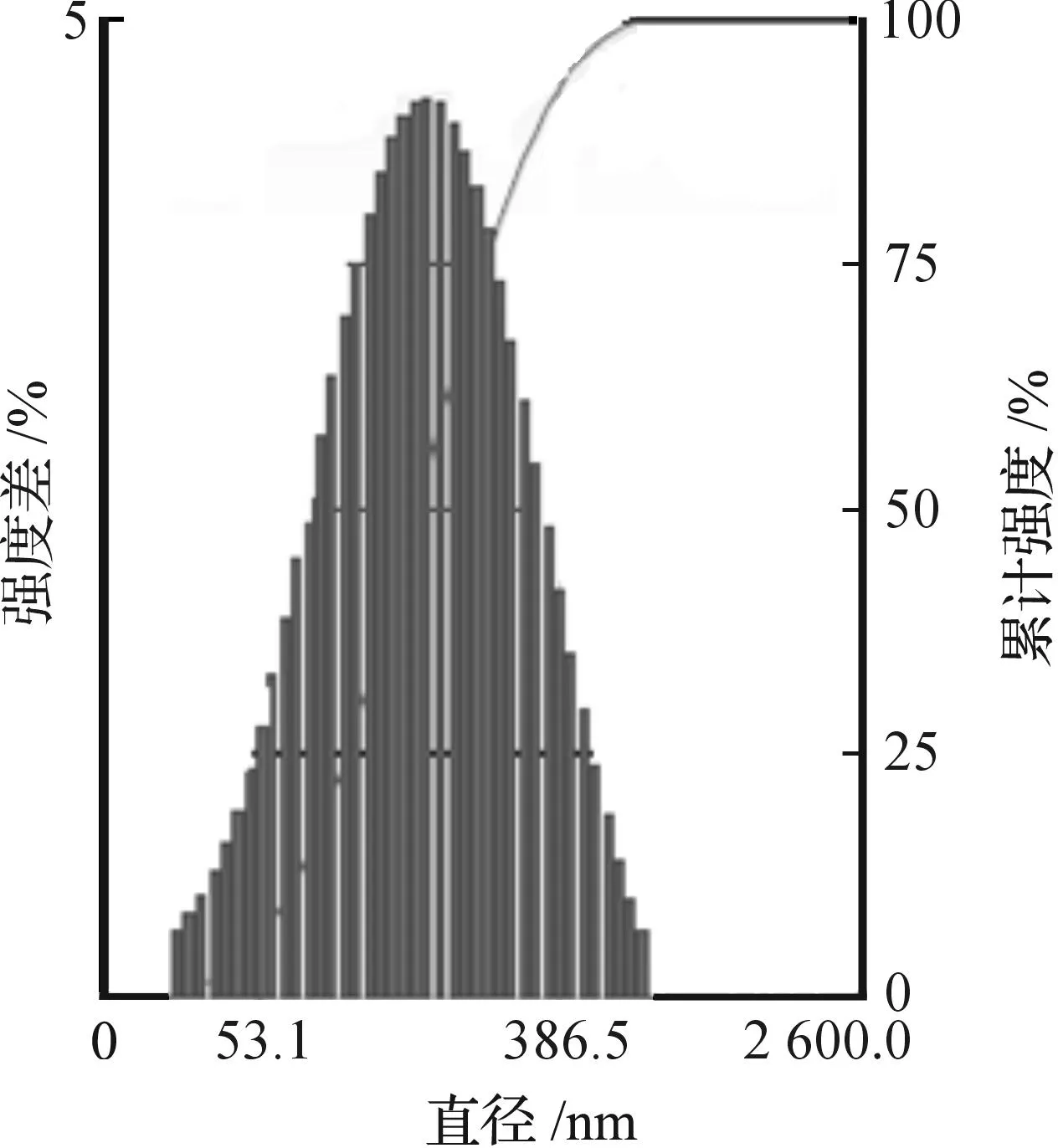
圖2 DC-CHEMS脂質體粒徑分布Fig.2 The size distribution of liposomes

圖3 DC-CHEMS脂質體透射電鏡圖Fig.3 Transmission electron micrograph images of liposomes
3.3脂質體與質粒DNA結合率以及保護DNA能力的測定
DNA脂質體復合物的瓊脂糖凝膠電泳結果如圖4所示,從圖4可看出:當+/-電荷比較低時,只有部分質粒DNA被阻滯在點樣口,隨著+/-電荷比的升高,結合在加樣孔的質粒逐漸增加,加樣孔上方瓊脂糖膠面上的條帶逐漸減弱.當+/-電荷比超過4∶1時,DNA全部被阻滯在加樣孔,膠面上觀察不到亮條帶,說明在+/-電荷比大于4∶1時DC-CHEMS脂質體與質粒DNA能完全結合.

1—純質粒;2~6—分別表示+/-電荷比為16∶1,8∶1,4∶1,2∶1,1∶1圖4 DC-CHEMS脂質體與質粒DNA結合率實驗Fig.4 Agarose gel electrophoresis of DC-CHEMS liposomes/pDNA complexes
為了考察脂質體對DNA的保護作用,將DNA脂質體復合物與DNaseI酶作用20 min,再加曲拉通破壞脂質體,使DNA游離后電泳,結果見圖5.從圖5可看出:游離的質粒DNA與DNaseI酶作用20 min后,已被全部降解,與對照組相同位置處已無條帶,而脂質體復合物組在相應位置處有類似對照組的強量條帶,說明DC-CHEMS脂質體能有效地質粒DNA使其免受DNaseI酶的降解.
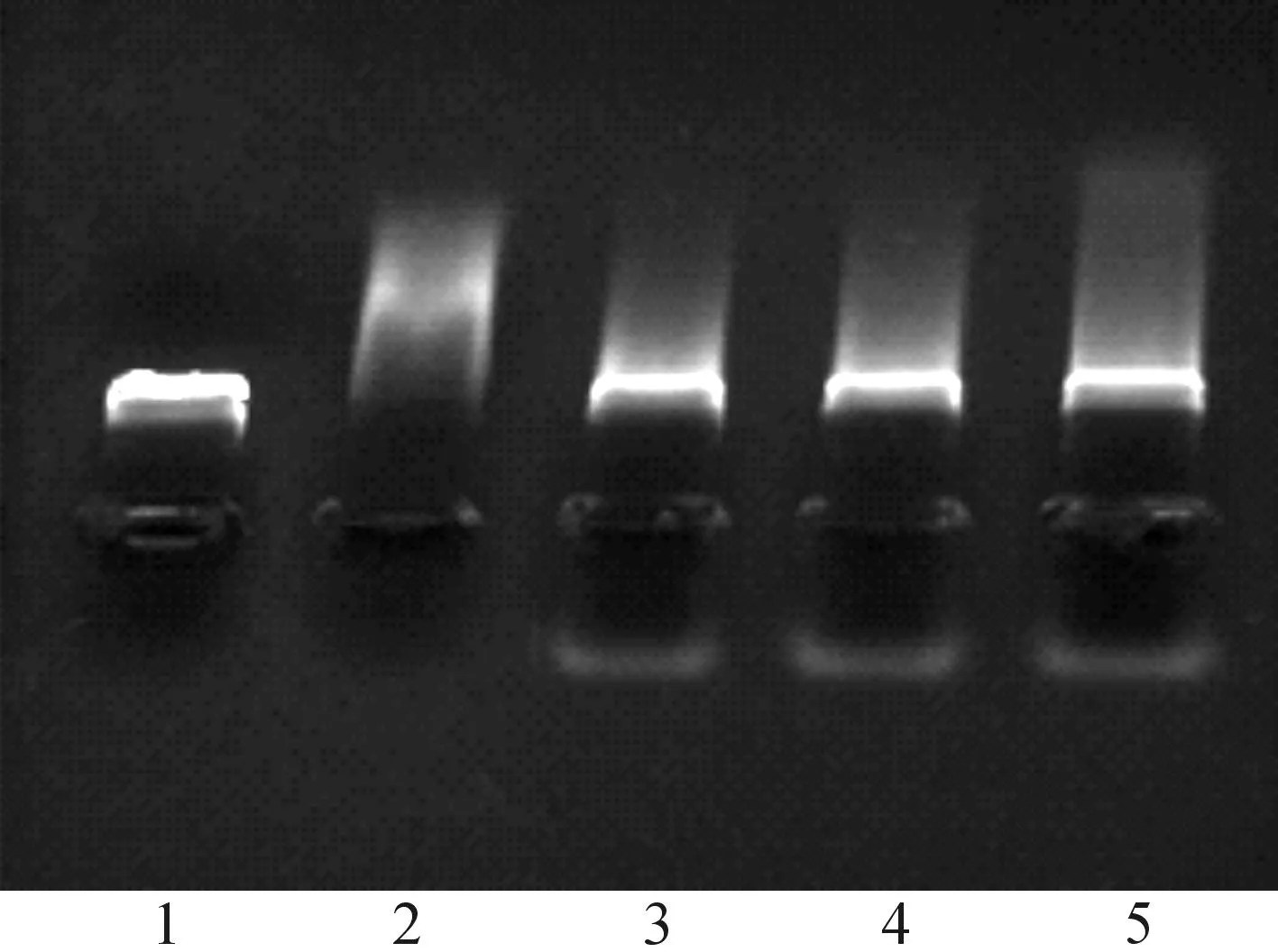
1—純質粒;2—質粒+酶,作用時間20 min;3~5—分別表示+/-電荷比為8∶1,4∶1,2∶1圖5 DC-CHEMS脂質體保護DNA能力Fig.5 pDNA protection from DNase I by DC-CHEMS liposmes
3.4細胞溶血試驗
陽離子型兩親性物質常具有較強的細胞膜破壞作用而呈現較大的毒性[14-15].為此,首先通過測量抗紅細胞破裂實驗來評價DC-CHEMS脂質體的細胞毒性,結果如圖6所示.從圖6可看出:即使當脂質的終質量濃度高達4 mg/mL,脂質體的溶血百分率小于2%.說明所得脂質體沒有溶血作用,細胞毒性較小[16].
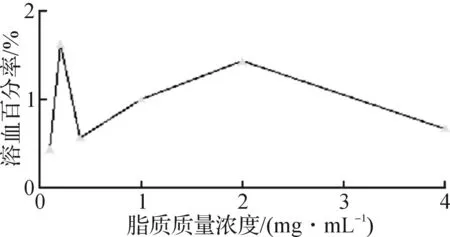
圖6 DC-CHEMS脂質體的溶血性能Fig.6 Hemolytic activity of DC-CHEMS liposomes
3.5細胞毒性評價
采用MTT法測得各種質量濃度脂質體對HepG2細胞的毒性結果如圖7所示,在磷脂質量濃度小于0.2 mg/mL時,HepG2細胞存活率幾乎都為100%,說明DC-CHEMS具有很低的細胞毒性.因此,在攝取與轉染實驗中,將磷脂質量濃度控制在這一范圍之內即可.
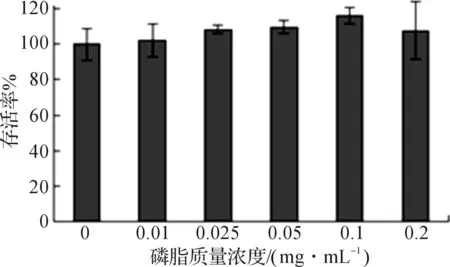
圖7 DC-CHEMS脂質體的細胞毒性Fig.7 Cell toxicity of DC-CHEMS liposomes
3.6脂質體對F-ODN在HepG2細胞攝取的促進作用
HepG2細胞與F-ODN脂質體復合物共同孵育5 h后,收集3個平行孔細胞合成1管,用流式細胞儀測定帶熒光的陽性細胞率和胞內平均熒光強度,將兩者的乘積作為細胞內熒光總量,考察脂質體用量對細胞內熒光總量的影響,如圖8所示.結果發現:DC-CHEMS脂質體各質量濃度組的胞內熒光總量遠高于市售轉染試劑Lipofectamine?2000對照組,+/-電荷比為1∶1的F-ODN脂質體復合物組的熒光總量為Lipofectamine?2000對照組的3倍多.
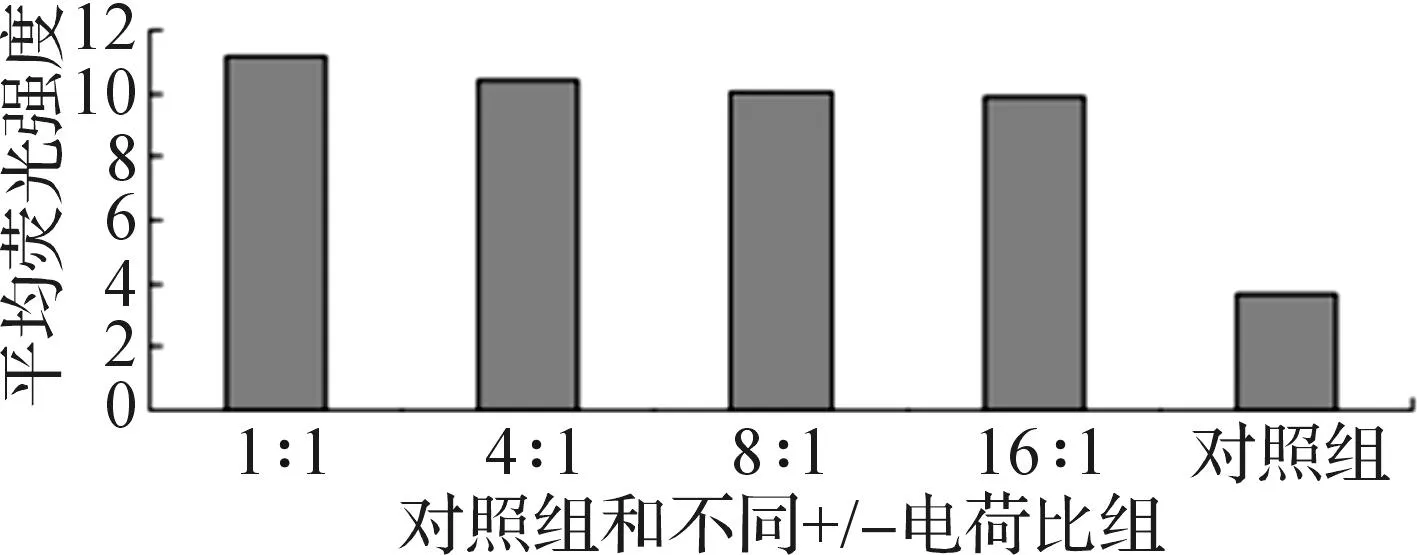
圖8 DC-CHEMS脂質體細胞攝取Fig.8 Cells uptake of DC-CHEMS liposomes
3.7脂質體的轉染效果
進入細胞只是基因藥物要發揮作用的第一步,入胞后的命運及細胞內的分布對基因轉染至關重要.因此,一個良好的基因載體不僅能促進基因的入胞,更重要的是能有效地控制基因在細胞內的釋放和轉運[17-18].為了評價DC-CHEMS所制脂質體作為基因載體的可行性,采用綠熒光蛋白質粒DNA為報告基因,考察其轉染效果.結果發現,在缺乏DOPE等輔助磷脂的情況下,雖然DC-CHEMS脂質體的細胞攝取較好,但基因轉染效率較低,與Koynova等研究結果類似[19].將磷脂換成DOPE后制備DC-CHEMS脂質體,結果發現轉染效率顯著提高,各種電荷比DC-CHEMS脂質體表現出的轉染活性要高于DC-Chol脂質體對照組,如圖9所示.從圖9中可看出:當脂質體的質量濃度較低時(+/-電荷比1∶8),細胞內的熒光強度較弱,隨著脂質體質量濃度的增加,細胞內的熒光強度顯著增加.當+/-電荷比為1∶2和1∶1時,DC-CHEMS脂質體組表現了很高的轉染效率,細胞內的熒光強度超過了Lipfectamine?2000對照組.繼續增加脂質體的量,其轉染效率反而下降,這可能是由于內吞飽和所致.當脂質體過多時,有一部分復合物沒有機會與細胞作用,使得這部分復合物上的質粒DNA或寡核苷酸不能進入到細胞.

圖9 脂質體復合物的細胞轉染Fig.9 Transfection efficiency of GFP-pDNA complexed with liposomes
4結論
采用N-羥基琥珀酰亞胺活化膽固醇琥珀酸單酯能將N,N-二甲基乙二胺接到膽固醇上合成一種新的陽離子膽固醇衍生物——DC-CHEMS,將其和磷脂混合可制得性能良好的陽離子脂質體.該陽離子脂質體具有較低的溶血性和細胞毒性,對DNA有很強的包裹能力并能保護DNA免受核酸酶的降解,能顯著地促進DNA的入胞,提高基因轉染效率,基因轉染效率可高于含酯酰基DC-CHOL脂質體和市售基因轉染試劑Lipfectamine?2000,故為一個極有發展前途的非病毒類基因載體.
參考文獻:
[1]SHIRAZI R S, EWERT K K, LEAL C,et al.Synthesis and characterization of degradable multivalent cationic lipids with disulfide-bond spacers for gene delivery[J].Biochimica et Biophysica Acta, 2011, 1808(9):2156-2166.
[2]王文喜,代凱,唐嵐.八聚精氨酸修飾的載ASODN脂質體的構建及體外評價[J].浙江工業大學學報,2014,42(3):334-337.
[3]SHIM G, KIM M, PARK J Y, et al.Application of cationic liposomes for delivery of nucleic acids[J].Asian journal of pharmaceutical sciences, 2013, 8(2):72-80.
[4]RADCHATAWEDCHAKOON W, WATANAPOKASIN R, KRAJARNG A, et al.Solid phase synthesis of novel asymmetric hydrophilic head cholesterol-based cationic lipids with potential DNA delivery[J].Bioorganic & Medicinal Chemistry, 2010, 18(1):330-342.
[5]SINGHM,BORAINJ,NOOR-MAHOMEDN,etal.Theeffectofpegylationonthetransfectionactivityoftwohomologouscationiccholesterylcytofectins[J].AfricanJournalofBiotechnology, 2011, 10(8):1400-1407.
[6]DORASAMYS,NARAINPERSADN,SINGHM,etal.Noveltargetedliposomesdeliversirnatohepatocellularcarcinomacellsinvitro[J].ChemicalBiology&DrugDesign, 2012, 80(5):647-656.
[7]NARAINPERSADN,SINGHM,ARIATTIM.Novelneoglycolipid:formulationintopegylatedcationicliposomesandtargetingofDNAlipoplexestothehepatocyte-derivedcelllineHepG2[J].NucleosidesNucleotidesNucleicAcids, 2012, 31(3):206-223.
[8]SEWBALASA,ISLAMRU,ARBUTHNOTP,etal.EnhancementoftransfectionactivityinHEK293cellsbylipoplexescontainingcholesterylnitrogen-pivotedaza-crownethers[J].MedicinalChemistryResearch, 2013, 22(6):2561-2569.
[9]LIL,NIEY,ZHUR,etal.Preparationandgenedeliveryofalkalineaminoacids-basedcationicliposomes[J].ArchivesofPharmacalResearch,2008,31(7):924-931.
[10]KEARNSMD,PATELYN,SAVVAM.Physicochemicalcharacteristicsassociatedwithtransfectionofcationiccholesterol-basedgenedeliveryvectorsinthepresenceofDOPE[J].ChemistryandPhysicsofLipids, 2010, 163(8):755-764.
[11]程序,宋必衛,張春麗,等.含氣脂質體的超聲波介導體外基因輸送的實驗研究[J].浙江工業大學學報,2010,38(5):503-507.
[12]YUB,TANGC,YINC.Enhancedantitumorefficacyoffolatemodifiedamphiphilicnanoparticlesthroughco-deliveryofchemotherapeuticdrugsandgenes[J].Biomaterials, 2014, 35(24):6369-6378.
[13]唐嵐,趙亞,單海峰,等.甜瓜蒂中葫蘆素類成分分離及體外抗癌活性研究[J].浙江工業大學學報,2012,40(4):388-391.
[14]PAECHAROENCHAIO,NIYOMTHAMN,LEKSANTIKULL,etal.Nonionicsurfactantvesiclescomposedofnovespermine-derivativecationiclipidsasaneffectivegenecarrierinvitro[J].AmericanAssociationofPharmaceuticalScientists, 2014, 15(3):722-730.
[15]NIEY,JIL,DINGH,etal.Cholesterolderivativesbasedchargedliposomesfordoxorubicindelivery:preparation,invitroandinvivocharacterization[J].Theranostics, 2012, 2(11):1092-1103.
[16]PAECHAROENCHAIO,NIYOMTHAMN,LEKSANTIKULL,etal.Nonionicsurfactantvesiclescomposedofnovelspermine-derivativecationiclipidsasaneffectivegenecarrierinvitro[J].AmericanAssociationofPharmaceuticalScientists,2014,15(3):722-730.
[17]SUNXY,WEILL,CHENHL,etal.Advancesinthestudyoforganellestargetingnanocarriers[J].ActaPharmacologicaSinica, 2009, 44(8):838-844.
[18]DOMINSKAM,DYKXHOORNDM.Breakingdownthebarriers:SiRNAdeliveryandendosomeescape[J].JournalofCellScience, 2010, 123(8):1183-1189.
[19]KOYNOVAR,TENCHOVB.Cationiclipids:molecularstructure/transfectionactivityrelationshipsandinteractionswithbiomembranes.[J].TopicsinCurrentChemistry, 2010, 296:51-93, 2010, 296:51-93.
(責任編輯:陳石平)
Synthesis and characterization of a novel cationic
cholesterol derivatives for gene delivery
WANG Wenxi, HONG Lu, CAI Ting, ZHENG Haili, ZHU Miao, CHEN Lina
(College of Pharmaceutical Science,Zhejiang University of Technology,Hangzhou 310014,China)
Abstract:To synthesis and evaluate the feasibility as a gene carrier of a novel cationic cholesterol derivative , N,N-dimethylethylenediaminyl succinyl cholesterol (DC-CHEMS), which N,N-Dimethyl-1,2-ethanediamine was coupled to cholesterol by Succinate. The liposome was made of DC-CHEMS and phosphatide by film dispersion method, which showed sphere and uniform morphology under transmission electron microscopy( TEM). The size of liposome was 136 nm and Zeta potential was 25 mV determined by a laser particulate size analyser. Agarose gel electrophoresis demonstrated that the liposome could condense and protect plasmid DNA completely when the +/- charge ratio was more than 4∶1.The results of hemolysis test and MTT test showed that liposome was low toxic. Cellular uptake and gene transfeciton experiments showed that the liposome could enhance the uptake of F-ODN in HepG2 cells significantly ; when +/-charge ratio was 1∶1 or 1∶2, the gene transfection efficiency was stronger than the commercially available transfection reagent Lipfectamine?2000.Therefore, DC-CHEMS has the advantage of high efficiency and low toxicity as a gene carrier and is worthy of further research.
Keywords:cationic cholesterol derivatives ; cationic liposomes; gene carrier
文章編號:1006-4303(2015)04-0383-06
中圖分類號:R944
文獻標志碼:A
作者簡介:王文喜(1977—),男,浙江蒼南人,副教授,博士,碩士生導師,主要從事新型給藥系統研究,E-mail:yjw@zjut.edu.cn.
基金項目:國家自然科學基金資助項目(81102396)
收稿日期:2015-01-30