肢體缺血預處理對大鼠腦缺血后海馬的保護作用機制研究進展
梁辰,初海平,王福文
(1山東省醫(yī)學科學院藥物研究所,濟南 250062;2濟南大學 山東省醫(yī)學科學院醫(yī)學與生命科學學院;3山東省罕少見病重點實驗室)
?
肢體缺血預處理對大鼠腦缺血后海馬的保護作用機制研究進展
梁辰1,2,初海平1,3,王福文1,3
(1山東省醫(yī)學科學院藥物研究所,濟南 250062;2濟南大學 山東省醫(yī)學科學院醫(yī)學與生命科學學院;3山東省罕少見病重點實驗室)
摘要:缺血性腦血管疾病時海馬損傷最為嚴重,肢體缺血預處理(LIP)可以積極地緩解腦缺血引起的海馬損傷,主要通過抑制自由基毒性、抑制炎癥反應、介導信號傳導通路、誘導基因表達等機制發(fā)揮保護作用,亦能通過促進熱休克蛋白Hsp70表達和干細胞的增殖,以及激活阿片受體和線粒體ATP敏感性鉀通道減輕海馬損傷。
關鍵詞:肢體缺血預處理;缺血性腦血管疾病;腦缺血;海馬損傷
目前,缺血性腦血管病的發(fā)病率不斷升高,其中海馬損傷最為嚴重,迅速恢復腦血流量是其首要的治療措施。然而大量研究表明,缺血后再灌注可加重缺血組織或器官損傷。因此,臨床上如何防止缺血再灌注損傷是目前亟待解決的問題。Kitagawa等[1]發(fā)現,對沙鼠腦缺血模型進行腦缺血預處理(CIP)可對缺血5 min的海馬CA1區(qū)椎體神經元起到明顯的保護作用。與此類似的許多其他同一器官的缺血預處理也證實具有良好的預防效果。然而這種方法也存在一些弊端,如預處理程度難掌控、操作復雜等。遠隔器官的缺血預處理就是對缺血損傷的主要器官以外的器官進行程度較小的缺血/再灌注處理,這種使用非重要生命器官預缺血處理對抗心、腦等重要器官缺血再灌注損傷的方法[2]為臨床治療疾病提供了新的方法和思路。有文獻報道,肢體、小腸以及腎臟等遠隔器官的短暫缺血等均對缺血后腦海馬區(qū)椎體神經元有保護作用。肢體缺血預處理(LIP)通過對肢體的周期性缺血/再灌注的方法間接治療或減輕腦損傷,尤其對海馬區(qū)神經纖維具有良好的保護作用[3],但其機制尚不清楚,研究較多的有抑制自由基毒性、抑制炎癥反應、介導信號傳導通路等。現就LIP對大鼠腦缺血后海馬的保護作用機制研究進展進行綜述。
1抑制自由基毒性
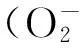
2抑制炎癥反應
腦缺血/再灌注時伴隨著局部過度炎癥反應,是造成海馬區(qū)損傷的主要原因之一,許多炎癥細胞和炎癥介質參與了炎癥反應。炎癥細胞包括白細胞、小膠質細胞和星形膠質細胞,其中白細胞是造成神經損傷的主要炎癥細胞。以往的研究表明,腦缺血后,白細胞黏附在腦血管壁上會加劇腦水腫的形成[8],白細胞的積累還會刺激氧自由基和蛋白水解酶的釋放[9,10],同時腦缺血再灌注后,浸潤的炎癥細胞會產生大量的炎癥介質細胞因子、趨化因子和黏附分子等,進而促進白細胞黏附并浸潤內皮細胞,進一步加重海馬區(qū)神經元損傷。Yannopoulos等[11]研究發(fā)現,對豬雙前肢缺血預處理后,能夠提高線粒體還原型輔酶Ⅰ(NADH)含量,增強線粒體呼吸鏈功能,明顯減少白細胞數目。炎癥反應可以激活血管內皮細胞、血小板、免疫細胞釋放大量細胞因子IL、THF-α等。這些細胞因子又反過來促進了炎癥反應,增加興奮性氨基酸、NO、氧自由基的釋放等加重海馬損傷。IL-6參與機體免疫應答和炎癥反應,其含量迅速增高可加劇神經元、膠質細胞及內皮因子損傷,是衡量海馬損傷程度的一個重要標志。Wang等[12]研究表明,LIP后MCAO的SD大鼠較單純MCAO大鼠海馬CA1區(qū)IL-6和IL-17表達水平顯著減少,提示抗炎作用可以減少海馬區(qū)神經細胞凋亡。
3介導信號傳導通路
絲裂原活化蛋白激酶(MAPK)是一組能被不同的細胞外刺激(細胞因子、神經遞質、激素、細胞應激及細胞黏附等)激活的絲氨酸-蘇氨酸蛋白激酶,可調節(jié)包括新陳代謝、細胞活力、細胞炎癥、細胞的壞死和凋亡等一系列的細胞活動。Zhao[13]研究發(fā)現,早期的缺血預處理可以保護心肌和腦急性缺血再灌注引起的損傷,其保護機制與MAPK有關。細胞外信號調節(jié)激酶(ERK1/2)是MAPK家族的重要成員,參與海馬區(qū)神經細胞的凋亡過程,但其作用說法不一,Ansar等[14]研究發(fā)現ERK1/2抑制劑能夠降低血管緊張素Ⅱ(AngⅡ)和血栓素(TP)的含量,抵抗由腦缺血引起的血管收縮,進而防止神經損傷。姜紅升等[15]使用Western blotting法檢測不同時長腦缺血再灌注大鼠海馬CA1區(qū)ERK1/2含量,結果表明,各時間點LIP組ERK1/2水平均高于腦缺血/再灌注組,同時焦油紫染色結果顯示,LIP組海馬CA1區(qū)神經元數量較腦缺血/再灌注組明顯增加,而給予ERK1/2上游激酶抑制劑PD98059后,神經元數量較LIP組大幅下降,這表明LIP可通過激活ERK1/2通路減輕大鼠海馬CA1區(qū)缺血性神經元損傷。但Maddahi等[16]研究表明,ERK1/2通過上調TNF-α、IL-1β、IL-6等炎癥因子擴大炎癥反應,加重缺血區(qū)神經損傷。
磷脂酰肌醇激酶-3/絲蘇氨酸蛋白激酶(PI3K/AKT)信號轉導通路是膜受體信號向細胞內轉導的重要途徑,在心臟、腎臟、肝臟等多種器官缺血再灌注損傷中發(fā)揮抑制細胞凋亡作用。PI3K通過3-磷酸肌醇依賴性蛋白激酶1(PDK1)磷酸化AKT使其活性增強,影響下游凋亡相關蛋白如GSK-3β、BAD、FKHR、CaMKⅡ等,發(fā)揮抗凋亡的作用[17]。Peng等[18]研究表明,LIP通過PI3K/AKT信號轉導途徑上調eNOS減輕海馬CA1區(qū)神經損傷,eNOS抑制劑N(ω)-硝基-L-精氨酸甲酯能顯著廢除LIP的神經保護作用,而PI3K的高度選擇性抑制劑LY294002不僅能顯著逆轉LIP的神經保護作用,也能明顯抑制LIP誘導的eNOS上調。JAK/STAT是近年來新發(fā)現的一條細胞內信號轉導途徑。該信號轉導途徑參與中樞神經系統的發(fā)育以及神經細胞的增殖、生存、分化過程,并與腦腫瘤、腦缺血等中樞神經系統疾病的病理生理過程密切相關。腦缺血后,STAT3過度活化能促進神經細胞死亡,加重腦損傷。Cheng等[19]研究表明,LIP可以通過下調STAT3減少TNF-α和核轉錄因子κB(NF-κB)的表達減輕海馬損傷。
4誘導基因表達
腦缺血可誘導某些基因的表達,這些基因的表達可能有助于缺血后神經元損傷的恢復。LIP可增加這些基因的表達, 減輕腦缺血再灌注損傷。原癌基因c-fos是一種即刻早期基因(IEGs),其蛋白產物Fos蛋白常被用作神經元功能活動的標記物。CIP可促進c-fos的表達[20]。海馬CA1區(qū)c-fos表達弱且延遲,甚至出現只有c-fos的mRNA,但無Fos蛋白翻譯的情況,提示c-fos早期表達對促進缺血后細胞的存活具有重要作用,LIP可增強損傷性腦缺血后c-fos在海馬CA1區(qū)的表達[21]。
有研究[22]表明,p63基因的表達對腦缺血后神經損傷有保護作用,可能參與腦缺血后神經細胞損傷的凋亡過程。Lee等[23]研究發(fā)現,腦缺血處理后,海馬CA1區(qū)椎體神經元p63表達明顯高于假手術組,提示p63可能是調控腦缺血后神經元死亡的關鍵基因。廖常莉等[24]使用免疫組化法分析表明,LIP處理后的大鼠海馬CA1區(qū)p63基因表達低于缺血/再灌注組,且HE染色結果顯示LIP處理后神經凋亡減弱,表明LIP對海馬區(qū)神經元的保護作用可能與下調p63基因的表達有關。
5促進Hsp70蛋白表達
Hsp是在缺血、缺氧等應激因素作用下,機體大量合成的一組蛋白,與缺血性腦損傷等多種神經系統疾病關系密切,按其相對分子質量大小主要分為Hsp27、Hsp70、Hsp90等,其中Hsp70家族研究最為廣泛。Hsp70作為腦缺血誘導產生的一種神經元保護性物質,可阻止蛋白質在壓力下發(fā)生聚集或錯誤的折疊,被認為與缺血性腦損傷的修復密切相關,是預示受損神經元能夠存活的一個敏感指標。Sun等[25]研究表明,Hsp70參與腦缺血后海馬CA1區(qū)椎體神經元的保護作用。Sun等[26]使用Western blotting和免疫組化檢測LIP處理后的大鼠,發(fā)現海馬CA1區(qū)Hsp70蓄積增多,腹腔注射Hsp抑制劑SB 203580后,LIP對海馬CA1區(qū)腦損傷的保護作用減弱。以上研究表明,Hsp70作為一種內源性保護蛋白,參與LIP誘導腦缺血耐受的產生,腦缺血后海馬區(qū)神經細胞的最終死亡可能與Hsp70合成障礙有關,Hsp70的表達上調是LIP誘導缺血耐受的重要分子機制之一。
6促進神經干細胞(NSC)增殖
NSC是中樞神經系統中可以增殖、遷移、分化成神經元和膠質細胞的一類具有代償功能的細胞,人腦海馬的齒狀回是NSC的主要存在部位。巢蛋白(Nestin)的表達伴隨NSC分裂分化的始終,隨著神經分化完成而終止,為NSC的特征性標志物。這是因為Nestin是一種中間絲類型的蛋白,能夠在NSC特異性表達,因此可以通過檢測Nestin的含量評價神經損傷的治療效果[27]。張永輝等[28]采用免疫組化法檢測LIP后的大鼠海馬中心區(qū)冠狀腦切片,發(fā)現其Nestin陽性細胞明顯多于假手術組,表明較輕程度遠隔肢體缺血能引起NSC增殖,從而提高腦梗死后的局部應激能力,加速腦內NSC的增殖,保護腦組織損傷。
7激活阿片受體和線粒體ATP敏感性鉀通道
阿片受體廣泛分布于腦、脊髓、外周感覺神經元及外周自主神經元,在海馬區(qū)分布也相當廣泛,阿片受體同樣分布在上下肢等其他遠隔器官,LIP對海馬區(qū)神經細胞的保護作用可能與介導阿片受體有關。2011年,Zhou等[29]研究表明,阿片受體拮抗劑納洛酮削弱了LIP后腦梗死面積減少的保護作用,另外,Akt信號通路被渥曼青霉素阻斷后同樣抑制該保護作用,由此得出結論,LIP可以通過激活阿片受體和Akt信號通路來保護腦缺血造成的神經損傷。許多研究[30]證實,線粒體ATP敏感性鉀通道(mito KATP)參與了κ-阿片受體介導的心肌保護作用。mito KATP在缺血預處理中的作用已得到肯定,在神經元的缺血/再灌注損傷中具有非常重要的地位。研究[31]表明,mito KATP阻斷劑5-HD能消除LIP的神經保護作用。Sun等[32]對大鼠雙側股動脈閉塞/再灌注5個周期后發(fā)現,大鼠腦梗死面積明顯減少,海馬區(qū)神經細胞損傷減弱,而使用mito KATP拮抗劑后該保護作用明顯減弱。以上研究表明,LIP可以通過增強mito KATP活性保護海馬區(qū)神經細胞。
LIP能夠通過抑制自由基毒性、抑制炎癥反應、介導信號傳導通路、誘導基因表達等機制發(fā)揮保護作用,亦能通過促進熱休克蛋白Hsp70表達和干細胞的增殖,以及激活阿片受體和線粒體ATP敏感性鉀通道減輕海馬損傷。LIP通過腦缺血耐受而調動內源性保護機制,延長缺血性腦血管病的治療時間窗,進而防治缺血性腦血管病,其具體病理生理機制尚在研究中,許多內源性神經保護因子或介質參與缺血預處理的細胞保護作用,其中與早期保護有關的物質包括乙酰膽堿、兒茶酚胺、AngⅡ、緩激肽、阿片肽等,與延遲保護有關的有腺苷、氧自由基和NO等,即刻早期基因在LIP也發(fā)揮重要的作用以及其他機制[33,34]等。LIP實施方便,方法簡單,對人體的損傷微小,具有很高的臨床應用價值。此外,LIP配合藥物治療效果會大大增加,Burda等[35]研究表明,注射紅藻氨酸后大鼠海馬CA1區(qū)神經元存活數量由單純LIP的15.87%上升為42.8%。因此,藥物聯合治療缺血性腦血管疾病將成為未來發(fā)展的方向。
參考文獻:
[1] Kitagawa K, Matsumoto M, Tagaya M, et al. Ischemic tolerance phenomenon found in the brain[J]. Brain Res, 1990,528(1):21-24.
[2] Vainer BG, Markel AL. Systemic vascular response to brachial arteries crossclamping may prognosticate the outcome of remote ischemic preconditioning[J]. Med Hypotheses, 2015,84(4):298-300.
[3] Xu J, Sun S, Lu X, et al. Remote ischemic pre- and postconditioning improve postresuscitation myocardial and cerebral function in a rat model of cardiac arrest and resuscitation[J]. Crit Care Med, 2015,43(1):12-18.
[4] Yuan HJ, Zhu XH, Luo Q, et al. noninvasive delayed limb ischemic preconditioning in rats increases antioxidant activities in cerebral tissue during severe ischemia- reperfusion injury[J]. J Surg Res, 2012,174(1):176-183.
[5] Narasimhan P, Sugawara T, Liu J, et al. Overexpression of human copperzinc superoxide dismutase in transgenic animals attenuates the reduction of apurinicapyrimidinic endonuclease expression in neurons after in vitro ischemia and after transient global cerebral ischemia[J]. J Neurochem, 2005,93(2):351-358.
[6] Takhtfooladi HA, Takhtfooladi MA, Karimi P, et al. Influence of tramadol on ischemia-reperfusion injury of rats′ skeletal muscle[J]. Int J Surg, 2014,12(9):963-968.
[7] Chen G, Yang J, Lu G, et al. Limb remote ischemic post- conditioning reduces brain reperfusion injury by reversing eNOS uncoupling[J]. Indian J Exp Biol, 2014,52(6):597-605.
[8] Shiga Y, Onodera H, Kogure K, et al. Neutrophil as a mediator of ischemic edema formation in the brain[J]. Neurosci Lett, 1991,125(2):110-112.
[9] Justicia C, Panés J, Solé S, et al. Neutrophil infiltration increases matrix metalloproteinase-9 in the ischemic brain after occlusion/reperfusion of themiddle cerebral artery in rats[J]. J Cereb Blood Flow Metab, 2003,23(12):1430-1440.
[10] Chou WH, Choi DS, Zhang H, et al. Neutrophil protein kinase Cdelta as a mediator of stroke-reperfusion injury[J]. J Clin Invest, 2004,114(1):49-56.
[11] Yannopoulos FS, Arvola O, Haapanen H, et al. Leg ischaemia before circulatory arrest alters brain leucocyte count and respiratory chain redox state[J]. Interact Cardiovasc Thorac Surg, 2014,18(3):272-277.
[12] Wang W, Yu XD, Mo X, et al. Limb ischemic preconditioning attenuates cerebral ischemic injury in rat model[J]. Perfusion, 2014,29(3):210-218.
[13] Zhao H. Ischemic postconditioning as a novel avenue to protect against brain injury after stroke[J]. J Cereb Blood Flow Metab, 2009,29(5):873-885.
[14] Ansar S, Eftekhari S, Waldsee R, et al. MAPK signaling pathway regulates cerebrovascular receptor expression in human cerebral arteries[J]. BMC Neurosci, 2013,14:12.
[15] 姜紅升,涂悅,程世翔,等.肢體缺血后處理通過激活MAPK途徑保護大鼠海馬區(qū)缺血性神經元[J].解剖科學進展,2011,17(1):4-7.
[16] Maddahi A, Edvinsson L. Cerebral ischemia induces microvascular pro-inflammatory cytokine expression via the mek/erk pathway[J]. J Neuroinflammation, 2010,7:14.
[17] Bassili M, Birman E, Schor NF, et al. Differential roles of Trk and p75 neurotrophin receptors in tumorigenesis and chemoresistance exvivo and invivo[J]. Cancer Chemother Pharmacol, 2010,65(6):1047-1056.
[18] Peng B, Guo QL, He ZJ, et al. Remote ischemic postconditioning protects the brain from global cerebral ischemia/reperfusion injury by up-regulating endothelial nitric oxide synthase through the pi3k/akt pathway[J]. Brain Res, 2012,1445:92-102.
[19] Cheng Z, Li L, Mo X, et al. Non-invasive remote limb ischemic postconditioning protects rats against focal cerebral ischemia by upregulating STAT3 and reducing apoptosis[J]. Int J Mol Med, 2014,34(4):957-966.
[20] Jovanovic AA, Babovic SS, Damjanovic A, et al. The role of c-fos protein, somatostatin and neuropeptide Y in the pathogenesis of ischemic brain injuries based on animal model of cerebral ischemia[J]. Coll Antropol, 2013,37(3):847-852.
[21] 趙紅崗,李文斌,孫曉彩,等.c-fos在肢體缺血預處理抗腦缺血再灌注損傷中的作用[J].中華老年心腦血管病雜志,2006,8(11):772-775.
[22] Bui T, Sequeira J, Wen TC, et al. ZEB1 links p63 and p73 in a novel neuronal survival pathway rapidly induced in response to cortical ischemia[J]. PLoS One, 2009,4(2):1-18.
[23] Lee JC, Cho GS, Kim IH, et al. p63 Expression in the gerbil hippocampus following transient ischemia and effect of ischemic preconditioning on p63 expression in the ischemic hippocampus[J]. Neurochem Res, 2015,40(5):1013-1022.
[24] 廖常莉,周述芝,張英,等.p63與大鼠全腦缺血后神經元凋亡的關系及肢體缺血后處理對p63表達的影響[J].臨床與實驗病理學雜志,2012,28(12):1351-1355.
[25] Sun M, Yamashita T, Shang J, et al. Acceleration of TDP43 and FUS/TLS protein expressions in the preconditioned hippocampus following repeated transient ischemia[J]. J Neurosci Res, 2014,92(1):54-63.
[26] Sun XC, Xian XH, Li WB, et al. Activation of p38 mapk participates in brain ischemic tolerance induced by limb ischemic preconditioning by up-regulating hsp 70[J]. Exp Neurol, 2010,224(2):347-355.
[27] Choi KH, Park MS, Kim HS, et al. Alpha-lipoic acid treatment is neurorestorative and promotes functional recovery after stroke in rats[J]. Molecular Brain, 2015,8:9.
[28] 張永輝,汪永新,劉輝,等.肢體缺血預處理對腦梗死后大鼠海馬神經干細胞激活增殖的研究[J].新疆醫(yī)科大學學報,2009,32(5):592-597.
[29] Zhou Y, Fathali N, Lekic T, et al. Remote limb ischemic postconditioning protects against neonatal hypoxic-ischemic brain injury in rat pups by the opioid receptor/akt pathway[J]. Stroke, 2011,42(2):439-444.
[30] Cohen MV, Yang XM, Liu GS, et al. Acetylcholine, bradykinin, opioids, and phenylephrine, but not adenosine, trigger preconditioning by generating free radicals and opening mitochondrial K(ATP) channels[J]. Circ Res, 2001,89(3):273-278.
[31] 沈佳,孫麗娜,吳莉萍,等. mito KATP和κ-阿片受體介導肢體缺血后處理對抗大鼠腦缺血/復灌損傷[J].中國應用生理學雜志,2009,25(3):368-372.
[32] Sun J, Tong L, Luan Q, et al. Protective effect of delayed remote limb ischemic postconditioning: role of mitochondrial k(atp) channels in a rat model of focal cerebral ischemic reperfusion injury[J]. Cereb Blood Flow Metab, 2012,32(5):851-859.
[33] Li S, Ma C, Shao G, et al. Safety and Feasibility of Remote Limb Ischemic Preconditioning in Patients With Unilateral Middle Cerebral ArteryStenosis and Healthy Volunteers[J]. Cell Transplant, 2015,24(9):1901-1911.
[34] Li SQ, Li WB, Zhang M, et al. The role of neuroglobin in the neuroprotection of limb ischemic preconditioning in rats[J]. Mol Neurobiol, 2013,47(1):197-208.
[35] Burda R, Danielisova V, Gottlieb M, et al. Delayed remote ischemic postconditioning protects against transient cerebral ischemia/ reperfusion as well as kainate-induced injury in rats[J]. Acta Histochem, 2014,116(6):1062-1067.
收稿日期:(2015-07-03)
通信作者:王福文
基金項目:國家科技重大專項子課題(2009ZX09301-013)。
中圖分類號:R96;R971
文獻標志碼:A
文章編號:1002-266X(2015)47-0101-04
doi:10.3969/j.issn.1002-266X.2015.47.040

