沙棘籽粕原花青素制備、體外抗氧化及細胞活力評價
張佳嬋,王昌濤,孫寶國,曲悠歌
(1.天津科技大學食品工程與生物技術學院,天津 300457;2.北京食品營養與人類健康高精尖創新中心 北京工商大學,北京 100048;3.植物資源研究開發北京市重點實驗室 北京工商大學,北京 100048;4.食品添加劑與配料北京高校工程研究中心 北京工商大學,北京 100048)
?
沙棘籽粕原花青素制備、體外抗氧化及細胞活力評價
張佳嬋1,2,王昌濤2,3,孫寶國2,4,*,曲悠歌3
(1.天津科技大學食品工程與生物技術學院,天津 300457;2.北京食品營養與人類健康高精尖創新中心 北京工商大學,北京 100048;3.植物資源研究開發北京市重點實驗室 北京工商大學,北京 100048;4.食品添加劑與配料北京高校工程研究中心 北京工商大學,北京 100048)
本實驗優化了沙棘籽粕原花青素的提取方法,條件為80%乙醇,提取溫度35 ℃,液料比8∶1 mL/g,時間1.5 h,pH3.0,在該條件下的原花青素提取率為(97.31±0.48) mg/g沙棘籽粕;對提取得到的原花青素提取物進行了DPPH自由基和羥自由基清除能力實驗,并分析得到IC50,發現沙棘籽粕原花青素提取物的DPPH自由基清除能力較維生素C強;羥自由基清除能力較弱;MTT法測定了沙棘籽粕原花青素提取物對小鼠B16黑色素瘤細胞活力的抑制作用,分析得到24、48、72 h處理時間下提取物IC50分別為542.78、199.25、82.58 μg/mL。結論:沙棘籽粕提取物對小鼠B16黑色素瘤細胞具有一定的抑制作用,隨著劑量和時間的增加,呈逐漸增強的趨勢。
沙棘籽粕原花青素,抗氧化,細胞活力
沙棘(HippophaerhamnoidesL.),主要存在于亞歐大陸,是我國西部生態治理的優選植物。大量研究證實了沙棘具有抗炎、抗癌[1-3]等功效。沙棘籽粕是沙棘籽經過脫油處理后的副產物,N A Ushakova等人[4]研究發現沙棘籽粕中含有較多纖維素、半纖維素等物質,一般作為飼料或廢棄物丟棄,造成了資源的浪費。前期研究發現原花青素是沙棘籽粕中最主要的極性活性成分,且含量較高,若能將沙棘籽粕中的活性成分原花青素提取并加以利用,將顯著提高沙棘籽粕的利用價值,提高經濟效益。
很多食源性的原花青素可以在日常生活中被人們所攝取,并且具有很強的生物活性,如降血糖[5]、抗癌[6]、預防心血管疾病[7]等。沙棘原花青素的功效作用也引起了少量研究者的重視:Heejin Kim[8]發現沙棘籽水提物具有潛在的預防皮膚光老化的功效;在C Widen[9]的研究中,沙棘具有比其他漿果更好的保護紅細胞免受氧化應激損害的功效;Manimaran Manickam[10]還發現沙棘水提物還可以通過影響JAK/STAT信號通路來減輕神經細胞免受缺氧損害。由于文獻中沙棘原花青素是從沙棘果實中提取得到,有別于沙棘籽粕原花青素的提取位置,可能含有不同種類或配比的原花青素,所以初步探索沙棘籽粕中的原花青素功能特性也具有一定的意義。
本實驗優化了沙棘籽粕原花青素的提取方法,并對提取后的原花青素粗提物進行了化學抗氧化功效評價及細胞實驗,探索了沙棘籽粕原花青素提取物對DPPH自由基和羥自由基的清除能力,以及對小鼠B16黑色素瘤細胞活力的抑制作用,本實驗的完成為沙棘籽粕原花青素的更深一步的功效研究奠定基礎。
1 材料與方法
1.1 材料與儀器
沙棘籽粕 青海康普生物科技股份有限公司;蘆丁、原花青素 中國藥品生物制品檢定所;亞硝酸鈉、硝酸鋁、氫氧化鈉、無水乙醇、鹽酸、鄰二氮菲 北京化工廠;抗壞血酸(分析純≥99.7%) 國藥集團化學試劑有限公司;DPPH(1,1-二苯基苦基苯肼)、胰酶(1∶250) 美國Sigma Aldrich公司;DMEM培養基、新生牛血清、PBS、1×105U/L青霉素、100 mg/L鏈霉素 美國GIBCO生命技術公司;小鼠黑色素瘤細胞株B16 中國醫學科學院基礎醫學研究所細胞資源中心。
BS2202S型電子天平 北京賽多利斯儀器系統有限公司;DSHZ-300恒溫水浴振蕩器 江蘇省太倉市實驗設備廠;2-16N型醫用高速離心機 湖南恒諾儀器設備有限公司;Elx-808型酶標儀 美國Bio-Tek公司;T6 新世紀紫外可見分光光度計 北京普析通用儀器有限公司。
1.2 實驗方法
1.2.1 原花青素含量的測定 原花青素含量的測定方法參考相關文獻[10],并做適當修改。
標準曲線的繪制:準確配制1 mg/mL濃度的原花青素-甲醇標準溶液作為母液。分別量取0.25、0.5、1、1.5、2、2.5 mL母液于6只離心管中,再分別量取4.75、4.5、4、3.5、3、2.5 mL甲醇溶液將6個不同濃度標準樣品補齊至5 mL。所得六種濃度的標準溶液分別為0.05、0.1、0.2、0.3、0.4、0.5 mg/mL。再取6只離心管,分稱取不同濃度標準溶液0.5 mL,各加入2.5 mL 3%香草醛-甲醇溶液及2.5 mL 30%硫酸的甲醇溶液。30 ℃水浴反應20 min。測定500 nm下吸光度值。制定濃度與吸光度值的標準曲線。用0.5 mL甲醇代替標準溶液重復操作,作為參比液。
樣品的測定:取待測樣品0.5 mL于離心管,分別加入2.5 mL 3%香草醛-甲醇溶液及2.5 mL 30%硫酸的甲醇溶液。30 ℃水浴反應20 min。測定500 nm下吸光度值。對應標準曲線計算待測樣品中原花青素含量。
1.2.2 沙棘籽粕原花青素提取溶劑的選擇 固定提取溫度40 ℃、液料比6∶1 mL/g、自然pH(pH為5~5.5),提取時間2 h,轉速120 r/min,選擇文獻報道的常見[10]提取溶劑丙酮、甲醇、乙醇為研究對象,探討0、20%、40%、60%、80%、100%這六種濃度對提取率的影響。設置三組平行。
1.2.3 沙棘籽粕原花青素提取工藝的單因素實驗 液料比單因素實驗:設置液料比分別為6∶1、10∶1、15∶1、20∶1、25∶1 mL/g,固定乙醇濃度為80%,提取溫度40 ℃,提取時間2.0 h,自然pH(pH為5~5.5),將提取液減壓抽濾后定容到100 mL容量瓶中,混合均勻后測定原花青素含量。設置三組平行。
溫度單因素實驗:將提取溫度分別設定為20、30、40、50、60 ℃,固定乙醇濃度80%,提取時間2.0 h,液料比6∶1 mL/g,自然pH(pH為5~5.5),將提取液減壓抽濾后定容到100 mL容量瓶中,混合均勻后測定原花青素含量。設置三組平行。
提取時間單因素實驗:固定因素乙醇濃度80%,提取溫度40 ℃,液料比6∶1 mL/g,自然pH(pH為5~5.5)時,提取時間分別為1.0、2.0、3.0、4.0、5.0 h,將提取液減壓抽濾后定容到100 mL容量瓶中,混合均勻后測定原花青素含量。設置三組平行。
提取pH單因素實驗:固定因素乙醇濃度80%,提取溫度40 ℃,液料比6∶1 mL/g,提取時間2.0 h,提取pH分別為3.0、4.0、5.0、6.0、7.0,將提取液減壓抽濾后定容到100 mL容量瓶中,混合均勻后測定原花青素含量。設置三組平行。
1.2.4 沙棘籽粕原花青素乙醇提取工藝的正交實驗 在單因素實驗的基礎上,選取考察的四個單因素進行正交設計,按照正交設計表格(表1)進行實驗,并測定原花青素含量。
表1 正交實驗因素水平表
Table 1 Orthogonal factor level table

水平因素A溫度(℃)B液料比(mL/g)C時間(h)DpH1258∶1152523010∶1203033512∶12535
1.2.5 DPPH自由基清除實驗 DPPH自由基清除實驗方法參照文獻[11],并做適當修改。
取1.5 mL待測液加入到1.5 mL 2×10-4mol/L DPPH溶液中,迅速混勻,室溫下避光靜置30 min后于517 nm下測吸光度值,記錄為A1。
取1.5 mL無水乙醇加入到1.5 mL 2×10-4mol/L DPPH溶液中,迅速混勻,室溫下避光靜置30 min后于517 nm下測吸光度值,記錄為A2。
取1.5 mL 無水乙醇加入到1.5 mL待測液中,迅速混勻,室溫下避光靜置30 min后于517 nm下測吸光度值,記錄為A3。
DPPH自由基清除率的計算公式為:
清除率(%)=100%×(A2+A3-A1)/A2
1.2.6 羥自由基清除實驗 羥自由基清除實驗參照文獻[12-13],并做適當修改。取0.5 mL 0.75 mmol/L鄰二氮菲無水乙醇溶液于試管中,依次加入1 mL 0.15 mol/L磷酸鹽緩沖溶液(PBS,pH7.40)和0.5 mL蒸餾水,充分混勻后,加入0.5 mL 0.75 mmol/L硫酸亞鐵溶液(FeSO4),混勻后,加入0.5 mL 0.01%雙氧水(H2O2),于37 ℃水浴60 min后,在536 nm測其吸光值,所得數據為損傷管吸光度A損傷。未損傷管以0.5 mL蒸餾水代替損傷管中的0.5 mL 0.01%雙氧水,操作方法同損傷管,可測得536 nm未損傷管的吸光度值A未損傷。樣品管以0.5 mL樣品代替損傷管中的0.5 mL蒸餾水,操作方法同損傷管,可測得536 nm樣品管中的吸光度A樣品。
按照下式計算樣品對·OH的清除率:
清除率I(%)=(A樣品-A損傷)/(A未損傷-A損傷)×100
1.2.7 粗提原花青素凍干粉的制備 采用正交實驗所得的最優實驗方法進行原花青素的提取,對所得原花青素進行冷凍干燥,條件為-80 ℃,0.03 mbar,48 h。由此得到沙棘籽粕原花青素粉末。
1.2.8 粗提原花青素的抗氧化活性 將粗提原花青素凍干粉配制不同濃度的粗提原花青素溶液,對不同濃度原花青素溶液分別進行DPPH自由基和羥自由基清除率實驗。
1.2.9 細胞與細胞培養 小鼠黑色素瘤細胞株B16培養于含10%新生牛血清、1×105U/L青霉素、100 mg/L鏈霉素的DMEM培養基,置于37 ℃、5% CO2飽和濕度的培養箱中,以0.05%胰酶消化傳代。
1.2.10 MTT法檢測粗提原花青素對小鼠B16細胞活力的影響 實驗方法參照文獻[14],并做適當修改。取對數生長期B16細胞以0.05%胰酶消化、細胞培養液制備成單細胞懸液,接種于96孔細胞培養板中,每孔100 μL、5000個細胞,過夜后每孔加入100 μL含不同濃度樣品的培養液或空白對照組培養液,實驗設置調零組、細胞對照組、實驗組。實驗組粗提原花青素培養液濃度分別為454.45、90.91、45.45、9.09、4.55 μg/mL,每組至少6個平行孔。37 ℃、5% CO2條件下培養,分別處理24、48、72 h。常規方法加入5 mg/mL MTT溶液處理,DMSO溶解,37 ℃孵育10 min,測定490 nm下吸光度值。
細胞活力(%)=(實驗組-調零組)/(細胞對照組-調零組)×100
1.3 數據處理

2 結果與分析
2.1 沙棘籽粕主要成分測定
表2為沙棘籽粕主要成分及活性物質含量表,依照國標GB/T 18868-2002《飼料中水分、粗蛋白質、粗纖維、粗脂肪、賴氨酸、蛋氨酸快速測定 近紅外光譜法》測定沙棘籽粕中的粗蛋白質、粗纖維、粗脂肪含量,分別為17.90±0.47、11.20±0.78、6.74±0.78 g/100 g干物質;依照GB/T 5009.88-2008《食品中膳食纖維的測定》測定沙棘籽粕總膳食纖維含量,為(33.20±1.47) g/100 g干物質。數據分析發現,沙棘籽粕纖維類物質含量較多,高達45%。此外,還含有其他未知成分約31 g/100 g干物質。
表2 沙棘籽粕主要成分含量
Table 2 Chemical compounds of seabuckthorn seed residues

項目含量(g/100g干物質)粗脂肪674±078粗蛋白質1790±047粗纖維1120±078總膳食纖維3320±147
2.2 提取溶劑的篩選
丙酮、乙醇、甲醇是常用的活性成分提取溶劑,三者均可不同程度的滲透植物細胞,使原花青素溶出。圖1顯示不同提取溶劑在不同濃度下提取原花青素的結果。丙酮、乙醇、甲醇隨著溶劑濃度的逐漸升高(0%~80%范圍),均有利于原花青素的提取,當100%純溶劑提取時,僅有甲醇的提取率較高,乙醇和丙酮下降迅速,且以丙酮下降幅度最大。該結果與紅蓮外皮原花青素的提取[15]結果略有不同,彭芳剛在研究紅蓮外皮原花青素的提取工藝時,同樣考察了該三種提取溶劑,結果發現:在一定范圍內,均隨著濃度的升高而提取效果增強,但是濃度大于80%時,提取效果驟然下降;但是與本論文結果相異的是,丙酮的提取效果為最好。這可能是由于研究對象的不同,沙棘籽粕的主要物質及結構與紅蓮外皮差異較大,故與溶劑的作用機制不同。因此,本論文同時考慮到甲醇毒性較高,且乙醇為溶劑提取原花青素的得率也已達到80 mg/g,處于較高水平,所以選擇80%乙醇為提取溶劑,進行后續實驗。

圖1 提取溶劑及濃度對原花青素含量的影響Fig.1 Effect of extraction solutions and concentration on proanthocyanidin content
2.3 多種因素對沙棘籽粕原花青素提取效果的影響
2.3.1 提取時間對沙棘籽粕原花青素提取效果的影響 圖2顯示為不同提取時間對沙棘籽粕原花青素的提取效果的影響,由結果可以看出,提取時間在2 h時,已達到最高水平,隨后時間繼續延長不會提高原花青素的含量,因此選擇2 h作為后續實驗的提取時間。

圖2 提取時間對原花青素含量的影響Fig.2 Effect of extraction time on proanthocyanidin content注:字母表示原花青素含量的差異性;字母不同表示差異顯著(p<0.05),圖3~圖5同。
2.3.2 提取pH對沙棘籽粕原花青素提取效果的影響 圖3為不同提取pH(3.0、4.0、5.0、6.0、7.0)對沙棘籽粕原花青素的提取效果的影響,隨著pH的升高,提取效果下降,這可能是由于原花青素含有較多的酚羥基,在酸性條件下更有助于保持結構穩定。彭芳剛[15]在研究紅蓮外皮原花青素時,也選擇pH3.0為研究條件,其認為酸性條件下有利于原花青素的溶出。所以本項目選擇pH3.0為后續實驗條件。

圖3 提取pH對原花青素含量的影響Fig.3 Effect of extraction pH on proanthocyanidin content
2.3.3 提取溫度對沙棘籽粕原花青素提取效果的影響 本項目探討了不同提取溫度對原花青素提取效果的影響,隨著提取溫度的升高,分子運動速度加快,滲透、擴散以及溶解的速度提高,一般活性成分的提取率也隨之增加[15]。該規律可以解釋提取溫度<30 ℃時,原花青素提取含量升高的現象。但是,隨著溫度的升高,由于原花青素不穩定,使提取效果下降[16],因此選擇30 ℃為后續實驗反應條件。

圖4 提取溫度對原花青素含量的影響Fig.4 Effect of reaction temperature on proanthocyanidin content
2.3.4 液料比對沙棘籽粕原花青素提取效果的影響 圖5為不同液料比(mL/g)對原花青素提取效果的影響。圖5可知,液料比在10∶1、15∶1、20∶1、25∶1時均保持較高的DH,且水平之間無顯著性差異。所以選取液料比為10∶1,作為后續實驗條件。
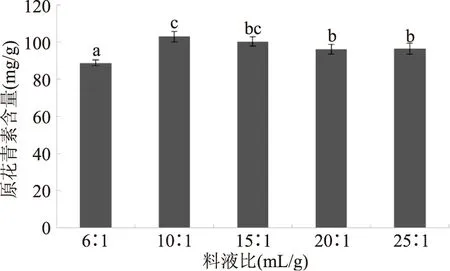
圖5 液料比對原花青素含量的影響Fig.5 Effect of the ratio of liquorto material on proanthocyanidin content
2.4 正交實驗優化沙棘籽粕原花青素提取工藝條件
根據單因素實驗結果,分別對溫度、液料比、時間、提取pH進行正交實驗設計。實驗設計結果及數據分析表如表3所示。四個因素對沙棘籽粕原花青素提取效果的影響為:A>D>C>B(溫度>提取pH>時間>液料比)。最佳提取因素組合為:A3B1C1D2。因此,沙棘籽粕提取原花青素的最優工藝為提取溶劑80%乙醇,提取溫度35 ℃、液料比8∶1、時間1.5 h、pH3.0。
表3 正交實驗結果及數據分析表
Table 3 Orthogonal Test Results

實驗號A溫度(℃)B液料比(mL/g)C時間(h)D提取pH原花青素含量(mg/g)1111148.732122255.493133360.734212372.795223160.306231287.357313296.158322383.569332161.96K154.9872.5673.2157.00K273.4866.4563.4179.66K380.5670.0172.3972.36R25.586.119.8022.67
表4 正交實驗結果驗證
Table 4 Verification Results of Orthogonal Test

實驗條件沙棘籽粕原花青素提取實驗液料比(mL/g)8∶1提取溫度(℃)35提取時間(h)1.5pH3.0乙醇濃度(%)80提取量(mg/g)97.31±0.48
2.5 優化條件的結果驗證
將以上優化的反應條件進行3組驗證實驗,提取結果為(97.31±0.48) mg/g(表4),表明正交實驗優化的工藝條件可行。
2.6 抗氧化活性研究
常用體外抗氧化測定方法可分為4類:活性氧自由基清除能力;基于氫原子轉移(HAT)的檢測方法;基于 SET 反應機制的抗氧化實驗方法;金屬離子螯合法[12]。基于不同的抗氧化機理以及實驗室的實驗條件,本課題選擇了兩種實驗機理(基于活性氧自由基清除能力和基于SET反應機制)的自由基清除方法對所得樣品進行測定。圖6、圖7分別為不同濃度原花青素凍干粉對DPPH自由基和羥自由基清除能力的結果。以維生素C為陽性對照,對比了兩者的抗氧化性區別,從圖6對DPPH的結果來看,沙棘籽粕原花青素凍干粉表現出較高的清除能力,且隨著濃度的增加,清除能力呈遞增趨勢,通過計算提取物IC50為0.11 mg/mL,維生素C的IC50為0.25 mg/mL;而清除羥自由基的能力較低。馬翠蘭在藍莓葉片藍莓葉片原花青素清除自由基能力的研究中發現,藍莓葉片原花青素不僅可以顯著清除DPPH自由基,也具有羥自由基清除能力,且以維生素C為對照,其羥自由基清除能力高于維生素C[17]。由此可見,推測原因可能是原花青素的組成成分及結構的差異也會造成其抗氧化性能的不同。本項目所得的沙棘籽粕原花青素凍干粉,具有較強的基于SET反應機制的自由基清除能力。

圖6 不同濃度原花青素提取物對DPPH自由基的清除能力Fig.6 DPPH free radical scavenging rates of proanthocyanidin freeze-dried powder

圖7 不同濃度原花青素提取物對羥自由基的清除能力Fig.7 OH free radical scavenging rates of proanthocyanidin freeze-dried powder
2.7 沙棘籽粕原花青素對B16細胞活性的研究
本實驗用不同濃度沙棘籽粕原花青素凍干粉處理對數生長期小鼠B16黑色素瘤細胞,處理時間分別為24、48、72 h,結果見圖8。三種處理條件下樣品刺激B16細胞的IC50結果見表5。由圖8所示,三種處理時間下,小鼠B16細胞活力均隨著樣品濃度的降低呈上升趨勢,說明較高濃度的沙棘籽粕原花青素對B16細胞有一定的抑制作用。隨著處理時間的延長,細胞耐受相同濃度的樣品能力下降:24 h處理時間,B16細胞活力為50%時,原花青素含量為542.78 μg/mL,48 h時,IC50為199.25 μg/mL,72 h下,細胞活力在50%時的IC50低至82.58 μg/mL。

圖8 不同濃度原花青素提取物對B16細胞活力的影響Fig.8 B16 Cell viability of proanthocyanidin freeze-dried powder注:A:處理細胞24 h;B:處理細胞48 h;C:處理細胞72h。

項目處理時間(h)IC50(μg/mL)12454278248199253728258
3 結論
本實驗以副產物沙棘籽粕為研究對象,優化沙棘籽粕原花青素的提取條件,并初步分析沙棘籽粕原花青素的抗氧化功效,同時進行了對B16細胞的抑制活性實驗。實驗結果顯示,沙棘籽粕原花青素具有清除DPPH自由基的功效,清除效果優于維生素C。72 h作用時間處理B16細胞的IC50為82.58 μg/mL(即82.58 mg/L),高于文獻報道蓮房原花青素對B16細胞的半數抑制率32.4 mg/L[18],說明本實驗所得沙棘籽粕原花青素粗品比蓮房原花青素對B16細胞的刺激程度較低;本實驗沙棘籽粕原花青素24 h作用時間處理B16細胞的IC50為542.78 μg/mL,低于文獻報道的楊梅葉原花青素的IC50,文獻報道楊梅葉原花青素在50 mg/mL時得細胞活力為68.28%[19]。這又揭示了本實驗所得沙棘籽粕原花青素比楊梅葉原花青素對B16細胞的刺激程度強。因此,為了更全面和透徹的分析本實驗所得樣品的安全性和功效性,需進行進一步的實驗。
[1]Suryakumar G,Gupta A.Medicinal and therapeutic potential of Sea buckthorn(HippophaerhamnoidesL.)[J].Journal of Ethnopharmacology,2011,138:268-278.
[2]Wani T A,Wani S W,Ahmad M,et al.Bioactive profile,health benefits and safety evaluation of sea buckthorm(Hippophae rhamnoides L.):A review[J].Cogent Food and Agriculture,2016,2:1128519
[3]Wolfgang H,Peter S.Analysis of proanthocyanidins[J]. Molecular Nutrition & Food Research. 2008,52:1381-1398.
[4]Ushakova N A,Brodskii E S,Kozlova A A,et al.Anaerobic solid-phase fermentation of plant substrates by Bacillus subtilis
[J].Applied Biochemistry and Microbiology,2007,45(1):61-67.
[5]Zhang H,Yang Y,Ma C,et al. Structures and antioxidant and intestinal disaccharidase inhibitory activities of A-type proanthocyanidins from peanut skin[J]. Journal of Agricultural and Food Chemistry,2013,61(37):8814-8820.
[6]Serra A T,Rocha J,Sepodes B,et al. Evaluation of cardiovascular protective effect of different apple varieties-correlation of response with composition[J]. Food Chemistry,2012,135(4):2378-2386.
[7]Nishizuka T,Fujita Y,Sato Y,et al. Procyanidins are potent inhibitors of LOX-1:a new player in the French Paradox[J]. Proceedings of the Japan Academy. Series B,Physical and Biological Sciences,2011,87(3):104-108.
[8]Kim H,Cho H,Seo Y K,et al. Inhibitory Effects of Sea Buckthorn(HippophaerhamnoidesL.)Seed on UVB-induced Photoaging in Human Dermal Fibroblasts[J]. Biotechnology and Bioprocess Engineering,2012,17:465-474.
[9]Widen C,Coleman M D,Renvert S,et al. Protection of human erythrocytes against oxidative stress by berries[J]. Journal of Berry Research,2012,2:159-167.
[10]Manickam M,Tulsawani R. Survival Response of Hippocampal Neurons under Low Oxygen Conditions Induced by Hippophae rhamnoides is Associated with JAK/STAT Signaling[J]. Plos One,2014,9(2):e87694.
[11]孫蕓,谷文英.硫酸-香草醛法測定葡萄籽原花青素含量[J].食品與發酵工業.2003,29(9):43-46.
[12]張佳嬋,謝婭霏,虞旦,等.玫瑰花及花渣中黃酮類物質的提取及其抗氧化活性研究[J].食品工業科技,2014,(22):226-230.
[13]劉文穎,徐亞光,任瑋.三文魚皮膠原肽體外抗氧化活性研究[J].食品科技,2010,35(12):86-89.
[14]林菁,彭華毅.黃癸素誘導小鼠黑色素瘤B16細胞凋亡的研究[J].中國藥理學通報,2010,26(12):1630-1634.
[15]彭芳剛,李綺麗,吳衛國.響應面法優化紅蓮外皮原花青素的提取工藝研究[J].現代食品科技,2013,29(6):1349-1354,1315.
[16]史經略,張安寧,王傳榮.響應面法優化葡萄籽中原花青素提取[J].食品研究與開發,2011,32(10):187-192.
[17]劉靜.藍莓葉片原花青素的提取、分離及抗氧化活性研究[D].福州:福建農林大學,2014.
[18]段玉清,周密,張海暉,等.蓮房原花青素對黑色素瘤B16細胞的抑制作用[J].中國藥學雜志,2009,44(2):103-106.
[19]傅瑜.楊梅葉原花色素的結構鑒定以及對黑色素生成和細胞凋亡的作用研究[D].杭州:浙江大學,2015.
Technological conditions,antioxidant activities in vitro and cell viability of the proanthocyanidins extracted from seabuckthorn(Hippophae rhamnoides L.)seed residues
ZHANG Jia-chan1,2,WANG Chang-tao2,3,SUN Bao-guo2,4,*,QU You-ge3
(1.College of Food Engineering and Biotechnology,Tianjin University of Science and Technology,Tianjin 300457,China; 2.Beijing Key Laboratory of Plant Resources Research and Development,School of Science of Beijing Technology and Business University,Beijing 100048,China; 3.Beijing Advanced Innovation Center for Food Nutrition and Human Health,Beijing Technology and Business University,Beijing 100048,China; 4.Beijing Higher Institution Engineering Research Center of Food Additives and Ingredients, School of Food and Chemical Engineering of Beijing Technology and Business University,Beijing 100048,China)
The optimal conditions of proanthocyanidins extracted from seabuckthorn(HippophaerhamnoidesL.)seed residues were obtained by orthogonal test,on the basis of one factor tests. The optimal condition of ethanol extraction was ethanol concentration 80%,temperature 35 ℃,liquid to solid ratio 8∶1 mL/g,extraction time 1.5 h,pH3.0. Under this condition,proanthocyanidins was 97.31±0.48 mg/g seabuckthorn(HippophaerhamnoidesL.)seed residues. Antioxidant activities were tested,using crude extract lyophilized power. Antioxidant activities of proanthocyanidins extracted from seabuckthorn(HippophaerhamnoidesL.)seed residues were investigated with the method of scavenging hydroxyl and DPPH. IC50was calculated. Results indicated that the proanthocyanidin extracts had higher antioxidant activity than vitamin C on the scavenging ability of DPPH. The ability on scavenging hydroxyl was low. Methods MTT assay was employed to determine the cell viability of proanthocyanidin extracts in B16 cells. The IC50was 542.78,199.25 and 82.58 μg/mL when B16 cells was exposed for 24,48,and 72 h,respectively.It was suggested that the B16 cell viability followed the dose-and time-dependent manner.
proanthocyanidins extracted from sea buckthorn(HippophaerhamnoidesL.)seed residues;antioxidant activity;cell viability
2016-05-16
張佳嬋(1987-),女,博士生,研究方向:食品生物技術,E-mail:xiaochan8787@163.com。
*通訊作者:孫寶國(1961-),男,博士,教授,研究方向:食品香料與風味化學,E-mail:sunbg@btbu.edu.cn。
質檢公益性行業科研專項(201310132);質檢公益性行業科研專項(201410019)。
TS202.3
A
1002-0306(2016)23-0103-06
10.13386/j.issn1002-0306.2016.23.011

